D-青霉胺的膳食剂量对大鼠体内铜锌代谢水平的影响
徐 虹, 青山赖孝, 宋焕禄
(1.北京工商大学 化学与环境工程学院/食品添加剂与配料北京高校工程研究中心, 北京 100048; 2.日本名古屋文理大学 健康生活学部, 日本爱知县 492-8520)
D-青霉胺是一种含巯基氨基酸,具有螯合金属离子的能力,尤其是铜离子. 它能有效地去除体内多余的铜离子而被用于人类Wilson病——一种遗传性的异常铜代谢疾病的治疗[1-2]. D-青霉胺也能很好地用于缓解肝脏中铜异常积聚的LEC大鼠的肝炎症状[3-4]. 目前对于D-青霉胺药性研究的动物试验常用方法是将D-青霉胺溶解于去离子水中,以每天10 mg/100 g体重的剂量喂饲[3-10]. 然而,强迫实验动物每天饮用D-青霉胺口服液并不容易. 因此,本实验将口服D-青霉胺混合在膳食成分中让实验大鼠通过摄食自然摄取,旨在寻求一种更为简便和人道的治疗途径,并探讨其有效移除大鼠体内铜离子的最适膳食剂量. 同时,本实验还比较了铜和锌这两种微量元素在体内的代谢途径.
1 材料与方法
1.1 实验动物分组及给药
本实验严格遵守日本实验动物管理委员会制定的实验动物管理条例. SPF级Fischer大鼠42只,雄性,体重(99±2) g,购自日本静冈滨松市SLC株式会社,分别单独饲养于不锈钢鼠笼. 动物房始终保持23 ℃左右以及12 h循环光照(每天早8:00亮灯,晚8:00熄灯). 实验开始的前3 d,所有大鼠自由摄取空白膳食和饮用普通水以适应新环境. 三天后,42只大鼠根据体重被分成7组(每组6只)并被分别喂饲空白膳食或添加质量浓度分别为0.1%,0.2%,0.3%,0.4%,0.5%,1.0% D-青霉胺的膳食组和去离子水. 实验膳食配方如表1. 整个饲养期间,每日测量每只大鼠的体重和摄食量. 并于实验第7至9 d用代谢笼收集72 h尿液. 16 d实验期结束后,大鼠被断头宰杀并取血样. 肝脏被迅速移取、称重并入液氮冷冻. 血样经3 000×g速度离心后移取血清样品. 最后所有肝脏和血清样品储藏于-80 ℃冷柜至各项生化指标测定分析.
1.2 金属含量及生化指标测定
1.2.1 铜与锌含量的测定
肝脏、血清及尿液中的铜锌含量由原子吸收分光光度计测定. 血清和尿液样品可直接测定,肝脏样品测定前取等量的份先用浓硝酸湿法灰化,然后用30%的过氧化氢彻底消化[11].
1.2.2 脂质的测定
肝脏和血清中的三酰甘油[12]、胆固醇[13]以及血清中的磷脂[14]含量分别用酶法测定. 肝总脂肪按Folch等所采用的方法提取和纯化[15]后用重量法测得. 然后,肝脏中的磷脂含量以[总脂肪含量-(三a表示购自新西兰威灵顿新西兰奶制品公司;b表示购自德国Sigma化学制剂公司;c表示购自日本大阪和光纯药工业株氏会社;d表示已糊化,购自日本爱知县中央食粮株氏会社.

表1 实验膳食配方
酰甘油含量+胆固醇含量)]差值计算获得. 最后,分别以885.4(三酰甘油中主要成分三油酸甘油酯的分子量)和786.1(磷脂中主要成分L-α-磷脂酰胆碱的分子量)作为三酰甘油和磷脂的分子量计算它们的摩尔浓度.
1.3 统计学分析
2 结果与分析
2.1 大鼠的生长指标测定
测定不同膳食组的大鼠生长指标,结果见表2. 由表2可以看出,0.1%,0.2%,0.3%和0.4%D-青霉胺组大鼠的摄食量和体重增长量与空白组的大鼠相比没有显著性差异,而0.5%D-青霉胺膳食组大鼠的摄食量和体重增长量比空白组明显降低,1.0%D-青霉胺膳食组则显著低于0.5%D-青霉胺膳食组. 但就鲜肝重而言,不同处理之间并没有明显差异.

表2 大鼠生长指标测定
注:a,b,c表示在同一纵向组中,带有不同角标字母的测定结果之间有显著差异(P<0.05).(下同)
2.2 大鼠肝脏中铜锌含量
测定不同膳食组的大鼠肝脏中铜锌含量,结果见表3. 由表3可知,0.1%,0.2%D-青霉胺膳食组的肝铜含量和空白组之间没有显著区别. 自从0.3%剂量开始,肝铜含量随着D-青霉胺的膳食剂量增高而显著递减,但在0.4%和0.5%D-青霉胺两组之间没有显著区别. 然而,实验组大鼠的肝锌含量却始终和空白组保持同一水平,并没有随剂量变化而变化.
2.3 尿液中铜锌含量
处理72 h后大鼠尿铜和锌含量在0.1%,0.2%D-青霉胺膳食组和空白组之间没有区别,见表4. 但自从0.3%剂量开始,尿铜含量显著增加,尤其是0.5%剂量时尿铜的排泄在各实验组达最高水平,1.0%D-青霉胺膳食组则低于0.5%实验组. 尿锌的排泄从0.3%剂量开始随剂量的增高而增高,在1.0%剂量时达最高水平.

表3 大鼠肝脏中铜锌含量

表4 大鼠尿液中铜锌含量
2.4 大鼠血清中铜锌含量
测定不同膳食组大鼠血清中铜锌含量,结果见表5. 由表5可以看出,血清铜和锌含量在0.1%,0.2%D-青霉胺组和空白组之间没有区别. 从0.3%剂量开始,血清中铜含量随着D-青霉胺的膳食剂量增高而显著递减,和肝铜的变化趋势一致. 血清中锌含量从0.2%剂量开始随剂量的增加而降低,至0.5%剂量水平血清中锌含量最低,但在1.0%剂量组和0.5%剂量组之间并没有显著区别.

表5 大鼠血清中铜锌含量
2.5 大鼠肝脏中脂肪含量
测定不同膳食组大鼠肝脏中脂肪含量,结果见表6. 由表6可知,各水平D-青霉胺的喂食没有影响大鼠肝脏中三酰甘油和胆固醇的含量,仅有1.0%剂量的D-青霉胺轻度降低了大鼠肝脏中磷脂的含量.

表6 大鼠肝脏中脂肪含量
2.6 大鼠血清中脂肪含量
测定不同膳食组大鼠血清中脂肪含量,结果见表7. 由表7可以看出,各水平D-青霉胺的喂食没有影响大鼠血清中磷脂和胆固醇的含量,但是0.5%和1.0%剂量的D-青霉胺不同程度地降低了血清中三酰甘油的含量.
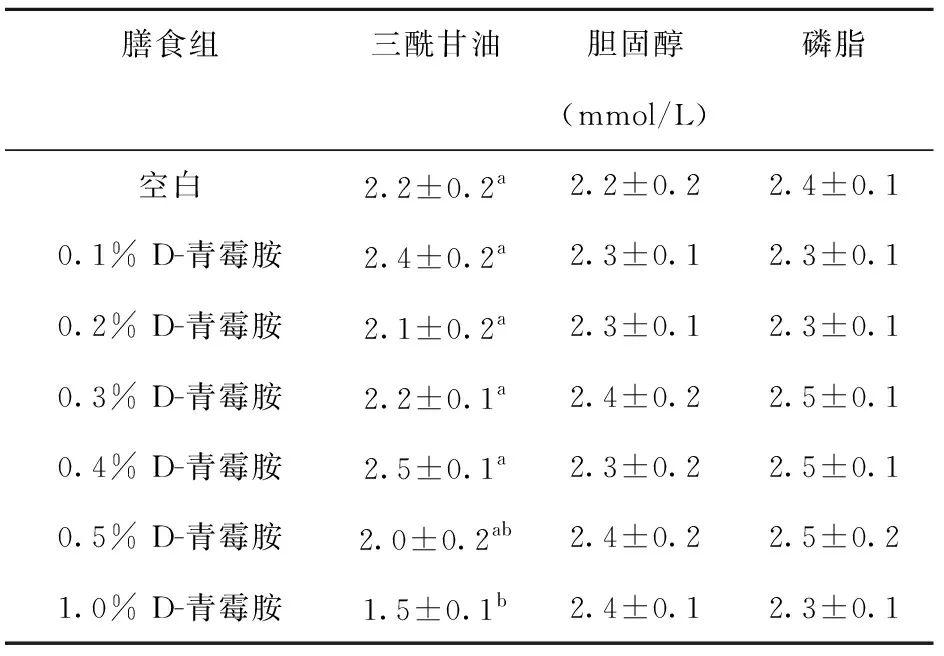
表7 大鼠血清中脂肪含量
3 讨论与结论
在本实验中,0.1%,0.2%,0.3%,0.4%,0.5%和1.0%六个不同水平的D-青霉胺膳食剂量被选择作为实验剂量. 按这些大鼠平均每日的摄食量为9.1 g/100 g体重计算,0.1%,0.2%,0.3%,0.4%,0.5%和1.0%各D-青霉胺膳食组的大鼠相当于每日摄入D-青霉胺的量分别为9.1 mg/100 g 体重、18.2 mg/100 g 体重、27.3 mg/100 g 体重、36.4 mg/100 g 体重、45.5 mg/100 g 体重和91.0 mg/100 g体重.
0.1%膳食组大鼠每日的D-青霉胺摄入量略低于常用的口服液剂量10 mg/100 g体重,而0.2%膳食组的大鼠每日D-青霉胺的摄入量则约为常用口服液剂量的1.8倍. 但是从实验结果可知,无论喂饲0.1%还是0.2%的实验膳食均没有对大鼠的食物摄入量、体重的增长、体内铜锌和脂肪水平造成任何影响. 0.3%和0.4%膳食剂量也没有影响大鼠的成长和体内脂肪代谢. 但是这两个剂量却把尿铜的排泄大幅度提高到空白组大鼠的3倍左右(表4),这个效果与LEC大鼠饮用10 mg/100 g体重D-青霉胺口服液一周的效果相当[3-4]. 随即,这两组大鼠的肝脏和血清中铜含量也显著下降(表3和表5). 当喂饲0.5%和1.0%膳食剂量时,体内的铜通过尿的排泄分别被提高到空白组大鼠的4.9和4.2倍(表4),显著地减少了肝脏和血清中的铜含量(表3和表5). 但同时,0.5%和1.0%膳食剂量也明显降低了实验动物的食欲,抑制了它们的生长(表2),不同程度地影响了体内脂肪的代谢(表6和表7). 尤其是在实验开始后,1.0%膳食剂量还引起了实验大鼠的腹泻症状(结果未列出).
综上所述,D-青霉胺膳食由于其他膳食成分的混合影响了D-青霉胺的吸收,致使低剂量(0.1%和0.2%)的实验膳食没有发挥效用;高剂量(0.5%和1.0%)实验膳食虽然达到了理想的降低体内铜含量的效果,但也引发了一些副作用;而中等剂量(0.3%和0.4%)实验膳食不仅可以显著地移除肝脏和血清中的铜元素,也没有给实验大鼠造成不良影响. 因此,虽然将口服D-青霉胺混合在膳食成分中所发挥的效力不及溶于水中明显,但由于其他膳食成分掩饰了D-青霉胺的不良口感,在整个实验过程中实验动物始终自觉自愿地摄取实验膳食,免除了强迫喂饲的痛苦,更为人道,仍不失为一种合理的治疗途径,而比较本实验的结果,我们认为0.3%~0.4%是D-青霉胺最适的膳食剂量.
此外,我们还发现,0.3%,0.4%,0.5%和1.0%D-青霉胺膳食组也激增了锌在尿液中的排泄(表4),并且也降低了血清中锌的含量,但是和铜元素不同,肝脏的锌含量却没有降低(表3). 这一发现和Aoyama等人[16]报道的当给大鼠喂饲过量组胺酸膳食所观察到的体内铜锌含量变化是相似的. 由此可见,铜和锌在大鼠体内的代谢途径并不完全一致,看起来似乎还有更微妙的机理控制着大鼠肝脏中的锌含量.

