3种非肌肉蛋白对竹荚鱼鱼糜凝胶特性的影响
陈海华,薛长湖
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.中国海洋大学食品科学与工程学院,山东 青岛 266003)
鱼糜制品加工过程中在50~60℃的温度带内常因肌原纤维蛋白的降解而引起凝胶形成能力下降,这种现象被称为凝胶劣化[1]。凝胶劣化的产生不仅影响鱼糜制品的弹性,更影响其商品价值。凝胶劣化现象是由于热激活蛋白酶作用于肌球蛋白重链而引起的[2-3]。引起凝胶劣化的两种主要的蛋白酶是丝氨酸蛋白酶和热稳定的碱性蛋白酶[4]。通过添加蛋白酶抑制剂或其他的添加剂,可降低鱼糜制品中组织蛋白酶的活性。非肌肉蛋白如大豆分离蛋白、鸡蛋清蛋白、乳清蛋白、猪血浆蛋白、牛血浆蛋白等,能抑制内源性热激活蛋白酶,从而改善各种鱼糜制品的质构特性[5-16]。大量研究表明非肌肉蛋白对长蛇鲻鱼糜、大眼海鲈鱼鱼糜、arro wtoo th flounder、太平洋无须鳕鱼糜、阿拉斯加狭鳕鱼糜等都有改善作用。非肌肉蛋白对不同级别鱼糜的凝胶特性可能影响不同。在高质量鱼糜中加入非肌肉蛋白质会降低其凝胶特性,而在低质量的鱼糜中加入这些蛋白质却能显著改善其凝胶特性[17-19]。但是大豆分离蛋白(soybean protein isolation,SPI)、谷朊粉(gluten powder,GP)和花生浓缩蛋白(peanut protein concentration,PPC)对竹荚鱼鱼糜凝胶化和凝胶劣化的影响研究较少。本研究主要探讨SPI、GP和PPC对竹荚鱼鱼糜凝胶特性的影响,以期为非肌肉蛋白在竹荚鱼鱼糜制品生产中应用提供参考。
1 材料与方法
1.1 材料与试剂
竹荚鱼(0.5kg,-30℃冻藏3个月) 浙江舟山市。
大豆分离蛋白(蛋白质含量≥90%,白度为76)、谷朊粉(蛋白质含量≥85%,白度为76) 青岛天新食品添加剂有限公司;花生浓缩蛋白(蛋白质含量≥72%,白度为73) 青岛长寿食品有限公司;三羟基氨基甲烷(Tris) 天津大茂试剂公司;三氯乙酸(TCA) 天津化学试剂厂;十二烷基硫酸钠(SDS)、尿素 中国医药集团上海化学试剂公司;β-巯基乙醇 上海化学试剂总厂;以上试剂均为分析纯。
1.2 仪器与设备
TMS-PRO质构仪 美国Food Technology公司;WSC-S型色差计 上海精密科学仪器有限公司;UMC5型真空斩拌机 德国Stephan公司;KYKY-2800B扫描电子显微镜 中国科学院科学仪器厂;电热恒温水浴锅金坛市荣华仪器制造有限公司。
1.3 方法
1.3.1 竹荚鱼冷冻鱼糜的制备
取冷冻竹荚鱼于4℃解冻,然后用冰水洗净后去头、去皮、去内脏、采肉,分别用3倍体积的冰水漂洗3次(每次10min)后脱水,精滤后加入抗冻剂(质量分数4%的山梨醇和质量分数4%的蔗糖),每袋500g分装,并于-20℃贮藏,备用,此为竹荚鱼冷冻鱼糜(水分含量为78%)。
1.3.2 竹荚鱼鱼糜蛋白凝胶的制备
将冻藏的冷冻竹荚鱼鱼糜500g,半解冻后用真空斩拌机在10℃以下空擂5min,添加质量分数2.5%的食盐继续盐擂15min,然后加入不同质量分数(0~10%)的非肌肉蛋白进一步擂溃5min;将鱼糜充填至直径为30mm的尼龙肠衣中,先在30℃条件下分别凝胶化0、1、3、5、7、9h,再在90℃加热20min;加热后立即置于冰水中冷却,再将其置于4℃静置过夜,待测。注意在鱼肠加热前应严格控制鱼糜的温度在10℃以下。
1.3.3 破断强度测定
将制备好的鱼肠从4℃取出,室温放置,使鱼肠温度平衡至室温,然后将其切成25mm长的片段,破断强度和凹陷度直接采用质构仪测定。采用直径为5mm的球形探头,以60mm/s的速度穿刺样品至20mm,穿刺曲线上的第一个峰即为破断强度,对应的距离为凹陷度。其中破断强度反映了鱼糜凝胶的硬度,凹陷度反映了鱼糜凝胶的弹性。二者的乘积即为凝胶强度[7],其计算如式(1)。每组实验重复5次,结果取其平均值。

式中:GS为凝胶强度/(g·mm);BF为破断强度/g;D为凹陷度/mm。
1.3.4 白度测定
将样品切成厚3mm的薄片,室温条件下用色差计测定样品的色泽,仪器采用标准白板校正,记录L*、a*、b*表示颜色的坐标,L*表示样品的亮度,a*表示样品偏红,-a*表示样品偏绿;b*表示样品偏黄,-b*表示样品偏蓝。白度(W)计算如式(2)[8]。每组实验重复5次,结果取其平均值。

1.3.5 持水性能测定
将样品切成厚3mm的薄片并称其质量(m1),下面放3张滤纸,上面放两张滤纸,用5kg的重物压制并保持2min,去掉滤纸,再将样品称其质量(m2),失水率如式(3)计算。每组实验重复5次,结果取其平均值。
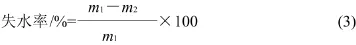
1.3.6 扫描电镜观察
将鱼糜凝胶样品切成小块,用体积分数为3%戊二醛溶液4℃条件下固定24h,再用0.1mol/L磷酸盐缓冲液(pH7.2)漂洗数次。然后用体积分数为1%的锇酸溶液固定2h,再用0.1mol/L磷酸盐缓冲液(pH7.2)漂洗数次。依次用体积分数为30%、50%、70%、90%和100%乙醇梯度脱水,最后用醋酸异戊酯脱乙醇,用临界点干燥仪干燥,再用离子溅射仪喷金后,用扫描电镜观察。
1.3.7 非肌肉蛋白对竹荚鱼鱼糜蛋白降解的抑制率
按照Visessanguan等[3]的方法检测非肌肉蛋白对鱼糜蛋白降解的抑制能力。取3g冷冻鱼糜,4℃放置2~3h后加入非肌肉蛋白至不同添加量。将鱼糜与非肌肉蛋白的混合物在50℃温浴1h,以促进凝胶劣化的进行,然后加入27mL 5g/100mL的冷TCA溶液,11000r/min均质处理2min。混合物在4℃静置15min后,将均质液在8000×g离心5min。采用Lowry法检测上清液中TCA-溶解肽的含量。根据式(4)计算非肌肉蛋白对鱼糜蛋白降解的抑制率。
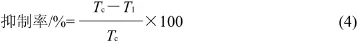
式中:Tc为对照鱼糜(不添加非肌肉蛋白)在50℃温浴后TCA-溶解肽含量;TI为样品鱼糜(添加非肌肉蛋白)在50℃温浴后TCA-溶解肽含量。
1.3.8 数据处理
采用SAS 8.0软件进行分析,利用Duncan多重比较对数据之间的显著性进行对比。
2 结果与分析
2.1 非肌肉蛋白对竹荚鱼鱼糜蛋白降解抑制率的影响
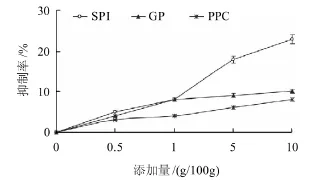
图1 添加不同非肌肉蛋白对竹荚鱼鱼糜蛋白降解抑制率的影响Fig.1 Inhibition effects of separately added non-muscle proteins against protein degradation in horse-mackerel surimi at 50 ℃
由图1可以看出,SPI添加量超过1g/100g鱼糜时,对竹荚鱼鱼糜蛋白的降解有一定的抑制作用;随着SPI添加量的增加,SPI对竹荚鱼鱼糜蛋白的降解抑制作用逐渐增大;添加量为10g/100g时,其抑制率为23%。随着GP、PPC添加量的增加,GP、PPC对竹荚鱼鱼糜蛋白的降解抑制作用均分别在1g/100g时达到最大值,而后变化较小;GP、PPC添加量为10g/100g时,其抑制率均低于10%。
2.2 非肌肉蛋白对竹荚鱼鱼糜凝胶质构的影响


图2 非肌肉蛋白添加量对竹荚鱼鱼糜凝胶质构特性的影响Fig.2 Effects of separately added non-muscle proteins on textural properties of horse-mackerel surimi gel
从图2可以看出,添加GP和SPI能提高竹荚鱼鱼糜凝胶的破断强度、凹陷度和凝胶强度。从破断强度看,随着GP添加量的增加,竹荚鱼鱼糜凝胶的破断强度逐渐增强;当添加量为10g/100g时,凝胶的破断强度为562g,比对照(未添加非肌肉蛋白的样品)增加了21%。随着SPI添加量的增加,凝胶的破断强度逐渐增加,添加量为5g/100g时达到最大值573g,比对照增加了23%;再继续添加SPI破断强度反而降低。从凹陷度看,随着SPI和GP添加量的增加,凝胶的凹陷度逐渐增大,分别在添加量为5g/100g和10g/100g达到最大值8.23mm和8.83mmm,比对照样品增加了17%和22%;再继续添加SPI,反而导致凹陷度降低。从凝胶强度来看,随着SPI和GP添加量的增加,凝胶强度逐渐增大,分别在添加量为5g/100g和10g/100g达到最大值4716g·mm和4962g·mm,比对照样品增加了39%和47%;再继续添加SPI或GP,反而导致凝胶强度降低。上述结果表明,添加SPI和GP可显著改善竹荚鱼鱼糜的凝胶特性。这一实验结果与国外学者对某些海水鱼糜的研究结果[9,17-18,20]相似。
从图2还可以看出,添加PPC降低了竹荚鱼鱼糜凝胶的破断强度、凹陷度和凝胶强度,并且随着添加量的增加,凝胶特性降低的越显著。这可能是由于PPC本身的凝胶特性较差,添加到鱼糜中干扰了鱼糜蛋白网络结构的形成,从而导致其凝胶特性变差。


图3 凝胶化时间对竹荚鱼鱼糜凝胶破断强度、凹陷度和凝胶强度的影响Fig.3 Effects of setting time on breaking force, deformation and gel strength of horse-mackerel surimi gel
从图3可以看出,与对照样品(未添加非肌肉蛋白的样品)相比,添加SPI和GP延长了竹荚鱼鱼糜凝胶的破断强度、凹陷度、凝胶强度达到最大值所需的时间。添加量为1g/100g时,达到最大破断强度所需的时间分别为7h和7h;达到最大凹陷度所需的时间分别为5h和5h;达到最大凝胶强度所需的时间分别为5h和7h。继续延长凝胶化时间,则会导致破断强度、凹陷度、凝胶强度显著降低。从图3还可以看出,随着凝胶化时间的延长,添加PPC样品的破断强度、凹陷度、凝胶强度基本保持不变。
2.3 非肌肉蛋白对竹荚鱼鱼糜凝胶白度的影响

表1 非肌肉蛋白添加量对竹荚鱼鱼糜凝胶白度的影响Table1 Effects of separately added non-muscle proteins on whiteness of horse-mackerel surimi gel
从表1可以看出,在竹荚鱼鱼糜中加入SPI、GP和PPC等非肌肉蛋白对其凝胶的颜色会产生较大的影响,导致最终制品的白度下降,且添加量越大,白度下降越多。这表明添加上述3种非肌肉蛋白对鱼糜凝胶的白度会产生负面影响。这可能是由于这3种非肌肉蛋白本身的白度均低于竹荚鱼鱼糜的白度所致。从表1还可以看出,当添加量相同时,不同种类的非肌肉蛋白对鱼糜凝胶白度没有显著影响。由于白度是鱼糜制品的重要质量指标之一,因此,在实际应用时,上述3种非肌肉蛋白的添加量均不应太高。
2.4 非肌肉蛋白对竹荚鱼鱼糜凝胶失水率的影响

图4 非肌肉蛋白添加量对竹荚鱼鱼糜凝胶失水率的影响Fig.4 Effects of separately added non-muscle proteins on water-loss rate of horse-mackerel surimi gel
从图4可以看出,添加SPI和GP均可降低竹荚鱼鱼糜凝胶的失水率,且添加量越大,失水率相应越低,这表明上述两种非肌肉蛋白可提高竹荚鱼鱼糜凝胶的持水性,竹荚鱼鱼糜凝胶失水率的变化与其凝胶特性的变化基本是一致的。当添加量相同时,添加GP的凝胶失水率最低,其次是添加SPI的凝胶。由图4还可以看出,添加PPC的凝胶失水率与对照(未添加非肌肉蛋白的样品)相比无显著差异。
2.5 非肌肉蛋白对竹荚鱼鱼糜凝胶微观结构的影响

图5 非肌肉蛋白对竹荚鱼鱼糜凝胶微观结构的影响Fig.5 Effects of non-muscle protein on microstructure of horsemackerel surimi gel
从图5可以看出,添加非肌肉蛋白对竹荚鱼鱼糜凝胶的微观结构有显著影响。与对照相比(图5a),添加SPI和GP的鱼糜凝胶(图5b、5c)在结构上较对照要致密、均匀,这从微观结构上进一步说明了添加上述两种非肌肉蛋白可改善竹荚鱼鱼糜的凝胶质构,从而使其具有较高的破断强度、凹陷度和凝胶强度,并有利于水分的保持。添加PPC的鱼糜凝胶(图5d)在结构上较对照样品要粗糙,凝胶表面有较多的大小不一的孔洞,这从微观结构上进一步说明了PPC对竹荚鱼鱼糜凝胶的质构无改善作用,并导致其破断强度、凹陷度和凝胶强度下降,水分不易保持等。
综上所述,添加SPI和GP延长了竹荚鱼鱼糜达到最佳程度凝胶化的时间,这主要是因为SPI和GP在竹荚鱼鱼糜中是一种外源添加物,因此阻碍了竹荚鱼鱼糜的凝胶进程,SPI和GP对竹荚鱼鱼糜凝胶特性的改善主要源于其本身能够形成凝胶的性质。添加PPC对竹荚鱼鱼糜凝胶化进程没有改善。
3 结 论
SPI对竹荚鱼鱼糜蛋白的降解有抑制作用。添加GP和PPC对抑制竹荚鱼鱼糜蛋白降解的影响较小。添加GP和SPI能提高竹荚鱼鱼糜凝胶的破断强度、凹陷度和凝胶强度,GP和SPI的添加量分别为10g/100g和5g/100g时,竹荚鱼鱼糜的凝胶特性达到最大值。添加PPC则降低了竹荚鱼鱼糜凝胶的破断强度、凹陷度和凝胶强度。
[1] MORRISSEY M T, WU J W, LIN D D, et al.Effect of food grade protease inhibitor on autolysis and gel strength of surimi[J].Journal of Food Science, 1993, 58: 1050-1054.
[2] JIANG S T.Enzymes and their effects on seafood texture[M]//HAARD N F, SIMPSON B K.Seafood enzyme: Utilization and influence on postharvest seafood quality.New York: Marcel Dekker, 2000: 411-450.
[3] VISESSANGUAN W, AN H.Effects of proteolysis and mechanism of gel weakening in heat-induced gelation of fish myosin[J].Journal of Agricultural and Food Chemistry, 2000, 48(4): 1024-1032.
[4] AN H, PETERS M Y, SEYMOURS T A.Roles of endogenous enzymes in surimi gelation[J].Trends in Food Science and Technology,1996, 7(10): 321-327.
[5] AKAZAWA H, MIYAUCHI Y, SAKURADA K, et al.Evaluation of protease inhibitors in Pacific whiting surimi[J].Journal of Aquatic Food Product Technology, 1994, 2(3): 79-95.
[6] BENJAKUL S, VISESSANGUAN W.Pig plasma protein: potential use as proteinase inhibitor for surimi manufacture; inhibitory activity and the active components[J].Journal of the Science of Food and Agriculture, 2000, 80(9): 1351-1356.
[7] BENJAKUL S, VISESSANGUAN W, SRIVILA C.Gel properties of bigeye snapper (Priacanthus tayenus) surimi as affected by setting and porcine plasma proteins[J].Journal of Food Quality, 2001, 24(5): 453-472.
[8] BENJAKUL S, VISESSANGUAN W, TUEKSUBAN J, et al.Effect of some protein additives on proteolysis and gel-forming ability of lizardfish(Saurida tumbil)[J].Food Hydrocolloids, 2004, 18(3): 395-401.
[9] CHANG-LEE M V, LAMPILA L E, CRAWFORD D L.Yield and composition of surimi from Pacific whiting (Merluccius productus) and the effect of various protein additives on gel strength[J].Journal of Food Science, 1990, 55(1): 83-86.
[10] KANG I S, LANIER T C.Bovine plasma protein functions in surimi gelation compared with cysteine protease inhibitors[J].Journal of Food Science, 1999, 64(5): 842-846.
[11] LEE J J, TZENG S S, WU J, et al.Inhibition of thermal degradation of mackerel surimi by pig plasma protein andL-kininogen[J].Journal of Food Science, 2000, 65(7): 1124-1129.
[12] RAWDKUEN S, BENJAKUL S.Whey protein concentrate: Autolysis inhibition and effects on the gel properties of surimi prepared from tropical fish[J].Food Chemistry, 2008, 106(3): 1077-1084.
[13] RAWDKUEN S, BENJAKUL S, VISESSANGUAN W, et al.Chicken plasma protein: Proteinase inhibitory activity and its effect on surimi gel properties[J].Food Research International, 2004, 37(2): 156-165.
[14] REPPOND K D, BABBITT J K.Protease inhibitors affect physical properties of arrowtooth flounder and walleye pollock surimi[J].Journal of Food Science, 1993, 58(1): 96-98.
[15] SEYMOUR T A, PETERS M Y, MORRISSEY M T, et al.Surimi gel enhancement by bovine plasma proteins[J].Journal of Agricultural and Food Chemistry, 1997, 45(8): 2919-2923.
[16] WASSON D H, REPPOND K D, BABBITT J K, et al.Effects of additives on proteolytic and functional properties of arrowtooth flounder surimi[J].Journal of Aquatic Food Product Technology, 1992, 1(3/4):147-165.
[17] PARK J W.Functional protein additives in surimi gels[J].Journal of Food Science, 1994, 59(3): 525-527.
[18] GOMEZ-GUILLEN M C, BORDERIAS A J, MONTERO P.Rheological properties of gels made from high- and low-quality sardine mince with added non-muscle proteins[J].Jounral of Agricultural and Food Chemistry, 1996, 44(3): 746-750.
[19] LUO Y K, PAN D D, JI B P.Gel properties of surimi from bighead carp(Aristichthys nibilis): influence of setting and soy protein isolate[J].Journal of Food Science, 2004, 69(8): E374-E378.
[20] 周爱梅.淡水鱼糜抗冻性能及凝胶特性改良的研究[D].广州: 华南理工大学, 2005.

