改善心血管健康的食源性生物活性肽构效关系研究进展
王春艳,田金强,王 强*
(中国农业科学院农产品加工研究所,北京 100193)
生物活性肽按来源可分为动物源功能性短肽和植物源功能性短肽。蛋白质经胃肠酶解分解或加工产生的生物活性肽具有非常重要和广泛的生物学功能和调节功能,可直接作为神经递质、间接刺激肠道受体激素或酶的分泌而发挥生理作用。短肽的生理功能主要有类吗啡样活性、免疫调节、抗血栓、降血压、降胆固醇、抑菌、抗氧化以及改善元素吸收和矿物质运输等。食物蛋白经酶解后制备的活性肽,通常包含2~20个氨基酸残基,而其功能活性取决于蛋白质本身的理化特性、水解肽的分子质量、氨基酸含量、氨基酸组成、氨基酸序列等因素。
在水解过程中,蛋白质肽链被打开、肽链中分子数目减少、分子质量和抗原性降低,同时分子结构的改变导致埋藏的疏水中心暴露到溶液环境中。但是蛋白质水解为肽后,结构的改变对功能特性和生物活性所产生的影响至今仍没有系统的理论和结论,因此肽的生物活性与结构之间的相关性研究是目前备受关注的一个热点。尽管生物活性肽的结构和功能之间的关系尚未完全明晰,但某些肽的生物活性和功能特性已表现出普遍的结构特点。本文对与心血管健康有关的活性肽的功能活性和构效关系进行综述,包括降血压、抗氧化、抗血栓、降胆固醇肽及抑制肥胖肽,以期对蛋白肽的深入研究和应用提供借鉴。
1 食物源活性肽功能活性及其构效关系
1.1 血管紧张素转换酶(ACE)抑制肽
目前食物蛋白源ACE)抑制肽因其独特的生理功能而受到广泛的关注,成为活性肽研究的热点。食物源ACE抑制肽通常由蛋白酶在温和条件下水解蛋白而获得,不同蛋白质来源的ACE抑制肽降压效果与结构有关。目前对其构效关系已经有了较深入的研究,但是这些研究都是基于氨基酸序列分析进行的,许多肽并不符合这些研究结果,确切的构效关系模型至今仍未建立,但从中可得到一些常见的局部结构特点。部分食物源ACE抑制肽体内降压效果及结构见表1。
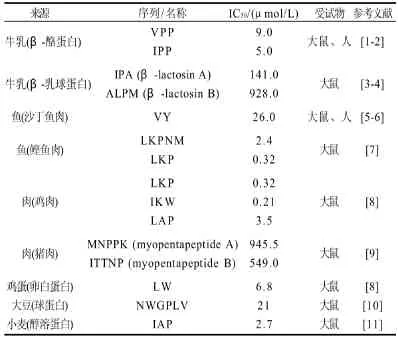
表1 部分食物源ACE抑制肽体内降压效果Table1 Antihypertensive effect of ACE inhibitory peptides in vivo
降压肽进入小肠后需被完整吸收并以活性形式进入心血管系统才能产生降压活性,因此肽的结构起着重要作用。首先在氨基酸组成上,从多数具有降压效果的肽段氨基酸个数来看,它与降压效果并不存在固定的关系。但一般具有较高降压效果的乳源活性肽氨基酸残基多集中在6~10个左右,分子质量大多低于1000D,也有极个别的由27个氨基酸组成的降血压肽被发现[12]。One等[13]研究表明,由非极性脂肪族氨基酸和芳香族氨基酸组成的肽可表现出较强的ACE抑制活性,并从鲑鱼酶解物中分离出6种可抑制ACE的二肽均含有色氨酸。Saiga等[14]从鸡胸肉的酶解液中分离出来的3种多肽表现出较强的ACE抑制活性,这3种多肽均有甘氨酸-X-X-甘氨酸、X-X-甘氨酸-X-X的序列,其中11肽Gly-Phe-Hyp-Gly-Thr-Hyp-Gly-Leu-Hyp-Gly-Phe表现出最高的抑制活性。而从新鲜鸭肉的酶解物中分离出的四肽Gly-Asp-Leu-Gly也表现出较强的ACE抑制活性。
大多数天然的ACE抑制肽具有Ala-Pro或Pro-Pro的羧基末端,而从人乳酪蛋白、金枪鱼肌肉蛋白质及玉米蛋白酶解物中分离的具有较强ACE抑制活性的肽在C端都有一个脯氨酸残基。大量研究表明,C末端为Trp、Phe、Tyr和Pro,而N末端为支链氨基酸的二肽或三肽具有较强的ACE抑制活性。大多数Casokinin(酪蛋白的酶解物,可表现出较强的ACE抑制活性)C端的氨基酸残基都为脯氨酸、赖氨酸、精氨酸等疏水氨基酸(芳香或支链氨基酸)。ACE抑制肽的活性强度也受C端Pro残基临近氨基酸的影响,高ACE抑制活性肽的C端临近氨基酸应该是疏水性氨基酸。ACE倾向于C末端三肽的每个位置含有疏水性氨基酸(如芳香族氨基酸和支链氨基酸)的底物或抑制剂,ACE的活性中心S1和S2立点可与C端三肽的残基发生作用。此外,抗高血压肽的N-端具有芳香环氨基酸和碱性氨基酸时,也能提高降压效果。肽的疏水性也是影响其活性的重要因素,高亲水性无法使肽接近ACE活性部位而导致活性较弱或无活性。
此外ACE抑制肽的一个明显特点是往往同时具有其他活性,如有人从牛乳酪蛋白中得到的ACE抑制肽(Ala-Val-Tyr-Pro-Glu-Arg),同时具有促进BALB/C 3T3细胞增殖、增强初代培养肝细胞胰高血糖素作用;源于血纤维蛋白ACE抑制(Ala-Arg-Pro-Ala-Lys),还具有促进吞噬、提高毛细管通透性等作用。
1.2 抗氧化肽
不同来源的水解蛋白都具有一定的抗氧化能力,牛乳酪蛋白、乳清蛋白、大豆蛋白等的水解物均可分离出抗氧化肽。表2列举了部分不同蛋白质来源的生物活性肽。抗氧化肽的抗氧化机理并不明确,可能与金属离子螯合、自由基清除作用及单线态氧的淬灭有关[15]。但Chen等[16]对合成的含组氨酸短肽的研究发现,这些机理都不能完全解释短肽的抗氧化性,因此短肽的抗氧化性可能是各种因素共同作用的结果。
一般说来,肽类的抗氧化能力大于氨基酸,相关资料报道分子质量在2500~3000D的肽类较为理想。Wu等[17]则认为900D和200D的肽具有更好的体外抗氧化活性。Yamaguchi等[18]酶解大豆分离蛋白质6h后发现,分子质量小的肽有较强的抗氧化活性,易被肠道吸收而直接在机体中发生作用。Seronei等[19]在乳清蛋白制备的研究过程中发现,疏水性氨基酸、芳香环氨基酸的存在与抗氧化之间有着密切的关系,它们所含有的个数越多,其抗氧化活性越显著。由支链氨基酸苯丙氨酸、亮氨酸、异亮氨酸等组成的肽可表现出抗氧化性,也有研究认为含碱性氨基酸的活性肽可作为电子受体夺取不饱和脂肪酸氧化形成的自由基的电子,从而阻断因自由基引发而造成的不饱和脂肪酸氧化链的延长[20]。Chen等[21]确认大豆酶解物的抗氧化性基于活性肽亮氨酸-亮氨酸-脯氨酸-组氨酸-组氨酸的存在,含组氨酸的肽可作为金属离子鳌合剂、单线态氧淬灭剂和·OH清除剂而表现出较强的抗氧化性能。肌肽为含组氨酸的二肽,也表现出较强的抗氧化性能。Rajapakse等[22]用一种蚌类(Mytilus edulis)为原料进行发酵,分离出一种含组氨酸抗氧化肽,命名为MRSP,其序列为His-Phe-Gly-Asp-Pro-Phe-His,具有很强的清除自由基的能力,且对Fe2+的螯合能力比柠檬酸盐高95%。研究表明,在组氨酸-组氨酸二肽的N-末端增加亮氨酸或脯氨酸残基可提高其抗氧化性。Chen等[23]报道Pro-His-His序列具有较强的抗氧化性,且与非肽类抗氧化剂有协同效应。此外由于疏水性短肽更易于与疏水性底物结合(如亲脂性脂肪酸),因此短肽的疏水性也是影响其活性的因素之一[24]。
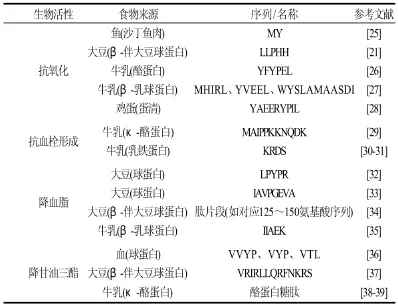
表2 部分食物源生物活性肽Table 2 Examples of bioactive peptides derived from foods
1.3 抑制胆固醇作用肽
高胆固醇血症是动脉粥样硬化及心血管疾病的危险因子,对人类身心健康和生命造成很大威胁,改善高胆固醇血症的最好办法是抑制肝脏胆固醇(CHOL)的合成与小肠的吸收。已知某些膳食蛋白质可改善血脂水平,如大豆、乳清及鱼类蛋白消化经吸收后具有降胆固醇、保护心血管的作用[40]。对于蛋白降低CHOL作用的机理尚不明确,但蛋白质的氨基酸组成会影响血浆中胆固醇水平。研究表明,大豆蛋白和鱼类蛋白中较低含量的Met-Gly和Lys-Arg具有较好的降胆固醇作用,而牛酪蛋白可能由于Met-Gly和Lys-Arg含量较高,可使血浆胆固醇水平提高[41-42]。
目前对具有降胆固醇作用的短肽报道较少,其中以大豆蛋白的研究较多。多肽降低血清CHOL的效应主要表现在升高高密度脂蛋白(HDL)、降低低密度脂蛋白(LDL),可有效减少CHOL的消化吸收,能阻碍肠道内CHOL的再吸收,促使其排出体外。多肽还能刺激甲状腺激素分泌,促使CHOL代谢产生胆汁酸,胆汁酸又被食物纤维吸附排出体外,从而阻碍对胆固醇的吸收,起到降低血液胆固醇作用[40]。此外多肽对胆固醇水平正常的人无降低作用,但可以防止食用高胆固醇食物后的血清CHOL升高。Nagata等[43]和Wang等[44]发现与大豆蛋白相类似的氨基酸混合物的降CHOL效果弱于大豆蛋白,但用胃蛋白酶与胰酶水解产生的高疏水性的食饵饲喂老鼠,血清CHOL浓度降低更大,说明多肽的降胆固醇效果大于蛋白和氨基酸。Making等[45]研究发现大豆蛋白中的疏水性氨基酸可促进胆固醇的胆汁酸化,因此起到降低血液胆固醇的作用。最近研究从大豆蛋白中分离出一种与肠抑素具有相同序列的短肽LPYPR,可对小鼠产生降低血清胆固醇作用[32],肠抑素是一种具有降胆固醇和产生厌食作用的内源性短肽。另一种序列为IAVPGEVA的大豆球蛋白短肽也具有降低胆固醇活性的功效[33]。体外实验证明,LPYPR及IAVPGEVA均有抑制3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)作用,HMGR为胆固醇生物合成中的关键酶。对其构效关系的研究表明,这两种肽的疏水性区域是具备其生物活性所必须的结构因素,疏水性序列的最大长度为4个氨基酸,脯氨酸残基是其中一种关键组成,可位于肽链的C端或除N端外的任何区域。大豆球蛋白水解物还具有显著的降甘油三酯作用,已鉴定的短肽包括VVYP、VYP及VTL。除大豆蛋白外,牛乳乳清蛋白也可降低血浆中胆固醇水平。Nagaoka等[35]从牛乳β-乳球蛋白中分离出一种序列为IIAEK的降胆固醇五肽,且其降胆固醇作用好于谷甾醇。
1.4 抗血栓肽
抗血栓肽(antithiomboticpeptide)能抑制ADP激活的血小板聚合作用,同时还能抑制人血纤维蛋白原链与血小板表面特异位点的结合,所以具有抗血栓形成的生理功能[46]。抗血栓肽主要来自于牛乳κ-酪蛋白的水解,酪蛋白血小板因子(casoplatelins)是来源于牛酪蛋白C-末端的一类生物活性肽,相当于κ-酪蛋白106~116残基序列的十一肽(Met-Ala-Ile-Pro-Pro-Lys-Lys-Asn-Gln-Asp-Lys),分别对应于κ-酪蛋白106-112、112-116、113-116残基序列的小肽也具有抗血栓活性。近年来研究从人乳铁蛋白中分离出一种具有与纤维蛋白原α-链相似结构的四肽KRDS,发现其可抑制血小板凝集。Lee等[47]将大豆蛋白酶解后通过凝胶过滤色谱、反相高效液相色谱、阳离子交换HPLC等从中分离出一种抑制血小板聚合的两种肽,分别命名为SSGE和DEE,抑制非正常血小板聚合的IC50值分别为480μmol/L和460μmol/L。抗血栓肽的发现和进一步的开发研制为近年来多发的血栓类疾病的预防和治疗提供了新的手段。
1.5 减肥肽
肥胖是引发心血管疾病的又一因素,常与胰岛素和脂肪代谢异常有关。在影响肥胖的膳食因素中,蛋白质是最能引起饱腹感的常量营养素,同时摄食蛋白质比摄食脂肪和糖类更能促进能量代谢,但不同来源的蛋白质对降低体重和改善心血管状况的影响不同。大豆蛋白、酪蛋白及乳清蛋白都表现出减肥或抑制食欲的功能,且大豆蛋白效果优于后两者。蛋白质抑制食欲的机理还不明确,但有研究显示,膳食蛋白质在消化过程中释放的肽可产生几种厌食信号从而抑制食物的摄入。肽类诱导饱腹感的产生主要通过调节阿片样受体和胆囊收缩素(CCK)A受体的活性。阿片样活性肽可延迟胃排空及抑制消化物在小肠内的推进;CCK的分泌引起胆囊的强烈收缩,同时促进了胆汁酸化,从而促进胆固醇排泄,由于CCK的大量分泌刺激了神经系统而调节下丘脑中枢饱觉区,因而导致受试者或动物摄食量减少。
研究报道大豆蛋白肽对降低身体脂肪含量和食物摄入的作用较完整的大豆蛋白更为显著,这说明大豆蛋白水解物具有重要的降低体重作用,而模拟大豆蛋白和酪蛋白的氨基酸混合物对刺激黏膜细胞CCK的释放没有显著效果[48]。这些结果说明饱腹感的产生是由于肽的作用。Nishi等[49]认为高活性肽由于蛋白质来源不同,其适合的肽链长度也不同,较小的大豆短肽对CCK的产生效果较明显,而更大的酪蛋白水解肽则更利于CCK的释放。Nishi等[50]还分离出序列为VRIRLLQRFNKRS的抑制食欲肽,对应于β-伴大豆球蛋白的51~63残基序列,可直接刺激肠黏膜细胞分泌CCK,对几种合成短肽模型的研究发现精氨酸残基的大量存在是CCK释放的必要条件。酪咖肽和酪蛋白糖巨肽是水解牛乳酪蛋白产生的具有饥饿调节功能的生物活性肽。具有阿片样活性的酪咖肽与特定的阿片受体结合来调节胃肠动力并抑制食物的摄入。酪蛋白糖巨肽是к-酪蛋白C末端的106~169氨基酸残基片段,可产生CCK释放活性,因此是一种食欲抑制剂。
2 展 望
心血管疾病是一种世界范围内的公众健康疾病,生物活性肽已经显示出对心血管健康的积极效应,因此生物活性肽在保护人体健康方面将起到重要作用。食物源生物活性肽作为一种功能食品,其发展很大程度上依赖于对结构和功能关系的把握,但是目前大部分已发现的生理功能是基于体外或动物模型实验得到,人体临床研究则很有限,最佳的摄入水平还未可知。因此对活性肽潜在的治疗作用及结构-功能关系的研究值得进一步深入开展。此外,活性肽可作为功能食品或药品的组成成分,用于改善健康状况或治疗疾病,并最终为个性化营养和健康维护提供参考。
[1] NAKAMURA Y, YAMAMOTO N, SAKAI K, et al.Antihypertensive effect of sour milk and peptides isolated from it that are inhibitors to angiotensin I-converting enzyme[J].J Dairy Sci, 1995, 78(6): 1253-1257.
[2] SEPPO L, JAUHIAINEN T, POUSSA T, et al.A fermented milk high in bioactive peptides has a blood pressure-lowering effect in hypertensive subjects[J].Am J Clin Nutr, 2003, 77(2): 326-330.
[3] ABUBAKAR A, SAITO T, KITAZAWA H, et al.Structural analysis of new antihypertensive peptides derived from cheese whey protein by proteinase K digestion[J].J Dairy Sci, 1998, 81(12): 3131-3138.
[4] MURAKAMI M, TONOUCHI H, TAKAHASHI R, et al.Structural analysis of a new anti-hypertensive peptide (β-lactosin B) isolated from a commercial whey product[J].J Dairy Sci, 2004, 87(7): 1967-1974.
[5] KAWASAKI T, SEKI E, OSAJIMA K, et al.Antihypertensive effect of Valyl-Tyrosine, a short chain peptide derived from sardine muscle hydrolyzate on mild hypertensive subjects[J].J Hum Hypertens, 2000, 14(8):519-523.
[6] MATSUFUJI H, MATSUI T, OHSHIGE S, et al.Antihypertensive effects of angiotensin fragments in SHR[J].Biosci Biotechnol Biochem,1995, 59(8): 1398-1401.
[7] FUJITA H, YOSHIKAWA M.LKPNM: a prodrug-type ACE-inhibitory peptide derived from fish protein[J].Immunopharmacology, 1999,44(1/2): 123-127.
[8] FUJITA H, YOKOYAMA K, YOSHIKAWA M.Classification and antihypertensive activity of angiotensin I-converting enzyme inhibitory peptides derived from food proteins[J].J Food Sci, 2000, 65(4): 564-569.
[9] NAKASHIMA Y, ARIHARA K, SASAKI A, et al.Antihypertensive activities of peptides derived from porcine skeletal muscle myosin in spontaneously hypertensive rats[J].J Food Sci, 2002, 67(1): 434-437.
[10] KODERA T, NIO N.Identification of an angiotensin I-converting enzyme inhibitory peptides from protein hydrolysates by a soybean protease and the antihypertensive effects of hydrolysates in spontaneously hypertensive model rats[J].J Food Sci, 2006, 71(3): 164-173.
[11] MOTOI H, KODAMA T.Isolation and characterization of angiotensin I-converting enzyme inhibitory peptides from wheat gliadin hydrolysate[J].Nahrung/Food, 2003, 47(5): 354-358.
[12] ROBERTM C, RAZANAME A, MUTTER M, et al.Identification of angiotensin-I-converting enzyme inhibitory peptides derived from sodium caseinate hydrolysates produced byLactobacillus helveticusNCC 2765[J].Journal of Agricultural and Food Chemistry, 2004, 52(23):6923-6931.
[13] ONE S, HOSOKAWA M, KAKAHASHI K.Isolation of peptides with angiotension-I-converting enzyme inhibitory effect derived from hydrolysates of upstream chum salmon muscle[J].J Food Sci, 2003, 68(5):1611-1614.
[14] SAIGA A, OKUMTWA T, MUKINARA T.Angiotension-I-converting enzyme inhibitory peptides in a hydrolyzed chicken breast muscle ex-tract [J].J Agric Food Chem, 2003, 51(6): 1740-1745.
[15] KITTS D D, WEILER K.Bioactive proteins and peptides from food sources.Applications of bioprocesses used in isolation and recovery[J].Curr Pharm Des, 2003, 9(16): 1309-1323.
[16] CHEN Huaming, MURAMOTO K, YAMAUCHI F, et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].J Agric Food Chem,1998, 46(1): 49-53.
[17] WU Huichun, CHEN Huaming, SHIAU C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J].Food Research International, 2003,36(9/10): 949-957.
[18] YAMAGUCHI N, NAITO S, YOKOO Y, et al.Oxidative stability of dried model food consisted of soybean protein hydrolyzate and lard[J].Nippon Shokuhin Kogyo Gkkaishi, 1980, 27(4): 51-55.
[19] SERONEI, CHEISON S C, WANG Zhang.Preparation of whey protein hydrolystaes using a single and two-stage enymatic membrane reactor and their immunological and antioxidant properties: characterization by multivariate data analusis[J].J Agric Food Chem, 2007, 55(10): 3896-3904.
[20] KAWASHIMA K, HOB H, MIYOCHI M, et a1.Antioxidant properties of branched-chain amino acid derivatives[J].Chem Pharm Bull, 1997,27(8): 1912-1916.
[21] CHEN Huaming, MURAMOTO K, YAMAUCHI F.Structural analysis of antioxidative peptides from soybean beta-conglycinin[J].J Agric Food Chem, 1995, 43(3): 574-358.
[22] RAJAPAKSE N, MENDIS E, JUNG W K.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International, 2005, 38(2): 175-182.
[23] CHEN Huaming, MURAMOTO K, YAMAUCHI F, et al.Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J].J Agric Food Chem, 1996, 44(9):2619-2623.
[24] CHEN Huaming, MURAMOTO K, YAMAUCHI F, et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].J Agric Food Chem,1998, 46(1): 49-53.
[25] ERDMANN K, GROSSER N, SCHIPPOREIT K, et al.The ACE inhibitory dipeptide Met-Tyr diminishes free radical formation in human endothelial cells via induction of heme oxygenase-Ⅰ and ferritin[J].J Nutr, 2006, 136(8): 2148-2152.
[26] SUETSUNA K, UKEDA H, OCHI H.Isolation and characterization of freeradical scavenging activities peptides derived from casein[J].J Nutr Biochem, 2000, 11(3): 128-131.
[27] BLANCA H L, DAVALOS A, BARTOLOME B, et al.Preparation of antioxidant enzymatic hydrolysates from alphalactalbumin and betalactoglobulin identification of active peptides by HPLC-MS/MS[J].J Agric Food Chem, 2005, 53(3): 588-593.
[28] DAVALOS A, MIGUEL M, BARTOLOME B, et al.Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J].J Food Prot, 2004, 67(9): 1939-1944.
[29] JOLLES P, LEVY-TOLEDANO S, FIAT AM, et al.Analogy between fibrinogen and casein effect of an undecapeptide isolated from kappacasein on platelet function[J].Eur J Biochem, 1986, 158(2): 379-382.
[30] RAHA S, DOSQUET C, ABGRALL J, et al.KRDS-a tetrapeptide derived from lactotransferrin-inhibits binding of monoclonal antibody against glycoprotein IIb-IIIa on ADP-stimulated platelets and megakaryocytes[J].Blood, 1988, 72(1): 172-178.
[31] MAZOYER E, LEVY-TOLEDANO S, RENDU F, et al.KRDS, a new peptide derived from human lactotransferrin, inhibits platelet aggregation and release reaction[J].Eur J Biochem, 1990, 194(1): 43-49.
[32] YOSHIKAWA M, FUJITA H, MATOBA N, et al.Bioactive peptides derived from food proteins preventing lifestyle-related diseases[J].Biofactors, 2000, 12(1/4):143-146.
[33] PAK V V, KOO M S, KASYMOVA T D, et al.Isolation and identification of peptides from soy 11S-globulin with hypocholesterolemic activity[J].Chem Nat Compd, 2005, 41(6): 710-714.
[34] LOVATI M R, MANZONI C, GIANAZZA E, et al.Soy protein peptides regulate cholesterol homeostasis in Hep G2 cells[J].J Nutr, 2000,130(10): 2543-2549.
[35] NAGAOKA S, FUTAMURA Y, MIWA K, et al.Identification of novel hypocholesterolemic peptides derived from bovine milk beta-lactoglobulin[J].Biochem Biophys Res Commun, 2001, 281(1): 11-17.
[36] KAGAWA K, MATSUTAKA H, FUKUHAMA C, et al.Globin digest,acidic protease hydrolysate, inhibits dietary hypertriglyceridemiaand Val-Val-Tyr-Pro, one of its constituents, possesses most superior effect[J].Life Sci, 1996, 58(20): 1745-1755.
[37] NISHI T, HARA H, ASANO K, et al.The soybean beta-conglycinin beta 51-63 fragment suppresses appetite by stimulating cholecystokinin release in rats[J].J Nutr, 2003, 133(8): 2537-2542.
[38] PEDERSEN N L, NAGAIN-DOMAINE C, MAHE S, et al.Caseinomacropeptide specifically stimulates exocrine pancreatic secretion in the anesthetized rat[J].Peptides, 2000, 21(10): 1527-1535.
[39] BEUCHER S, LEVENEZ F, YVON M, et al.Effects of gastric digestive products from casein on CCK release by intestinal cells in rat[J].J Nutr Biochem, 1994, 5(12): 578-584.
[40] ERDMANN K, CHEUNG B, SCHRER H.The possible roles of food-derived bioactive peptides in reducing the risk of cardiovascular disease[J].The Journal of Nutritional Biochemistry, 2008, 19(10): 643-654.
[41] WERGEDAHL H, LIASET B, GUDBRANDSEN O A, et al.Fish protein hydrolysate reduces plasma total cholesterol, increases the proportion of HDL cholesterol, and lowers acyl-CoA: cholesterol acyltransferase activity in liver of Zucker rats[J].J Nutr, 2004, 134(6):1320-1327.
[42] MORITA T, OH-HASHI A, TAKEI K, et al.Cholesterol-lowering effects of soybean, potato and rice proteins depend on their low methionine contents in rats fed a cholesterol-free purified diet[J].J Nutr, 1997,127(3): 470-477.
[43] NAGATA Y, ISHIWAKI N, SUGANO M.Studies on the mechanism of antihypercholesterolemic action of soy protein and soy proteintype amino acid mixtures in relation to the casein counterparts in rats[J].J Nutr,1982, 112(8): 1614-1625.
[44] WANG Mingfu, YAMAMOTO S, CHUNG Heimei, et al.Antihypercholesterolemic effect of undigested fraction of soybean protein in young female volunteers[J].J Nutr Sci Vitaminol, 1995, 41(2): 187-195.
[45] MAKING S, NAKASHIMA H, MINAMI K, et al.Bile acid-binding protein from soybean seed: isolation, partial characterization and insulinstimulating activity[J].Agric Biol Chem, 1988, 52(3): 803-809.
[46] JOLLES P, CAEN J P.Parallels between milk clotting and blood clotting: opportunities for milk-derived protucts[J].Trend in Food Science and Technology, 1991(2): 42-43.
[47] LEE K A,KIM S H.SSGE and DEE, new peptides isolated from a soy protein hydrolysate that inhibit platelet aggregation[J].Food chemistry, 2005, 90(3): 389-393.
[48] NISHI T, HARA H, KASAI T.Guanidinated casein hydrolysate stimulates pancreatic secretagogue release by direct action to the intestine in rats[J].Proc Soc Exp Biol Med, 1998, 218(4): 357-364.
[49] NISHI T, HARA H, HIRA T, et al.Dietary protein peptic hydrolysates stimulate cholecystokinin release via direct sensing by rat intestinal mucosal cells[J].Exp Biol Med, 2001, 226(11): 1031-1036.
[50] NISHI T, HARA H, ASANO K, et al.The soybean beta-conglycinin beta 51-63 fragment suppresses appetite by stimulating cholecystokinin release in rats[J].J Nutr, 2003, 133(8): 2537-2542.

