菜籽饼粕多糖对D-半乳糖衰老小鼠的抗氧化及免疫调节作用
雷 红,孙汉巨,姜绍通
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
菜籽粕含有蛋白质、多糖、植酸、多酚、胆碱、生物素、烟酸、VB1、VB2和丰富的微量元素如钙、磷等成分,具有较高的利用价值[1]。本课题组已采用脱脂、脱色、碱溶、脱蛋白等提取和纯化方法得到菜籽饼粕多糖(PRM),并考察了PRM对正常小鼠免疫功能和抗氧化功能的影响,结果表明PRM具有免疫促进和抗氧化作用[2-3]。
D-半乳糖(D-gal)可产生拟衰老反应,对氧自由基代谢的损伤、免疫功能的影响与人体衰老的改变基本一致[4-5]。本实验采用D-半乳糖亚急性人工衰老模型,以肝肾组织中MDA含量、抗氧化酶SOD活性,以及脾细胞增殖反应、巨噬细胞增殖反应、IL-1、IL-2、一氧化氮(NO)产生为指标,探讨PRM对D-gal衰老模型小鼠的作用及其抗氧化和免疫调节作用机理。
1 材料与方法
1.1 材料与试剂
昆明种小白鼠与C57BL/6J小鼠,♂,体质量(20±2) g;购于安徽医科大学实验动物中心,合格证号:皖医实动准第01号。
采用脱脂、脱色、碱溶、脱蛋白等提取和纯化方法得到PRM,多糖的纯度≥95%[2],临用时用质量分数1% CMC-Na溶液稀释至所需浓度。将VE用少量无水乙醇溶解后,再用1% CMC-Na溶液制成混悬液,供灌胃给药(乙醇终体积分数<0.2%)。
D-半乳糖(D-gal)、刀豆蛋白A(ConA)、脂多糖(LPS)、四甲基偶氮唑盐(MTT) Sigma公司;1,1,3,3-四乙氧基丙烷(TEP) Fluka公司; SOD、一氧化氮(NO)测定试剂盒 南京建成生物工程研究所;1640干粉 Gibco公司;胎牛血清(FBS) 北京元亨圣马生物技术研究所;VE Merck公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BIOROD Model 680 CO2培养箱 美国Precision Scientific公司;XSB-1A倒置显微镜 梧州光学仪器厂;YP202N 电子天平 上海精密科学仪器有限公司;电热恒温水浴锅 上海跃进医疗器械厂;CyberScan 510 pH 计 Singapore Eutech 仪器公司;GTL 16A 型离心机上海医用分析仪器厂;SW-CJ-IFD 型净化工作台 苏净集团苏州安泰空气技术有限公司;Multiskan全波长酶标仪 Thermo 公司。
1.3 方法
1.3.1 分组与给药
设正常对照组、D-gal模型组、PRM高、低剂量组(400、200mg/kg bw)、VE(50mg/kg bw)
阳性对照组,每组动物10只。D-gal处理4周后,检测各种指标。
1.3.2D-gal亚急性衰老小鼠模型的建立[6]
小鼠皮下注射D-gal 100mg/kg bw,每日一次,共4周。每周称体质量一次,并按此调整D-gal剂量。
1.3.3 组织匀浆的制备
于给药结束后处死小鼠,取出肝脏、肾脏,在冰冷的生理盐水中漂洗,除去血液,滤纸拭干,称质量。取组织块300mg,加入预冷的生理盐水2.7mL(其总质量是组织块质量的9倍),于玻璃匀浆器中尽快研碎组织块(冰浴中进行)。得肝、肾组积匀浆液用于MDA、SOD测定。
1.3.4 MDA含量的测定
采用硫代巴比妥酸比色法[7],根据TEP标准曲线计算MDA含量,结果以nmol/mg pro表示。蛋白质含量测定采用改良Lowry氏法。
1.3.5 超氧化物歧化酶(SOD)活性测定
按SOD测定试剂盒说明书进行,采用黄嘌呤氧化酶法测SOD活性。其活力单位以U/mg pro表示。
1.3.6 胸腺指数和脾脏指数的计算
胸腺指数和脾脏指数以胸腺质量(mg)和脾脏质量(mg)与体质量(g)的比值计,单位以(mg/g bw)表示。
1.3.7 小鼠脾淋巴细胞增殖反应
无菌取脾脏,加完全RPMI 1640营养液5mL,轻研,吸脾细胞悬液,不锈钢网过滤于离心管中,离心(2000r/min,10min),Hank's液(含 5%FBS)洗两次,计数,以完全RPMI 1640营养液制脾细胞悬液(1×107个/mL)。96孔培养板上,加ConA 100μL (终质量浓度3μg/mL),再加脾细胞悬液100μL,37℃、5% CO2培养箱继续培养24h。每孔加入5mg/mL MTT 20μL,继续培养6h。叩去营养液,每孔加DMSO 150μL,70r/min振摇10min,用酶标仪于波长570nm处测OD值。
1.3.8 脾细胞产生IL-2的检测[8]
IL-2的产生:无菌取脾脏,常规制备脾细胞悬液(1×107个/mL),方法同上。24孔培养板上加入ConA 500 μL (终质量浓度3μg/mL),脾细胞悬液500μL,置37℃,5% CO2培养箱中培养48h后,4℃离心(5000r/min,10min),收集上清,即为含IL-2活性的上清液。
IL-2的检测:制备ConA活化的小鼠脾细胞,用以测定IL-2的活性。以完全RPMI 1640营养液配制脾细胞悬液(2×106个/mL),加入ConA(终质量浓度3μg/mL),37℃、5% CO2培养4d。收集脾细胞,以完全RPMI 1640营养液制脾细胞悬液(2×106个/mL)。96孔板上,每孔加入稀释40倍的IL-2待测上清100μL,再加入100μL活化的小鼠脾细胞悬液(2×106个/mL),置37℃、5%CO2培养箱培养24h。终止前6h,加5mg/mL MTT 20μL,继续培养6h。叩去营养液,每孔加DMSO 150μL,用酶标仪于波长570nm处测OD值。
1.3.9 小鼠腹腔巨噬细胞增殖反应
放血处死小鼠,75%酒精浸泡5min。剪撕开腹部皮肤,75%酒精棉消毒。抽冷D-Hank 's 液(pH7.4)10mL注入腹腔,轻晃,抽腹腔细胞悬液6~8mL,注入离心管中,加3%~5%FBS,离心(1500r/min,10min),Hank's液(含5%FBS)洗两次,计数,以完全RPMI 1640营养液制腹腔细胞悬液(2×106个/mL),加入24孔板,1mL/(孔/样),37℃、5% CO2培养2h。吸管轻吸弃培养液,加0.9mL完全RPMI 1640营养液和0.1mL LPS(终质量浓度6μg/mL),37℃、5% CO2培养6h。吸管轻吸弃培养液,加1mL完全RPMI 1640营养液,37℃、5% CO2继续培养42h。吸取上清0.8mL,待测 NO、IL-1。每孔补加0.8mL完全RPMI 1640营养液,加入5mg/mL MTT 100μL,稍摇匀,继续培养6h。叩去营养液,每孔加DMSO 750μL,用酶标仪于波长570nm处测OD值。
1.3.10 巨噬细胞产生白介素1(IL-1)的检测
C57BL/6J小鼠处死,75%酒精浸泡5min。无菌取胸腺于培养皿中,加RPMI 1640营养液5mL,轻研,吸取胸腺细胞悬液,不锈钢网过滤于离心管中,离心(2000r/min,10min),Hank's液(含 5%FBS)洗两次,计数,以完全RPMI 1640营养液制C57BL/6J小鼠胸腺细胞悬液(2×107个/mL)。96孔板中,每孔加样本上清(稀释度1:30)100μL、50μL胸腺细胞悬液、50μL ConA(终质量浓度3μg/mL),37℃、5% CO2继续培养48h。终止前6h,加5mg/mL MTT 20μL。叩去营养液,每孔加DMSO 150μL,用酶标仪于波长570nm处测OD值。
1.3.11 巨噬细胞产生NO的检测
采用南京建成生物工程研究所试剂盒测定。
1.4 数据统计学处理
数据均用±s表示,组间比较采用t检验。
2 结果与分析
2.1 PRM对D-gal衰老小鼠体质量的影响
给D-gal前各组小鼠毛色白,有光泽。小鼠颈背部皮下注射D-gal连续4周后,小鼠毛色灰暗、失去光泽、形体瘦弱、行动缓慢、精神萎靡不振,呈现明显衰老体征;说明D-gal衰老模型建立成功。各组小鼠体质量变化如表1,结果表明,与正常组相比,D-gal模型组小鼠体质量增长明显缓慢;PR M高、低剂量(4 0 0、200mg/kg bw)组和VE(50mg/kg bw)组小鼠体质量增长高于模型组小鼠,其中以PRM高剂量组最为明显。说明PRM对D-gal所致的小鼠体质量增长缓慢有明显的改善作用。
2.2 PRM对D-gal衰老小鼠肝肾组织MDA含量和SOD活性的影响
正常机体的自由基氧化作用与抗氧化防御作用处于动态平衡状态,当自由基产生过多,和/或清除自由基的酶系统的防御功能减退时,这种动态平衡失调,导致生物体老化[9]。脂质过氧化(LPO)产物MDA的水平可反映活性氧损伤效应;SOD活性是反映机体抗氧化能力的重要指标。
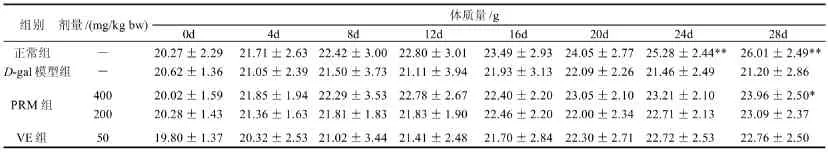
表1 PRM对D-gal衰老小鼠体质量的影响(n=10)Table1 Effect of PRM on body weight of D-galactose-induced aged mice (n=10)

表2 PRM对D-gal衰老小鼠肝肾组织中SOD活性的影响(n=10)Table2 Effect of PRM on SOD activity in liver and kidney of D-galactose-induced aged mice (n=10)

表3 PRM对D-gal衰老小鼠肝肾组织中MDA含量的影响(n=10)Table3 Effect of PRM on MDA content in liver and kidney of D-galactose-induced aged mice (n=10)
表2、3表明,与正常对照组相比,D-gal模型组衰老小鼠肝、肾组织中SOD活性显著降低,MDA含量显著升高;PRM高、低剂量(400、200mg/kg bw)和VE(50mg/kg bw)均可使MDA含量显著降低,SOD活性显著升高。说明PRM可使D-gal衰老小鼠肝肾组织中的脂质过氧化产物MDA含量明显降低,同时上调D-gal衰老小鼠的SOD活性,增强其抗氧化能力。
2.3 PRM对D-gal衰老小鼠免疫器官质量、脾细胞ConA増殖反应与IL-2产生的影响
胸腺和脾脏是体内重要的免疫器官。IL-2位居免疫调节的中心地位,脾淋巴细胞的ConA增殖反应和ConA诱导脾细胞产生IL-2活性是评价机体免疫功能的重要指标[10]。
D-gal衰老小鼠的胸腺指数明显低于同龄正常对照鼠,而脾指数无明显差异;PR M高、低剂量(4 00、200mg/kg bw)可明显恢复D-gal衰老小鼠的胸腺指数(表4)。D-gal衰老小鼠脾细胞Con A増殖反应与IL-2产生均明显低于同龄正常对照鼠(P<0.01);PRM高、低剂量(400、200mg/kg bw)可明显恢复D-gal衰老小鼠的ConA増殖反应与IL-2产生(P<0.05或P<0.01)(表5)。说明PRM具有提高机体保护性免疫反应的作用。

表4 PRM对D-gal衰老小鼠胸腺和脾脏指数的影响(n=10)Table4 Effect of PRM on thymus and spleen indexes of D-galactoseinduced aged mice (n=10)

表5 PRM对D-gal衰老小鼠脾淋巴细胞增殖反应和IL-2产生的影响(n=10)Table5 Effect of PRM on proliferation response of spleen lymphocytes and IL-2 production in D-galactose-induced aged mice (n=10)
2.4 PRM对D-gal衰老小鼠巨噬细胞增殖反应以及IL-1和NO产生的影响
巨噬细胞和淋巴细胞是导致细胞损伤的主要效应细胞,IL-1是淋巴细胞活化因子,为导致细胞调亡的主要因子, NO也参与了凋亡的发生[11]。

表6 PRM对小鼠巨噬细胞增殖反应和IL-1、NO产生的影响(n=10)Table6 Effect of PRM on proliferation response of macrophages and generation of IL-1 and NO in D-galactose-induced aged mice (n=10)
表6结果表明,D-gal衰老小鼠巨噬细胞增殖反应、IL-1和NO产生均明显高于同龄正常对照鼠(P<0.01);PRM高、低剂量(400、200mg/kg bw)可明显降低D-gal衰老小鼠的巨噬细胞增殖反应、IL-1和NO产生(P<0.05),说明菜籽多糖具有抑制机体破坏性免疫反应的作用。
3 结 论
3.1 PRM(400、200mg/kg bw)对D-gal所致的小鼠体质量增长缓慢有明显的改善作用。
3.2 PRM(400、200mg/kg bw)可使D-gal衰老小鼠肝肾组织中的脂质过氧化产物MDA含量明显降低,同时上调抗氧化酶SOD活性。说明PRM可降低衰老前期小鼠体内活性氧的损伤效应和改善其体内抗氧化能力。
3.3 PRM (400、200mg/kg bw)可明显提高D-gal衰老小鼠的胸腺指数,并可明显恢复D-gal衰老小鼠低下的脾细胞ConA増殖反应与IL-2产生;说明PRM具有提高机体保护性免疫反应的作用。
3.4 PRM(400、200mg/kg bw)可明显降低D-gal衰老小鼠升高的巨噬细胞增殖反应、IL-1和NO产生。说明PRM具有抑制机体破坏性免疫反应的作用。
[1] 严奉伟, 邓明, 朱建飞.菜籽粕综合利用[J].粮食与油脂, 2005(9): 6-8.
[2] 孙汉巨, 姜邵通, 赵荣敏.菜籽饼粕多糖对小鼠免疫功能的影响[J].食品科学, 2008, 29(11): 567-571.
[4] LEI Hong, WANG Bin, LI Weiping, et al.Anti-aging effect of astragalosides and its mechanism of action[J].Acta Pharmacol Sin,2003, 24(3): 230-234.
[5] 张石宁, 陈明, 肖红, 等.D-半乳糖致衰老模型的研究[J].临床精神医学杂志, 1998, 8(6): 327-328.
[6] 初晓, 姚如泳, 韩志武.茶多酚对D-半乳糖致衰老小鼠免疫功能的调节作用[J].中国医院药学杂志, 2006, 26(5): 637-638.
[7] 钟福孙, 胡文艺, 冯弛.硫代巴比妥酸比色法测定血清过氧化脂质[J].临床检验学杂志, 1986(4): 129-130.
[8] 丁桂凤, 席宏丽, 邓玉兰.用活化小鼠脾细胞测定IL-2[J].上海免疫学杂志, 1988, 8(1): 64-66.
[9] NOHL H.Involvement of free fadicals in ageing:a consequence or cause of senescerce[J].British Medical Bulletin, 1993, 49(3): 653-658.
[10] 黄凤杰, 吴梧桐.鲨肝活性肽S-8300免疫调节作用的研究[J].中国天然药物, 2005, 3(2): 121-123.
[11] MALEK M A, MOHAMMAD A.Nitric oxide involvement in pancreaticβcell apoptosis by glibenclamide[J].Nitric Oxide, 2006, 14(1):39-44.

