神经节苷脂对新生鼠缺血再灌注脑损伤神经细胞凋亡的影响
刘 华,付翠捧,孙晓梅,吴玲玲
目前,因围产期窒息导致的新生儿缺氧缺血性脑损伤是新生儿病死的主要原因之一,新生儿缺血缺氧性脑损伤 (hypoxic ischemic brain damage,HIBD)是围生期新生儿窒息引起的脑损伤,是常见病、多发病。严重者可威胁新生儿生命,生存者易留下神经系统后遗症,如脑瘫、智力障碍、癫痫、痉挛和共济失调等。必须及早用药干预治疗。但目前治疗效果尚不太满意。故寻找治疗HIBD更为有效的方法有重要意义。有研究显示外源性单唾液酸四已糖神经节苷脂(GM1)可以透过血脑屏障,模拟内源性GM1减轻脑缺血再灌注损伤[1,2]。为探讨GM1在脑缺氧缺血后神经元的保护作用及在神经细胞的凋亡过程中的作用,笔者在新生大鼠脑缺血再灌注模型基础上,通过给予外源性GM1,分组比较,以病理学及相关血清学指标的测定为依据以探讨GM1在HIBD中的作用与机制。
1 材料方法
1.1 实验动物及分组 生后6 d Sprague-Dawley(SD)新生大鼠30只(购自东南大学实验部),雌雄不限,体重10~25 g。随机分为A组(假手术对照组)10只,B 组(脑缺血再灌注组)10只,C 组(GM1治疗组)10只。其中,B组、C组缺血2 h再灌注46 h,C组于术前30 min和建模后即刻及24 h以后腹腔注射GM1,每次用量10 mg/kg,术后48 h取静脉血后迅速处死各组动物。
1.2 动物模型的制备[3]采用改良的Longa动脉拴线法制备大脑中动脉缺血再灌注模型。B组和C组于术后2 h将尼龙线拔除。A组除不插尼龙线外步骤同上。
1.3 电镜标本的制作 A、B、C组各取2只大鼠,迅速处死后,取出距额极5 mm处的梗塞灶边缘区脑组织 1 mm×1 mm×1 mm,固定、脱水、包埋、切片、染色后,应用JEM-200电镜观察、照片。
1.4 测内皮素(ET) 用放射免疫方法(试剂盒购自301医院东亚免疫技术研究所)。
1.5 血清NO水平测定 用镀铜镉还原法。测定外周血中NO2-/NO3-含量,721型分光光度计(上海第三仪器厂生产),波长545mm处测定各样本的吸光度值,系列亚硝酸盐溶液建立标准曲线。
1.6 细胞凋亡染色 采用TUNEL法(TUNEL试剂盒购自北京中山生物制品公司)。
1.7 图像分析与统计学处理 用Leuzer-F型图像分析仪,在400倍视野下,每张切片随机选取4个区域,每个区域面积均为200 μm×200 μm,区域TUNEL染色阳性细胞数。实验数据求出±s,均数间的显著性分析采用t检验。
2 结 果
2.1 切片大体外观 A组皮质、基底节等区域神经细胞无变性、坏死现象,神经元细胞形态结构正常,偶见凋亡神经元细胞。B组缺血侧皮质、基底节等区域神经细胞变性、坏死灶多见,电镜下部分细胞溶解、破碎,周边大量神经细胞体积皱缩,表面迂曲,胞膜内陷,染色质聚集于核膜下呈小块状,可见大小不等的凋亡小体。C组缺血侧皮质和基底节等区域的神经元,无变性、坏死改变,毛细血管内皮细胞肿胀,胶质细胞足突轻度水肿,电镜下细胞核不规则,染色质轻度聚集,核仁清晰可见,线粒体除少许肿胀外,多数正常。
2.2 ET测定结果 B、C组血浆ET含量明显高于A 组(P<0.01),而 C 组明显低于 B 组(P<0.01),见表1。
2.3 血清NO水平 A组与B组比较差异非常显著(t=4.094,P<0.01);A组与C组比较无显著性差异(t=0.657,P>0.05);B组与C组比较有非常显著性差异(t=3.239,P<0.01)。 见表 1。
表1 三组鼠血浆ET及血清NO测定结果(±s)

表1 三组鼠血浆ET及血清NO测定结果(±s)
与 A 组比较,△P<0.01;与 B 组比较,※P<0.01
A组 B组 C组ET(ng/L) 31.6±3.06 50.45±5.21△ 41.67±4.20△※NO(mol/L) 44.67±8.6 63.65±9.9△ 47.7±9.8※
2.4 TUNEL染色阳性细胞数 凋亡神经细胞核呈棕色,在A组中偶可见凋亡细胞,B组凋亡细胞主要位于梗塞边缘区的内侧,梗塞中心区域可见散在的凋亡细胞,C组凋亡细胞数量更少,其凋亡细胞的分布形式与B组相似,见表2。
3 讨 论
3.1 GM1的脑保护作用 本文结果显示缺血再灌注组梗塞区的病理变化明显重于GM1治疗组(P<0.01),GM1治疗组鼠脑梗塞区多数神经胶质细胞未发现不可逆改变,超微结构相对完整,无明显血管源性及细胞毒性水肿变化,表明外源性GM1的应用可在一定程度上减轻脑神经细胞的变性、坏死的病理过程。细胞凋亡是严格基因凋控的细胞程序性死亡,多种因素可诱导或抑制细胞凋亡的发生,笔者通过 TUNEL染色发现,局灶性脑缺血再灌注后有大量凋亡细胞出现,主要分布于梗塞边缘区内侧,即缺血半暗带,这与LIY等的观察结果一致。而位于缺血半暗带的脑神经细胞功能尚处于可逆阶段,此时若给予有效的功能恢复措施,细胞功能可复原如初。本文结果表明,使用GM1组细胞凋亡过程受到抑制,说明GM1有保护脑细胞作用。
表2 三组新生大鼠TUNEL染色阳性细胞数(±s)
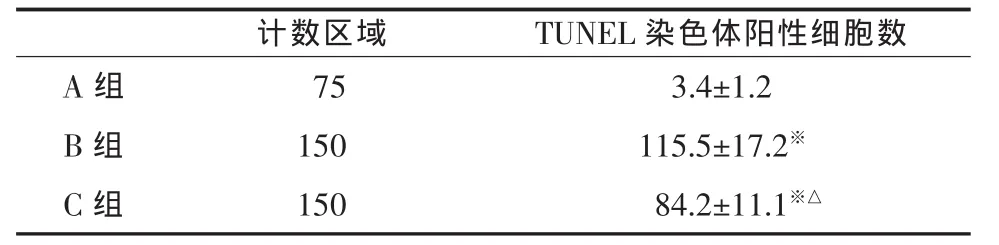
表2 三组新生大鼠TUNEL染色阳性细胞数(±s)
与 A 组比较,※P<0.01;与 B 组比较,△P<0.01
计数区域 TUNEL染色体阳性细胞数A 组 75 3.4±1.2 B 组 150 115.5±17.2※C 组 150 84.2±11.1※△
3.2 内皮素的作用 经动物实验和临床证实,在脑缺血或急性脑梗死早期,测定血浆内皮素(endothelin,ET)即有明显升高,ET是一种血管活性肽,其收缩血管作用强于血管紧张素Ⅱ、加压素及神经肽Y,且持久。ET升高可引起缺血区侧枝血管强烈、持久地收缩,使病灶局部血流进一步减少,加重梗塞区脑组织及神经细胞损伤,形成恶性循环,影响预后及转归。本文在脑缺血再灌注48 h测得ET明显升高,但C组的ET升高明显低于B组,说明ET升高持续于再灌注后,缺血区血流再通过后其区域的微小血管处于高度收缩状态,对脑组织损伤作用可能在于再灌注损伤之中,本文结果证明GM1有明显降低内皮素作用,防止缺血区血管及微小血管强烈痉挛所造成的脑组织持续损伤,因而有明显的脑保护作用,但GM1降低内皮素的作用是直接的还是通过抗自由基而减轻脑组织血管内皮损伤实现的,有待于进一步研究。
3.3 GM1对血清NO的影响 本文结果显示,缺血再灌注组NO2-/NO3-含量明显高于假手术对照组(P<0.01),而GM1治疗组其含量明显低于缺血再灌注组(P<0.01)。NO是一种具有自由基性质的气体生物活性分子,脑缺血缺氧后可出现血清NO暂时性或一过性升高[2,5],而延迟性升高多发生在24 h达高峰,并维持数天。大量研究表明,NO在脑缺氧缺血性损伤中具有神经保护和神经毒性的双重作用,生理状态下,NOS催化L2Arg和分子氧生成低水平固有型NO,作为内皮源性舒张因子具有舒张血管、抑制血小板聚集、防止血栓形成、拮抗氧自由基的作用;但HIBD后nNOS及iNOS被激活[6-8],NO过度合成则可干扰与生物转化有关的酶类的活性、破坏DNA结构、抑制线粒体的呼吸功能,具有明显的神经毒性作用,与进一步导致脑水肿等脑损伤有关,造成神经元的损伤。其功能在脑缺血再灌注组NO2-/NO3-含量明显高于假手术对照组也表明此机制。而且,GMI治疗组与其他组比较可推断GM1通过降低血清NO测定值起到保护脑神经细胞的作用[9]。
研究表明GM1通过抑制SD大鼠脑缺血再灌注后ET和NO的生成减轻神经元细胞的变性、坏死,抑制神经元细胞的凋亡,起到脑保护作用。
[1]Niwa K,Lindauer U,Villringer A,et al.Blockade of nitric oxide synthesis in rats strongly attenuates the CBF response to extracellar acidosis[J].J Cereb Blood Flow Metab,1993,13:535-539.
[2]汪 洁,孙玉娟,陈黎勤,等.新生儿窒息后一氧化氮水平的动态变化及其临床意义[J].中华儿科杂志,1998,36(12):737-739.
[3]Ferrai G,Anderson BL,Stephens RM,et al Prevention of apoptoic neuronal death by GM1 ganglioside[J].Biol Chem,1995,270:3074.
[4]Li Y,Chopp M,Jiang N,et al.Induction of DNA fragmentation after 10 to 120 minutes of focal cerebral ischemia in rats[J].Strock,1995,26:1252.
[5]Zhang ZG,Chopp M,Zaloga C,et al.Cerebral endothelial nitric oxide synthesis expression after focal cerebral ischemia in rats[J].Strock,1993,234:2016-2022.
[6]马 丽,孙 志,马惠青.中药在新生儿缺氧缺血性脑病治疗中的应用[J].儿科药学杂志,2006,12(3):64-66.
[7]Ji HL,Wang TY.Puerarin inhibits tetrodotoxin-resistant so-diumcurrent in rat dorsal root ganglion neurons[J].Acta Pharmacol Sin,1996,17(2):115-118.
[8]Zhang GQ,Hao XM,Zhou PA,et al.Puerarin blocks transient out ward current and delayed rectifier current in mice hippocampal CA1 neurons[J].Acta Pharmacol Sin,2001,22(3):253-256.
[9]范海虹,汪华侨,刘存领,等.新生大鼠缺血缺氧性脑损伤后神经节苷脂的保护作用[J].实用儿科临床杂志,2000,15(6):311-313.

