基于多重PCR的寡核苷酸基因芯片检测猪瘟病毒,猪繁殖与呼吸障碍综合征病毒及猪圆环病毒1型和2型
姜永厚,商晗武,徐 辉,朱良俊,丁先锋,陈伟杰,赵灵燕,方 立
(1.浙江理工大学生命科学学院,浙江杭州310018;2.中国计量学院生命科学学院,浙江杭州310018;3.浙江省动物疫病预防控制中心,浙江杭州310020;4.浙江大学动物科学学院,浙江杭州310029)
猪瘟病毒(Classical swine fever virus,CSFV),猪繁殖与呼吸障碍综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)和猪圆环病毒 2型(Porcine circovirus type 2,PCV-2)是引起繁殖和/或呼吸障碍的重要病原。在集约化养猪生产中发现,当猪同时感染上述两种或两种以上的病毒病原体时,会出现较严重的临床症状和病变[1-2]。猪圆环病毒1型(PCV-1)和PCV-2都属于圆环病毒科,PCV-1被认为是PK-15细胞系的污染物,并不具有致病性[3]。尽管两者致病性差异很大,但它们的基因组非常相似,序列同源性超过80%[4]。因此PCV-1也包括在本研究中。
单重PCR或RT-PCR已被用于检测和鉴定上述病毒[5-7],但是逐个检测几种病毒费时费力。已有报道多重PCR能灵敏快速地检测几种猪病毒[8]。但由于引物对的增加,可能会导致非特异性反应,结果难以判定[9]。而近年来发展起来的芯片检测技术是一种建立在特异性核酸杂交基础上,并结合PCR技术,具有灵敏度高、特异性强及高通量的优点,已被广泛用于病原体的检测等方面,该技术原理上可以同时检测无限多的病原物[10-12]。
本研究建立了一种基于多重PCR的寡核苷酸基因芯片检测和区分CSFV、PRRSV、PCV-1和PCV-2的方法,并利用标准毒株和临床样本对该方法的特异性和灵敏度进行了评价。
1 材料和方法
1.1 病毒株和临床样本 PRRSV和CSFV毒株由本实验室保存,PCV-1和PCV-2参考株由浙江大学周继勇教授提供。阴性对照包括牛病毒性腹泻病毒(BVDV),无 PCV、CSFV和 PRRSV污染的 PK-15细胞购自中国兽药监察所,猪传染性胃肠炎病毒(TGEV)和猪流行性腹泻病毒(PEDV)二联冻干活疫苗为哈尔滨维科生物技术公司产品,伪狂犬病病毒(PRV)疫苗株购自中牧实业股份有限公司。于2006年6月到2007年7月期间采集自11个农场中的4周龄~12周龄患有呼吸和/或繁殖障碍症状的仔猪和流产胎儿的76份临床样本,包括淋巴结、扁桃体、肺和脾,经PCR、实时荧光定量PCR和ELISA鉴定,由本实验室保存。
1.2 主要试剂 PCR产物纯化试剂盒为杭州V-gene公司产品;pGEM-T载体为Promega公司产品;RNA/DNA抽提试剂盒为宝生物工程(大连)有限公司产品;反转录酶、TaqDNA聚合酶、dNTP、蛋白酶K,均为上海生工生物技术公司产品;大肠杆菌E.coliDH5α,马铃薯18S rRNA基因重组质粒由本实验室保存。
1.3 寡核苷酸探针和引物的设计 根据GenBank登录的PCV-1、PCV-2、PRRSV和 CSFV的序列,选择保守序列和变异序列作为诊断区域,设计种特异性引物和种与型特异性探针。应用Primer Premier 5.0软件,根据以下设计原则进行设计探针:1、长度为22个~30个碱基;2、该探针在较窄范围的熔解温度(Tm),在65℃到75℃间;3、基因型之间的同源序列有2个以上的错配。在诊断区域的保守序列,用Primer Premier 5.0软件设计PCV-1和PCV-2通用的上游引物和下游引物。将一条基于马铃薯18S rRNA基因的寡核苷酸和一条用于杂交的Cy5标记的互补链作为阳性对照。两条和目的片段无相似性的植物病毒探针作为阴性对照。并用BLAST分析所设计的探针序列的特异性。在每个探针的5'端添加了poly T10尾并氨基化,以便于和醛基化的玻璃表面共价结合。所设计的PCR引物及探针由上海生工生物工程技术服务有限公司合成。引物和探针及其特性具体见表1。
1.4 芯片制作 利用芯片点样仪将10 μM寡核苷酸探针液(1×SSC为150 mM NaCl,15 mM的柠檬酸钠,pH7.0)点制于醛基化的玻璃片上,每个点20 nL,每一条寡链核苷酸探针重复点3次。点样时湿度维持在70%~75%之间,避免点样液的快速蒸发,以便氨基化的寡核苷酸探针与玻片表面的醛基充分联结。一张玻片点制两个相同PCV阵列,以同时检测两份样品。点样之后,将芯片放在点样仪里水合2 h,75℃烘干30 min。将点制的芯片用新鲜配置的含1%NaBH4的0.01 M磷酸缓冲液孵育30 min,用0.2%的SDS溶液洗涤1 min,用蒸馏水洗涤2次,每次1 min,以洗去未结合的寡核苷酸探针。制备的芯片于室温干燥,保存备用。
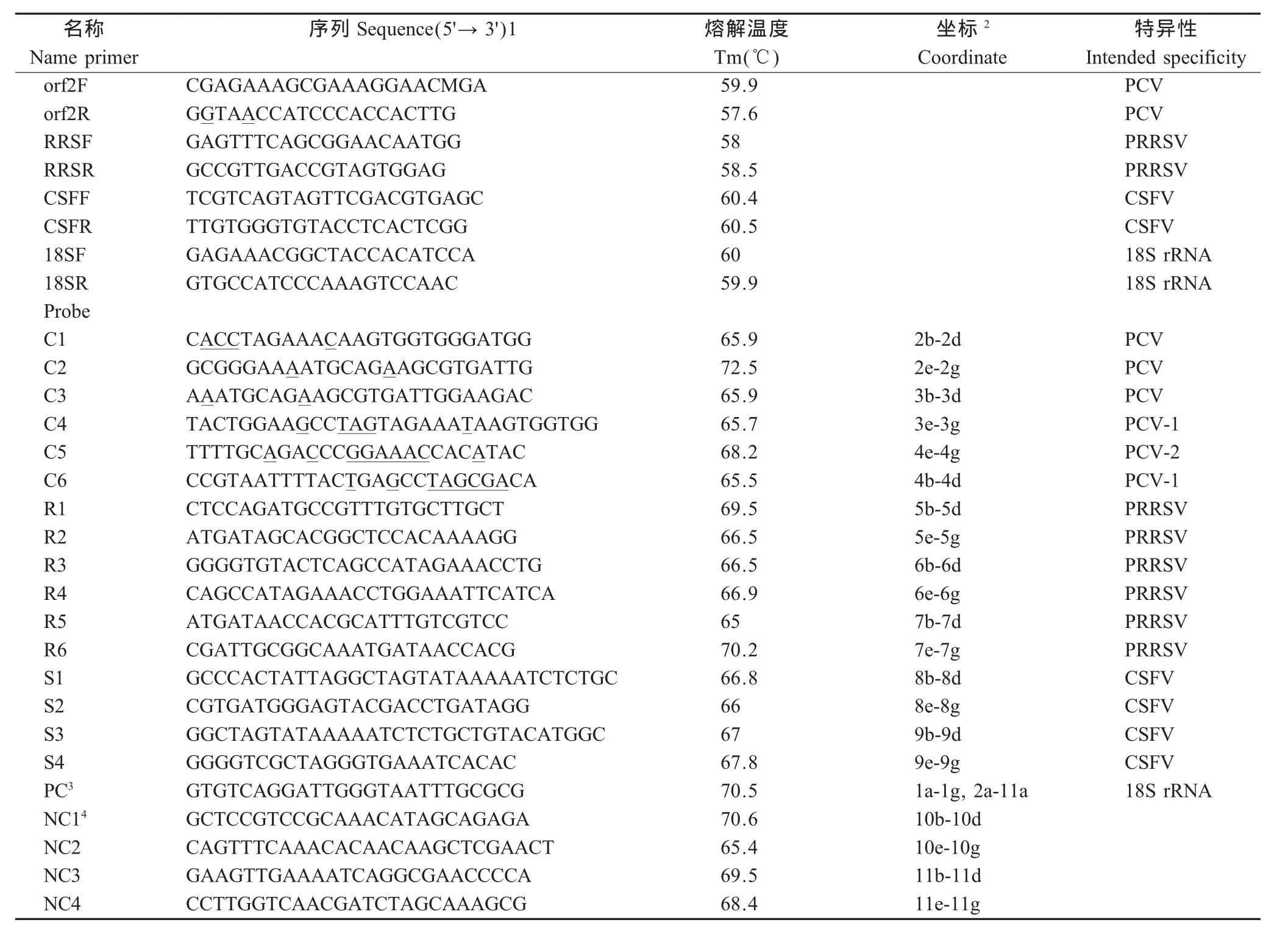
表1 设计的寡核苷酸引物和探针及其特性Table 1 List of primers and probes sequences,Tm,coordinate and intended specificity for the primers and probes used in this study
1.5 反转录 在cDNA的合成中,2 μL病毒RNA/DNA加入总体积为20 μL的反应体系中,包括4 μL的 5×反转录酶buffer,dNTP 0.5 mM,1.25 μM的CSFR和PRSR,20 u的核糖核酸酶抑制剂和5 u的AMV反转录酶。42℃下反应60 min,然后在94℃下变性3 min,后置于冰上备用。
1.6 PCR扩增 PCR反应总体积为 25 μL。PCR扩增反应程序:94℃3 min;94℃30 s,55℃30 s,72℃30 s,35个循环;72℃7 min。PCR产物进行2.5%琼脂糖电泳,EB染色和凝胶成像检测。
1.7 模板质粒的构建 构建含有特异病毒靶标的质粒用于基因芯片的检测灵敏度测定。将单个病毒扩增产物(表1)经PCR产物纯化后分别克隆至pGEM-T载体,重组质粒提取并分别经PCR和DNA测序验证。用分光光度计测定重组质粒DNA浓度。
1.8 目的片段标记 扩增反应的标记按照上述PCR反应系统进行,不同的是用10 nM dCTP和4 nM Cy5-dCTP代替200 mM dCTP,或2 μL重组质粒代替2 μL病毒DNA或cDNA。PCR产物用0.1倍体积3 M NaAc和2倍体积的无水乙醇在-20℃沉淀2 h。沉淀物空气中干燥后用20℃L的1×杂交缓冲液对该沉淀物重新溶解。用相同的方法处理阳性对照。
1.9 杂 交 杂交前,将10 μL Cy5标记的PCR产物和10 μL Cy5标记的阳性对照混合,于95℃变性5 min,然后在冰上迅速冷却5 min。将混合物均分成两份,每份10 μL,分别加于芯片两个区域,然后盖上盖玻片(1.8 cm×1.8 cm),45℃杂交1.5 h,用含0.1%SDS的0.2×SSC洗涤玻片5 min,再用0.1×SSC洗涤5 min,吸耳球吹干。
1.10 信号检测和数据分析 杂交结束后用GenePix 4100A扫描仪对该寡核苷酸芯片进行扫描,激发波长为635 nm,PMT电压为750,扫描分辨率为10 μm。用GenePix Pro 5.0软件对每个点的荧光信号进行测量,分析该寡核苷酸芯片。当探针荧光强度值大于1000,并且信噪比SNR(探针荧光强度值/局部背景荧光强度值)大于1.5时,判定为阳性。
2 结 果
2.1 诊断区选择和靶标基因片段制备 在对PCV、PRRSV和CSFV序列联配的基础上,在PCV复制酶基因序列内选择了371 bp片段,PRRSV ORF6基因内451 bp片段,以及CSFV 5端非编码基因内328 bp片段作为诊断区域,另外254 bp片段的马铃薯18S rRNA基因片段选作阳性诊断区。琼脂糖凝胶电泳显示,PCV、PRRSV和CSFV的单重和多重PCR均能扩增出预期大小的目的片段(图1)。
2.2 检测和区分 PCV-1、PCV-2、PRRSV与CSFV 标记的病毒扩增产物分别与芯片杂交,与预期一致,大多数探针均特异地与对应靶标杂交产生很强的信号(图2)。针对PCV-1特异设计的C4探针,虽然和其靶标片段杂交时产生强的信号,但是在两种基因型间也发生较强的交叉反应。但这并不影响对杂交结果的解释,杂交图谱清楚地表明,该芯片技术能够检测并鉴别PCV基因型、PRRSV和CSFV。而且,当其它的一些常见病毒,如BVDV,TGEV,PEDV和PRV,用同样的引物进行标记扩增和杂交时,均无阳性信号产生,进一步证实了该芯片的特异性。

基因芯片靶标灵敏度通过杂交5倍系列稀释的多重PCR产物进行评价。基因芯片可检测低至0.08 ng/μL PCR 产物(PCV-2),相当于 8×107拷贝数/μL;而琼脂糖凝胶检测低限为2 ng/μL PCR产物。表明基因芯片检测的灵敏度大约是琼脂糖凝胶电泳的25倍。通过多重PCR扩增系列稀释的含靶标片段的质粒和芯片杂交,得到基于多重PCR的基因芯片检测模板灵敏度为1.6×104PCV-2拷贝数/μL,1.6×105PRRSV 拷贝数 /μL,1.6×104CSFV 拷贝数 /μL,比琼脂糖凝胶电泳灵敏约10倍。实验重复3次,均获得了类似的结果。
2.3 芯片的临床应用 利用建立的基因芯片方法对76个临床样本进行了 PCV-1,PCV-2,CSFV和PRRSV检测,然后使用同样的3对特异性引物进行单重PCR/RT-PCR检测以及阳性样本的PCR产物DNA测序进行验证,两者结果符合率为100%。与以前的鉴定结果基本一致,基因芯片检测阳性的41个样本PCR也为阳性,基因芯片检测阴性的35个样本中有2个样本为荧光定量PCR检测PRRSV阳性。25个样本同时感染其中2或3个病毒(表2)。

表2 基因芯片检测76个临床样本3种病毒感染Table 2 Frequency of the three viruses alone or in combination in 76 clinical specimens detected by the multiplex PCR based oligonucleotide microarray
3 讨论
探针的选择和设计是基因芯片检测病原物非常重要的一个环节,许多与探针设计有关的因素影响芯片测定的可靠性,尤其对特异性和灵敏度[13]。使用寡核苷酸探针与标记目的片段进行杂交,是一种常见的芯片技术平台。研究表明长15 mer到30 mer的短寡核苷酸探针可以区分亲缘关系很近的病毒,甚至可以识别出多态位点[12,14]。在本实验中,我们在每一诊断区域设计了4条~5条长22 mer至30 mer的寡核苷酸探针来检测和鉴别PCV、PRRSV和CSFV。所有和靶标片段完全匹配的型或种特异性探针与另一个基因型或其它病毒的相应序列至少有4个碱基错配,除C4探针外其它探针均特异地产生很强的杂交信号。尽管Wang等研究认为3个碱基的错配就可以防止交叉杂交[12],但本研究中C4探针在PCV基因型间产生较强的交叉杂交,可能是由于错配在另一基因型的诊断区稀疏的分布。在预试验中我们针对每种病毒设计了7条~10条探针,但几条探针产生假阴性或虚弱信号[15]。这可能是由于在靶标片段内部相应区域形成了稳定的二极结构而阻止了探针与之结合,因此无法检测到杂交信号。Peplies等添加可结合到探针结合位点附近的未标记辅助寡核苷酸,使探针与原结合位点的结合有所增加,证实了这种猜测[16]。
灵敏度是衡量基因芯片临床应用水平的一个重要指标之一。本试验中用基因芯片检测扩增靶标片段的灵敏度是琼脂糖凝胶电泳的25倍左右,而基于多重PCR的基因芯片检测模板灵敏度比琼脂糖凝胶电泳灵敏约10倍,与其它文献报道结果相近[9]。另外,如果将更多的Cy5-dCTP加入扩增标记反应,会进一步提高检测灵敏度,而且,用单链DNA样品代替双链DNA进行杂交,也可提高杂交信号的强度[14]。因此,建立在PCR基础上的基因芯片技术是一种更加灵敏的检测技术。
除了具有同时检测微量样品中多种病原物的能力,基因芯片技术可方便地获得特异的探针,而且根据需要,通过设计靶标探针,更多的检测病原物可以添加到这个系统,目前本实验室正开展此方面的研究。
与基于凝胶电泳的多重PCR方法相比,基于多重PCR的基因芯片检测方法另一个优点是不需要设计不同的扩增产物大小。本研究中设计了不同大小的扩增产物仅为了与基于凝胶电泳的多重PCR方法比较。为多重PCR设计不同大小的扩增产物是一项复杂的程序,而且不同大小的扩增产物可能导致不同的扩增效率。
本研究对所述几种猪病毒对疑似呼吸和/或繁殖障碍症状的76个样品进行了检测。基因芯片检测结果与PCR、荧光定量PCR和ELISA的结果基本一致,2个荧光定量PCR检测PRRSV阳性的样本基因芯片检测阴性,可能是由于是两者灵敏度的差异。在中国多个地区发现混合感染PRRSV/PCV-2,PCV-1/PCV-2或PRRSV/CSFV[17-20]。本研究获得的数据亦表明,同时感染2种或3种上述病毒比较普遍。
总之,基于多重PCR的基因芯片方法对于检测和确定猪群感染一种或多种病毒是一种省时、省力的有效方法,本研究建立的基因芯片检测方法可用于猪病流行病学调查以及实验室临床分离株的鉴定。
[1]Kennedy S,Mofett D,McNeily F,et al.Reproduction of lesions of postweaning multisystemic wasting syndrome by infection of conventional pigs with porcine circovirus type 2 alone or in combination with porcine parvovirus[J].J Comp Pathol,2001,122:9-24.
[2]Rovira A,Balasch M,Segales J,et al.Experimental inoculation of conventional pigs with porcine reproductive and respiratory syndrome virus(PRRSV)and porcine circovirus type-2[J].J Virol,2002,76:3232-3239.
[3]Allan G M,McNeilly F,Cassidy J P,et al.Pathogenesis of porcine circovirus;experimental infections of colostrum deprived piglets and examination of pigs fetal material[J].Vet Microbiol,1995,44:49-64.
[4]Meehan B M,McNeilly F,Todd D,et al.Characterization of novel circovirus DNAs associated with wasting syndromes in pigs[J].J Gen Virol,1998,79:2171-2179.
[5]Cheon D,Chae C.Comparison of virus isolation,reverse transcription polymerase chain reaction,immunohistochemistry,and in situ hybridization for the detection of porcine reproductive and respiratory syndrome virus from naturally aborted fetuses and stillborn piglets[J].J Vet Diagn Invest,2000,12:582-587.
[6]Caprioli A,McNeilly F,McNair I,et al.PCR detection of porcine circovirus type 2(PCV2)DNA in blood,tonsillar and faecal swabs from experimentally infected pigs[J].Res Vet Sci,2006,81:287-292.
[7]Pan C H,Jong M H,Huang Y L,et al.Rapid detection and differentiation of wild-type and three attenuated lapinized vaccine strains of classical swine fever virus by reverse transcription polymerase chain reaction[J].J Vet Diagn Invest,2008,20:448-456.[8]Giammarioli M,Pellegrini C,Casciari C,et al.Development of a novel hot-start multiplex PCR for simultaneous detection of classical swine fever virus,African swine fever virus,porcine circovirus type 2,porcine reproductive and respiratory syndrome virus and porcine parvovirus[J].Vet Res Commun,2008,32:255-262.
[9]Gonzalez S F,Krug M J,Nielsen M E,et al.Simultaneous detection of marine fish pathogens by using multiplex PCR and a DNA microarray[J].J Clin Microbiol,2004,42:1414-1419.
[10]Hsiaa C C,Chizhikovb V E,Yangc A X,et al.Microarray multiplex assay for the simultaneous detection and discrimination of hepatitis B,hepatitis C,and human immunodeficiency type-1 viruses in human blood samples[J].Biochem Bioph Res Co,2007,356:1017-1023.
[11]Jack P J M,Amos-Ritchie R N,Reverter A,et al.Microarray-based detection of viruses causing vesicular or vesicular-like lesions in livestock animals[J].Vet Microbiol,2009,133:145-153.
[12]Wang Z,Orlandi PA,Stenger D A.Simultaneous detection of four human pathogenic microsporidian species from clinical samples by oligonucleotide microarray[J].J Clin Microbiol,2005,43:4121-4128.
[13]Loy A,Bodrossy L.Highly parallel microbial diagnostics using oligonucleotide microarrays[J].Clinica Chimica Acta,2006,363:106-119.
[14]Chizhikov V,Wagner M,Ivshina A,et al.Detection and genotyping of human group A rotaviruses by oligonucleotide microarray hybridization[J].J Clin Microbiol,2002,40:2398-2407.
[15]Townsend M B,Dawson E D,Mehlmann M,et al.Experimental evaluation of the FluChip diagnostic microarray for influenza virus surveillance[J].J Clin Microbiol,2006,44:2863-2871.
[16]Peplies J,Glockner F O,Amann R.Optimization strategies for DNA microarray-based detection of bacteria with 16S rRNA-targeting oligonucleotide probes[J].Appl Environ Microbiol,2003,69:1397-1407.
[17]崔力,姚从斌,芦银华,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].上海交通大学学报,2006,24(4):330-334.
[18]董信田,李玉峰,姜平,等.猪繁殖与呼吸综合征病毒和猪瘟病毒混合感染的检测[J].畜牧与兽医,2006,38:15-17.
[19]贾赟,芦银华,张素芳,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].中国病毒学,2004,19(5):467-470.
[20]杨宗照,方维焕.猪瘟合并猪繁殖与呼吸综合征病毒(PRRSV)和猪圆环病毒2型(PCV2)感染[J].中国兽医学报,2006,26:240-242.
- 中国预防兽医学报的其它文章
- 猴源人隐孢子虫的分离与鉴定

