猴源人隐孢子虫的分离与鉴定
徐前明,程家林,李国清*,叶亦见,梁详解,岳彩玲,高振勇
(1.华南农业大学兽医学院,广东广州510642;2.中国科学院广州生物医药与健康研究院,广东广州510663)
隐孢子虫病(Cryptosporidiosis)是由隐孢子虫感染而引起的以腹泻为主要临床表现的一种人兽共患原虫病。隐孢子虫可感染大多数脊椎动物,包括人类,免疫正常的个体感染后引起自限性腹泻,在免疫功能受损的患者则引起渐进性致死性腹泻。目前,公认的隐孢子虫有18种[1]。关于灵长类包括猴在内感染隐孢子虫已见报道,但虫体的分类地位尚未明确[2]。Xiao等从猴体内发现一株人隐孢子虫(Cryptosporidium hominis),并对该虫的部分基因进行了研究[3]。在关于隐孢子虫种和基因型与宿主关系的阐述中,Xiao和Ryan进一步明确了C.hominis可以感染灵长类动物,说明C.hominis可以感染猴,至于猴的品种与C.hominis存在何种相关性有待于进一步确定[1]。本研究以恒河猴(Macaca mulatta)为研究对象,对其感染的隐孢子虫进行了分离和鉴定,旨在探明感染不同灵长类动物的隐孢子虫种类以及与感染人的C.hominis之间的遗传差异,以便更好地控制C.hominis由灵长类动物传播给人或相互传播途径,为防治该病提供实验依据。
1 材料和方法
1.1 实验动物与虫株 恒河猴来自广东省灵长类实验动物中心的实验用猴。隐孢子虫虫株是从恒河猴粪便中采用蔗糖漂浮法分离而得。
1.2 主要试剂 EXTaq酶、M-MLV RTase cDNA Synthesis Kit、pMD18-T载体质粒系统均为TaKaRa公司产品;蛋白酶K购自Merk公司;蛋白胨和酵母浸出物购自OXOID公司;氨苄青霉素、Tris碱和十二烷基硫酸钠(SDS)购自广州美津生物技术有限公司;蔗糖购自天津大茂化学试剂厂;碱性品红购自北京瀛海精细化工厂;孔雀绿购自天津化学试剂一厂。
1.3 形态学鉴定 卵囊的分离与纯化以及改良抗酸法染色均参照文献[4]的方法进行。荧光显微镜观察参照文献[5]的方法进行。
1.4 虫体基因组DNA的抽提 将纯化后的隐孢子虫卵囊在液氮中反复冻融3次,加入270 μL的虫体裂解缓冲液轻轻混匀,再加入30 μL 20 mg/mL的蛋白酶K进行消化,55℃水浴24 h,其间混匀多次,使卵囊裂解充分。加入等体积的氯仿,混匀,12000 r/min离心10 min,将其上清转移至一新的eppendorf管中,加入0.7倍体积的异丙醇沉淀20 min,12000 r/min离心10 min,去上清,用70%乙醇洗涤,12000 r/min离心5 min,去上清,沉淀物于干燥箱内干燥10 min,用50 μL TE溶液(pH8.0)进行溶解,加入 1 μL RNase A(10 mg/mL)消化 RNA,电泳检测。提取的基因组DNA于-20℃冰箱冻存、备用。
1.5 引物设计 扩增卵囊壁蛋白(COWP)基因的引物参照GenBank登录的序列(QQ388399.1)进行设计。引物为Pc1:5'-GGACTGAAATACAGGCATTATCTT G-3'; Pc2: 5'-GTAGATAATGGAAGAGATTGTG-3',预计扩增片段大小为554 bp。扩增18S rRNA基因的引物参照GenBank登录的序列(EU032325.1)进行设计。引物为18SF:5'-AGTGACAAGAAATAACAA TACAGG-3';18SR:5'-CCTGCTTTAAGCACTCTAA TTTTC-3',预计扩增片段大小为370 bp左右。
1.6 卵囊壁蛋白(COWP)和18S rRNA基因的扩增25 μL 反应体系为:ddH2O 15.85 μL; 10×buffer 2.5 μL;25 mmol/L MgCl21.5 μL;2.5 mmol/L dNTP 2 μL;上、下游引物(20 pmol/μL)各 1 μL;基因组DNA 1 μL; EXTaq 酶 (1 u/μL)0.15 μL。 扩 增COWP基因的反应条件为:95℃5 min;94℃45 s,55℃ 45 s,72℃ 1 min,30个循环;72℃ 10 min。扩增18S rRNA基因的反应条件为:95℃ 5 min;94℃30 s,55℃30 s,72℃30 s,30个循环;72℃5 min;16℃保存。
1.7 序列测定与分析 分别将PCR扩增产物克隆至pMD-18-T载体中,阳性克隆送交上海生物工程有限公司进行测序;对所得的序列采用Mega4.0软件进行序列分析,采用NJ法构建进化树。
2 结果
2.1 抗酸染色和荧光检查结果 卵囊经抗酸染色后呈玫瑰红色,形状规则,似圆形或椭圆形;卵囊内含有4个呈月牙形的子孢子,均被染成玫瑰红色,且有明显的折光(图1)。而其他非特异性颗粒则不易着色。低倍荧光显微镜下对卵囊自发荧光进行观察,可见卵囊为一圆形小亮点,呈现乳白色荧光;卵囊壁周围略深染,中央淡染,似环状(图2)。

2.2 目的基因扩增结果 猴源隐孢子虫COWP基因PCR扩增的结果,可见在550 bp左右有明显的目的条带出现,与预期结果一致(图3);猴源隐孢子虫18S rRNA基因PCR扩增,可见在370 bp左右有明显的目的条带出现,与预期结果一致(图4)。

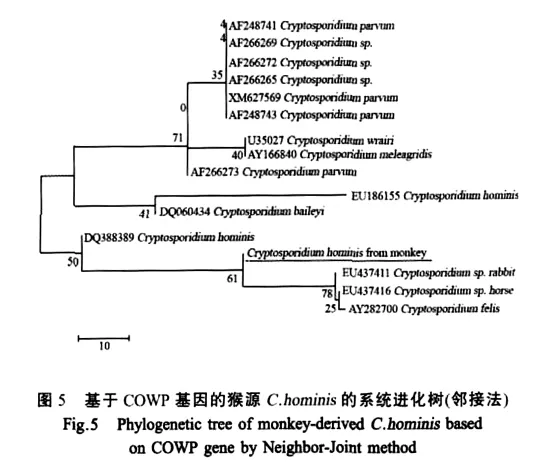
2.3 基因序列分析 将所获得的猴源隐孢子虫两个基因的序列在NCBI中进行Blast比对,其与Gen-Bank登录的C.hominisCOWP基因序列(QQ388399.1)和18S rRNA基因序列(FJ707311.1)的相似性均为100%。所得COWP基因序列经邻接法分析后,结果表明猴源隐孢子虫与C.hominis相关基因序列遗传距离最近(图5)。所得18S rRNA基因序列经邻接法分析后,结果表明猴源隐孢子虫与C.hominis相关基因序列在系统进化树上的遗传距离最近(图6)。

3 讨 论
隐孢子虫属于顶复门的寄生原虫,主要寄生在胃肠道上皮细胞微绒毛的刷状缘,可广泛感染包括人类在内的脊椎动物,而且各种隐孢子虫的致病性不同。微小隐孢子虫(C.parvum)是隐孢子虫中致病性最强的一种,可感染人和多种动物。此外,C.hominis主要感染人,也可感染灵长类动物[1],已证实松鼠猴、猕猴和东南非猴的腹泻与隐孢子虫感染有关[2,6-7]。Xiao等对各种宿主的隐孢子虫相关基因作了进化树分析,认为猴源隐孢子虫和人源隐孢子虫在分类上最为接近,并从猴体内分离到一种变异性较大的C.hominis[3,8]。基于灵长类动物与人类的亲缘关系,对猴源隐孢子虫准确鉴定不仅有助于虫种分类地位的确定,也有助于分子流行病学调查,以便防止隐孢子虫由猴传播给人。这不仅对兽医工作具有积极意义,在公共卫生学上也具有重要作用。
人隐孢子虫和微小隐孢子虫的形态基本相似。近年来,有关灵长类隐孢子虫包括从松鼠猴、绿猴、红狐猴、狨、蜘蛛猴、赤猴、狒狒[9-11]和大猩猩[12]粪便中分离的隐孢子虫在形态上均难以与C.parvum进行区别。本研究所分离的猴源隐孢子虫大小为4.6 μm~5.2 μm×3.7 μm~4.0 μm,虽然与 Ryan 等报道的人隐孢子虫大小基本一致,但从形态方面亦很难与C.parvum进行区别,需要借助分子生物学方法进行分子鉴定[13]。
常用于隐孢子虫分子分类的遗传标记有结构蛋白和非结构蛋白基因,如18S rRNA基因、COWP基因、血小板反应素相关粘附蛋白(TRAP)基因、二氢叶酸还原酶(DHFR)基因、70 ku热休克蛋白(HSP70)基因和乙酰辅酶A合成酶基因以及易变异的rDNA内转录间隔区(ITS-1和ITS-2)[14]。其中,COWP和18S rRNA以及HSP70基因在隐孢子虫鉴定方面最为常用[15]。本研究对猴源隐孢子虫鉴定时选用了COWP和18S rRNA作为参考基因,实验结果表明所用的参考基因均能有效地鉴定猴源隐孢子虫种类。猴源隐孢子虫的COWP和18S rRNA基因测序结果经NCBI信息库比对,所得到的两个基因序列与C.hominis同一基因的相似性均为100%。对分离的猴源隐孢子虫的COWP和18S rRNA基因序列采用邻接法作进化树分析,它们在进化树上的遗传距离均与C.hominis最为接近,这与Xiao[3]的报道基本一致。综合上述分析,我们认为本次分离的猴源隐孢子虫属于C.hominis。
[1]Xiao L H,Ryan U M.Molecular epidemiology inCryptosporidiumand Cryptosporidiosis[M].CRC Press and IWA Publishing,Boca Raton,2008,119-163.
[2]Bryant J L,Stills H F,Middleton C.Cryptosporidiosis in Squirrel monkeys(Saimiri scuireus)[J].Lab Ani Sci,1983,33:482.
[3]Xiao L H,Morgan U M,Limor J,et al.Genetic diversity within Cryptosporidium parvumand relatedCryptosporidiumspecies[J].Appl Environ Microbiol,1999,65(8):3386-3391.
[4]周庆新,李锦春,李培英,等.合肥市某奶牛场奶牛隐孢子虫病流行病学调查[J].河北农业科学,2008,12(1):122-124.
[5]Varea M,Clavel A,Doiz O,et al.Fuchsin fluorescence and autofluorescence in Cryptosporidium,Isospora and Cyclospora oocysts[J].Int J Parasitol.1998,28(12):1881-1883.
[6]Gomez M S,Gracenea M,Gosalbez P,et al.Detection of oocysts ofCryptosporidiumin several species of monkeys and in one prosimian species at the Barcelona zoo[J].Parasitol Res,1992,78(7):611-620.
[7]Kaup F J,Kuhn E M,Makoschey B,et al.Cryptosporidiosis of liver in pancreas in rhesus monkeys with experimental SIV infection[J].J Med Primatol,1994,23(5):304-308.
[8]Xiao L H,Irshad M S,Una M R,et al.Host adaptation and host parasite co-evolution inCryptosporidium:implications for taxonomy and public health [J].Int J Parasitol,2002,32(14):1773-1785.
[9]Riggs M W.Cryptosporidiosis in cats,dogs,ferrets,racoons,opossums,rabbits,and nonhuman primates[M].CRC Press,Boca Raton,FL,1990,113-123.
[10]Kalishman J,Paul-Murphy J,Scheffler J,et al.Survey ofCryptosporidiumandGiardia spp.in a captive population of common marmosets[J].Lab Ani Sci,1996,46(1):116-119.
[11]Fayer R,Speer C A,Dubey J P.The general biology of Cryptosporidium:CryptosporidiumandCryptosporidiosis[M].CRC Press,Boca Raton,1997,1-41.
[12]Nizeyi J B,Mwebe R,Nanteza A,et al.Cryptosporidium sp.and Giardiasp.infectionsin mountain gorillas(Gorillagorilla beringei)of the Bwindi Impenetrable National Park,Ugandap[J].J Parasitol,1999,85(6):1084-1088.
[13]Morgan-Ryan U M,Fall A,Ward L A,et al.Cryptosporidiumhominis n.sp.(Apicomplexa:Cryptosporidiidae)from Homo sapiens[J].J Eukaryotic Microbiol,2002,49(6):433-440.
[14]杨建伟,李国清.隐孢子虫病原分类研究进展[J].热带医学杂志.2008,8(7):742-745.
[15]Alexandre J,Silva D,Simone C,et al.Molecular and morphologic characterization of aCryptosporidiumgenotype identified in lemurs[J].Vet Parasitol,2003,111(4):297-307.

