IKKβ真核表达载体的构建及表达
张冬梅,杨媚婷,刘 瑛,于春雷,乌 垠,李玉新,,鲍永利*
(1.东北师范大学药物基因和蛋白筛选国家工程实验室,吉林长春 130024;2.东北师范大学 生命科学学院;3.白城市中心医院)
IKKβ真核表达载体的构建及表达
张冬梅1,杨媚婷2,刘 瑛3,于春雷1,乌 垠1,李玉新1,2,鲍永利1*
(1.东北师范大学药物基因和蛋白筛选国家工程实验室,吉林长春 130024;2.东北师范大学 生命科学学院;3.白城市中心医院)
目的构建核转录因子κ B抑制蛋白激酶(inhibitor of kappa B kinase,IKK)β真核表达载体,以便进一步探讨其生物学作用。方法从人正常肝细胞L02中提取RNA,并利用IKKβ特异性引物通过RT-PCR方法扩增了IKKβ cDNA,并克隆入pcDNA3载体中,构建重组载体pcDNA3-IKKβ。将重组载体转染入HEK293细胞中,并通过免疫印迹方法检测IKKβ的表达。结果酶切及测序结果显示,重组质粒构建成功;免疫印迹结果显示,瞬时转染重组质粒的人胚肾细胞HEK293中可有效表达IKK β。结论本研究成功构建了IKK β真核表达载体,并能够在真核细胞中进行表达,为进一步研究IKKβ的生物学功能奠定了基础。
IKK β;载体构建;真核表达
(Chin J Lab Diagn,2010,14:0977)
近年来的研究表明,核转录因子κ B(nuclear factor-kappa B,NF-κ B)通过调控多种基因的表达,参与细胞生长、发育、凋亡等多种生理功能,并在细胞恶性转化、纤维化等方面起重要作用[1]。NF-κ B抑制蛋白激酶(inhibitor of kappa B kinase,IKK)β 是NF-κ B激活通路中的关键激酶。外部刺激因子如TNF-α、IL-1、LPS、双链 RNA 和病毒通过激活 IKK[2],诱发Iκ B 的磷酸化而降 解失活 。NF-κ B 失去 Iκ B 抑 制而活化,从细胞质转移到细胞核内,与靶基因κ B位点结合,迅速诱导靶基因的转录[3,4],包括负反馈机制的自身抑制蛋白 Iκ Bα和 Iκ Bβ、各种细胞因子和趋化因子、抗凋亡基因、c-myc和 cyclin D1等,从而影响免疫、炎症和细胞周期调控等[5]。基因靶向实验证实,IKKβ是促炎因子激活NF-κ B必需的IKK亚基,所有激活 IKK的因素均直接影响NF-κ B的活化[6]。
为了进一步研究此基因的功能及其在NF-κ B信号转导中的具体作用,我们用IKKβ的特异引物通过RT-PCR方法从人正常肝细胞L02中钓取了IKKβ的全长表达序列,并克隆入真核表达载体进行表达。
1 材料与方法
1.1 主要材料和试剂
pcDNA3.1质粒、L02细胞及HEK293细胞由东北师范大学遗传与细胞研究所提供;兔抗IKKβ多克隆抗体购自Santa Cruz公司;TRIzol试剂及逆转录试剂均购自GIBCOBRL公司;限制性内切酶HindⅢ、KpnⅠ、Taq DNA聚合酶及T4连接酶购自TAKARA公司;胶回收试剂盒购自Vitagen公司;Transfast转染试剂购自Promega公司;ECL购自Amersham pharmacia公司。
1.2 方法
1.2.1 总RNA提取
将人正常肝细胞L02在12孔培养板中培养至对数生长期,用冷PBS洗涤后,每孔加入Trizol 1 ml,吹打均匀后加入200 μ l氯仿,混匀,4℃,12 000 rpm,离心15分钟,取上清,然后加入500 μ l异丙醇沉淀,混匀后,室温放置10分钟,4℃,12 000 rpm,离心10分钟,沉淀用70%乙醇洗一次,4℃,7 500 rpm离心10分钟,沉淀用真空抽干,溶于20 μ l DEPC水中备用。
1.2.2 RT-PCR
取总 RNA 5 μ g 用 DEPC 水调整至 14.25 μ l,然后加入Oligo-dT 1μ l,70℃,2分钟后置于冰上,加入5 μ l反应缓冲液 ,2.5 μ l 2.5 mM dNTP,1.25 μ l 0.1 M DTT,1 μ l逆 转录酶,37℃,90 分钟 ,然后加入 75 μ l DEPC水。取5 μ l反应产物做模板,用特异性 IKKβ引物进行PCR反应。上游端引物:5′-CCAAGCTTCCACCATGAGCTGGTCAC-3′下游端引物 :5′-GGGGTAC CTGAGGCCTGCTCCAGGC-3′。上游端及下游端引物中分别含有HindⅢ和KpnⅠ酶切位点。将扩增产物进行琼脂糖凝胶电泳,在紫外灯照射下切取目的片段,用凝胶回收试剂盒回收目的DNA片段。
1.2.3 pcDNA3-IKKβ体的构建及鉴定
将回收的IKKβcDNA片段及pcDNA3.1载体分别用HindⅢ和KpnⅠ双酶切后回收目的片段,将回收的片段及质粒用T4 DNA连接酶进行连接,16℃连接过夜。用上述连接产物转化DH5α感受态菌,涂平板,次日挑取单个克隆进行扩增并提取质粒。将提取的重组质粒以及载体pcDNA3.1分别用HindⅢ和KpnⅠ双酶切。将酶切鉴定正确的重组质粒进行测序鉴定。
1.2.4 用重组质粒瞬时转染HEK293细胞
将HEK293细胞铺入6孔板,每孔3×105个细胞,37℃5%CO2孵箱培养。次日用PBS将细胞洗一次待用。取两只离心管,各加入2 ml DMEM无血清培养基,分别加入pcDNA3.1及pcDNA3-IKKβ质粒各 3 μ g,然后加入 9 μ l Transfast 转染试剂,涡旋混匀20秒,室温静置15分钟,然后加入6孔板中,37℃5%CO2孵箱培养1小时后,每孔加入2 ml DMEM完全培养基。37℃5%CO2孵箱培养48小时。
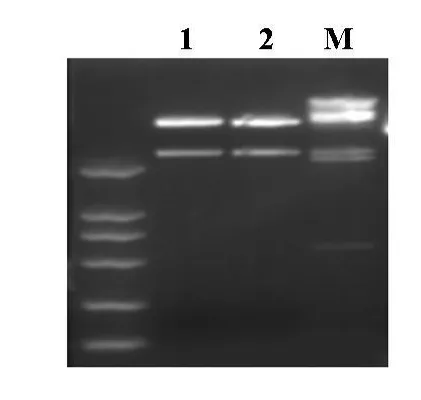
图1 PCR扩增IKK β全长表达序列

图2 重组质粒的酶切鉴定
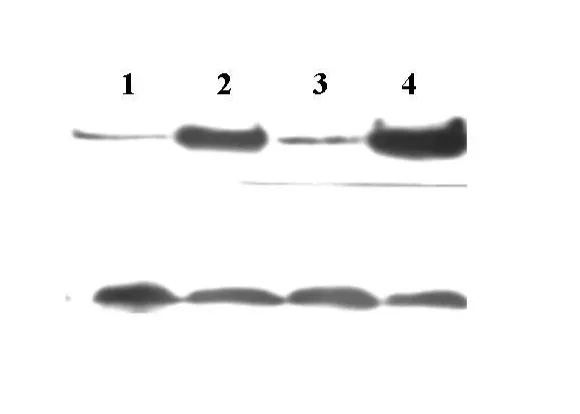
图3 IKK β在真核细胞中的表达
1.2.5 免疫印迹法检测重组质粒的表达
将转染后的HEK293细胞用PBS洗涤后,每孔加入100 μ l含有蛋白酶抑制剂的裂解缓冲液(50 mM Tris-HCl(pH7.5),150 mM NaCl,1 mM NaF,0.5%NP-40,Aprotinin 2 μ g/ml,1 mM PMSF)。用加样器吹打后移至离心管中,冰上放置20分钟后4℃离心20分钟,将上清液移至新的离心管中。在HEK293细胞裂解物中加入等体积的上样缓冲液,煮沸10分钟后放于冰上冷却,将此混合液加至SDS-PAGE凝胶上电泳分离,然后电转印到PVDF膜上。将此膜用抗IKKβ多克隆抗体杂交,之后用HRP标记的羊抗兔IgG作用,最后加入ECL,通过使X光胶片曝光来鉴定蛋白的表达情况。
2 结果
2.1 RNA提取及RT-PCR
用Trizol提取L02细胞总RNA,并以此总RNA为模板,利用IKKβ特异性引物通过RT-PCR方法扩增出一条2 270 bp左右的DNA片段(见图1),与理论推测的IKKβ表达序列的大小一致。
2.2 pcDNA3.1-IKKβ重组质粒的连接及鉴定
将PCR片段用HindⅢ和KpnⅠ双酶切,回收IKKβ片段,同时将pcDNA3.1用同样的酶酶切后进行连接。连接产物转化感受态DH5α后提取质粒,将提取的质粒用HindⅢ和KpnⅠ双酶切鉴定。结果如图2所示,重组质粒经酶切后出现一个载体片段及一个2 270 bp左右的DNA片段。将此质粒送至上海联合基因公司进行测序。结果显示,重组质粒构建正确。
2.3 免疫印迹法检测IKKβ的表达
将重组质粒转染到HEK293细胞中,将细胞裂解液通过SDS-PAGE电泳分离后转移至PVDF膜上,然后用抗IKKβ多克隆抗体及酶标羊抗兔抗体进行免疫印迹分析,通过ECL试剂发光后使X光胶片显影。结果如图3所示,对照HEK293中仅有少量内源性IKKβ蛋白表达,而转染了重组质粒的细胞中则有大量IKKβ蛋白表达,说明重组质粒在HEK293细胞中可有效表达IKKβ蛋白。
3 讨论
NF-κ B是一种重要的二聚体核转录因子,存在于多种细胞中,参与细胞的黏附、炎性细胞的趋化、增殖等多种生理、病理过程中相关的基因转录,具有重要的生理和病理意义[7-9]。Iκ B激酶(IKK)是NF-κ B信号系统上游的一个关键激酶,在绝大多数情况下是NF-κ B激活的共同通路。在未激活条件下,NF-κ B与其抑制物Iκ B以无活性的复合物形式存在于胞浆中。当细胞受到胞外信号刺激时,通过一个或多个信号转导途径,激活一系列激酶,使 Iκ B N端两个特异性位点的丝氨酸磷酸化,随后赖氨酸残基发生泛素化,最后,在26S蛋白酶体的作用下,Iκ B降解,NF-κ B与 Iκ B 发生解离,并迅速从细胞浆移至细胞核,与靶基因上的κ B位点发生特异性结合,调控相应的基因表达。在此过程中,IKK是最关键的激酶。IKK包括IKKα和IKKβ,其多肽分为激酶区、亮氨酸拉链样结构和螺旋环状结构。IKK被抑制则使NF-κ B不能转位入细胞核内,从而不能发挥促转录和调控细胞各种活动的功能[10-11]。本研究采取RT-PCR方法,从人肝细胞L02中成功钓取了IKKβ全长cDNA序列,并将其克隆入真核表达载体中进行表达,为进一步研究NF-κ B的信号传递机制奠定了基础。
[1]Shen HM,TergaonkarV.NFκ Bsignaling in carcinogenesis and as a potential molecular target for cancer therapy[J].Apoptosis,2009,14:348.
[2]Ghosh S,Karin M.Missing pieces in the NF-κ B puzzle[J].Cell,2002,109(Supp1):S81.
[3]Ziegelbauel K,GantnerF,Lukacs NW,et al.A selective novel Low molecular weight inhibitor of Iκ B kinase-β(IKK-β)prevents pulmonary inflammation and shows broad anti-flammatory activity[J].BrJ Pharmacol,2005,145(2):178.
[4]Wong ET and Tergaonkar V.Roles of NF-κ B in health and disease:mechanisms and therapeutic potential[J].Clinical Science,2009,116:451.
[5]Luo JL,Kamata H,KarinM.IKK/NFκ B signaling:balancing life and death-a new app roach to cancer therapy[J].The Journal of Clinical Investigation,2005,115(10):2625.
[6]Bamborough P,Callahan JF,Christopher JA,et al.Progress towards the development of anti-inflammatory inhibitors of IKK beta[J].Curr Top Med Chem,2009,9(7):623.
[7]Trinh DV,Zhu N,Farhang G,et al.The nuclear I κ appa B protein Iκ appa B zeta specifically binds NF-κ B p50 homodimers and forms ternary complex on κ B DNA[J].J Mol Biol,2008,379(1):122.
[8]Piette J,Piret B.Multipie redox regulation in NF-к B transcription factor activation[J].Biol Chem,1997,378(11):1237.
[9]May MJ,Ghosh S.Signal transduction through.NF-к B[J].Immuno Today,1998,19(2):80.
[10]Liu SF.NFκ B activation and the strategy of blocking progress[J].Guowai Yixue:Bingli Kexue yu Linchuang Fence,2005,25(3):264.
[11]Lynn M,Lali F,Willetts K,et al.Rac mediates TNF-induced cytokine productionviamodulation of NF-Κ b[J].Mol Immunol,2008,45(9):2446.
Construction of eukaryotic vector of inhibitor of kappa B kinase β and expression in HEK293 cells
ZHANGDong-mei,YANG Mei-ting,LIU Ying,et al.(National Engineering Laboratory forDruggable Gene and Protein Screening,Northeast Normal University,Changchun130024,China)
ObjectiveConstruct the inhibitor of kappa B kinase β recombinant eukaryotic expression vector,in order to further investigate the biological function of IKKβ.MethodsExtract total RNA from human liver cell L02 and amplify IKKβ cDNA by RTPCR using specific primers.Then the cDNA was inserted into vector pcDNA3 to construct the recombinant vector pcDNA-IKKβ,then the recombinant vector was transfectedinto human embryonic kidney cellHEK293 and the protein expression was detected by western blot.ResultsEnzyme restriction and sequencing data indicated that the recombinant vector was constructed exactly,western blot result shown that the IKKβ recombinant eukaryotic expression vector can efficiently express IKK β in HEK293 cells.ConclusionThe eukaryotic expression vector pcDNA3-IKKβ is constructed and expresses in HEK293 cells successfully,which establish the foundation for future research on IKK β gene function.
IKKβ;construction of expression vector;eukaryotic expression
G78
A
1007-4287(2010)07-0977-03
国家自然科学基金项目(30672068),吉林省科技发展计划项目(200805131)
*通讯作者
鲍永利,女,42岁,博士学位,教授,博士生导师,主要研究方向为肿瘤发生机制研究及抗肿瘤新药研发。
2009-12-28)

