血清SCC-Ag检测在宫颈鳞癌患者的治疗与病情监测中的临床价值
潘高辉,毛彩萍,张毅敏,徐笑红
(浙江省肿瘤医院,浙江 杭州 310022)
宫颈癌是女性恶性肿瘤中仅次于于乳腺癌的第二大恶性疾病[1],严重威胁着妇女的健康,而宫颈癌约90%是鳞癌[2],如何早期、快捷地协助诊断和跟踪治疗是医患共同的心愿,我们应用化学发光微粒子免疫分析法测定2084例宫颈鳞癌病人的血清SCC-Ag,现报告如下。
1 材料与方法
1.1 材料
对象为2007年1月~2009年12月首次在本院治疗的2084例宫颈鳞癌患者(不包括在外院开刀再到本院放/化疗的患者),所有病例均经活检或手术切片病理诊断证实,年龄29~71岁,平均42岁,按FIGO临床分期Ⅰa期444例,Ⅰb期215例,Ⅱa期315例,Ⅱb期595例,Ⅲ期392例,Ⅳ期123例;Ⅰa1子宫全切/锥切术,Ⅰa2~Ⅱa期根治手术(广泛子宫切除和盆腔淋巴结清扫),Ⅱb~Ⅲb期根治性同步放化疗,Ⅳ期患者以化疗为主的综合治疗;同期本院职工(健康体检)90人的SCC-Ag为正常对照,同期住院和门诊妇科良性肿瘤组宫颈上皮细胞不典型增生、子宫肌瘤、子宫颈炎等患者宫颈刮片或病理切片无恶性表现证据的患者1175例的SCC-Ag作为良性疾病对照。
1.2 测定方法及原理
取患者静脉血血清,运用美国雅培公司生产的酶免分析系统ARCHITECT I20000,测定SCC-Ag,其原理是将待测物与包被于微粒子的相应的抗体结合,再与吖啶酯标记抗体结合形成微粒子复合物,此复合物被磁石吸附在反应杯的管壁上,清洗去除未结合物质,加入预激发液与激发液,N-methylacridone形成并释放能量(光发射),根据化学发光发射的量(活动读数),计算分析物浓度,故称化学发光微粒子免疫分析法(CMIA),结果测定≤1.5ng/ml为阴性,>1.5ng/ml为阳性。
1.3 统计学处理
使用SPSS统计软件包,计量资料采用t检验,计数资料采用χ2检验。
2 结果
2.1 SCC-Ag测定的敏感性与特异性 宫颈鳞癌组(2084例)SCC-Ag阳性1784例,阳性率是85.6%(1784/2084),妇科良性肿瘤组(1175例)阳性89例,阳性率7.6%(89/1175),健康体检组无1例阳性,宫颈鳞癌组与妇科良性肿瘤组及健康体检组比较差异显著 (P<0.01),SCC-Ag对于宫颈鳞癌的敏感性85.6%,特异性92.4%(1086/1175),具体见表1。

表1 不同组患者血清SCC-Ag含量的阳性率
2.2 SCC-Ag值与宫颈鳞癌临床分期关系 宫颈鳞癌各临床分期与健康体检组及妇科良性肿瘤组比较,均有显著差异(P<0.01),见表 2。
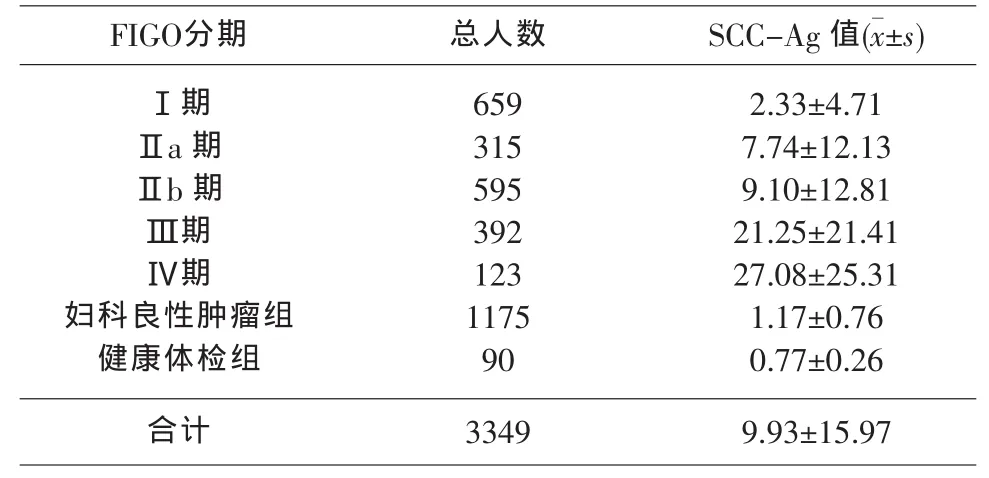
表2 依据FIGO分期及对照组与SCC-Ag含量的关系
2.3 SCC-Ag值与宫颈鳞癌患者有无淋巴转移关系
本组资料Ⅰa~Ⅱa期手术患者中有18例Ⅰa1期只做宫宫颈锥切未做淋巴结清扫,其余956例均做盆腔淋巴结清扫术,统计该部分数据发现有淋巴转移的152例中有118例其SCC-Ag值>1.5ng/ml,阳性率为77.6%(118/152);无淋巴转移的 804例中SCC-Ag值>1.5ng/ml的有199例,阳性率为24.8%(199/804),两者比较有差异(P<0.01)。
2.4 Ⅰa~Ⅱa期患者术前与术后及Ⅱb~Ⅳ期患者放/化疗前后SCC-Ag值的变化
本文将Ⅰa~Ⅱa期患者术后5天内及Ⅱb~Ⅳ期患者放化疗后20天内再次检测SCC-Ag的病例,作术前与术后、放化疗前与放化疗后的的比对,发现该部分患者治疗后的SCC-Ag值普遍下降,姑息性治疗者也有不同程度下降。见表3。
3 讨论
本组SCC-Ag的检测对于宫颈鳞癌的敏感性(85.6%)并不特别高,特异性很高(92.4%),与国内外报道相近[3-4],但与良性妇科肿瘤及健康体检组比较均有显著性差异,但全身鳞状上皮组织若有病变均可使其SCC-Ag升高而造成假阳性,因此在有临床症状或体征时,SCC-Ag的水平增高可作为宫颈鳞癌的一项实验室检测指标。
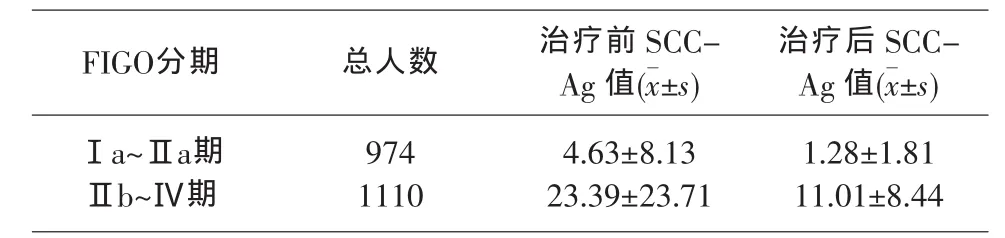
表3 Ⅰa~Ⅱa期患者术前/放化疗与术后/放化疗后SCC-Ag含量ng/ml的变化
SCC-Ag的检测其意义不仅仅在于阳性率的高低,表2显示,SCC-Ag水平的高低还与宫颈鳞癌的临床分期有密切相关,且随疾病的分期进展而逐渐升高,在Ⅰa~Ⅱa期的手术患者中,有淋巴结转移的152例中有118例SCC-Ag阳性,其阳性率为77.6%;无淋巴转移的804例中SCC-Ag阳性的有199例,阳性率为24.8%,两者经χ2检验差异显著(P<0.01),说明手术患者有无淋巴转移对于其后续治疗即是否需要辅以放/化疗等治疗有一定的指导意义。
在患者经过手术后其SCC-Ag值明显下降 (表3),根治性手术成功的病例SCC-Ag多在1~2d降至阴性,国内多篇文献[5-6]也报道术后比术前SCC-Ag值有普遍下降,因而SCC-Ag水平变化可作为手术治疗效果的观察是共识。同样,放疗和/或化疗后的病例其SCC-Ag水平比治疗前下降明显(表3),姑息性治疗的患者,在经过一定时间的治疗后其SCCAg水平也有不同程度的下降,这在一定程度上反映了宫颈鳞癌的手术与放化的疗效,但SCC-Ag作为鳞癌肿瘤标志物在晚期宫颈鳞癌中更有价值[7],患者病情好转时SCC-Ag浓度下降,相反病情恶化时患者SCC-Ag上升,SCC-Ag水平的测定也适用于Ⅱb-Ⅳ期放疗后的随访,可鉴别放疗盆腔纤维化与疾病复发,由于获得SCC-Ag的结果比较方便快捷,连续监测可用于帮助判断治疗效果,以便及时调整治疗方案。
由于宫颈鳞癌的临床分期是根据肿瘤的浸润深度、肿块的大小、侵犯黏膜的程度及有无远处转移等众多因素来界定的,故这些分期参考因子均与SCC-Ag有密切联系,Duk等[8]用Cox风险回归模型分析303例手术治疗的早期(Ia-IIa)宫颈鳞癌患者发现SCC-Ag水平与局部肿瘤大小、病理分级、脉管浸润、间质浸润深度及淋巴结转移众多因素中,术前SCC-Ag水平为独立影响因素,由于本次案例的病理只作分级报告而细胞类型分型不是很完整,故未作统计处理,但可见小细胞型的病例其SCC-Ag普遍较高,这需要进一步的数据来证明。
综上所述,在众多应用于临床的肿瘤标志物中,SCC-Ag是一项较特异的宫颈鳞癌的检测指标,测定方法简单、准确,其测定水平可作为治疗和病情观察的辅助措施。
[1]中华人民共和国卫生部.2009中国卫生统计年鉴[M].北京:中国协和医科大学出版社.
[2]Makhlpuf HR,Remotti HE,Ishak KG.Expression of KIT(CD117)in angimydipoma[J].Am J Surg Pathol,2002,26(4):493-497.
[3]李建华,杨宇星,董春雷.鳞状上皮细胞癌抗原监测宫颈鳞癌的临床价值[J].肿瘤防治研究,2002,29(5):406-407.
[4]刘联斌,周茂华,王 琪,等.血清鳞状上皮细胞癌抗原测定对宫颈鳞癌的诊断价值[J].临床检验杂志,2009,27(2):154.
[5]蒋鹏程,曾四元,傅晓艳,等.宫颈鳞癌患者血清鳞状上皮细胞癌抗原检测及其意义[J].实用癌症杂志,2000,15(5):508-510.
[6]孔双燕.鳞状上皮细胞癌抗原检测在宫颈鳞癌中的临床意义[J].浙江实用医学,2009;14(1):51-52.
[7]Aoki D,Hirasawa A,Susumu N.Diagnostic significance of tumer markers for gynecologic maligancies[J].Japanese Journal of Cancer and Chemotherapy,2005,32(3):411-416.
[8]Duk BJM,Groenier KH,Bruijn HWA,et al.Pretreatment serum squamous cell carcinoma antigen:a newly identified prognostic factor in early-stage cervical cancer[J].Clin Oncol,1996,14(1):111.

