葡萄感染霜霉病菌后几种信号物质的变化
林志强, 李希东, 侯丽霞, 张英昊, 刘 新
(青岛农业大学生命科学学院,青岛 266109)
葡萄感染霜霉病菌后几种信号物质的变化
林志强, 李希东, 侯丽霞, 张英昊, 刘 新*
(青岛农业大学生命科学学院,青岛 266109)
以3个抗病性不同的酿酒葡萄品种(‘西拉’>‘霞多丽’>‘赤霞珠’)叶片为材料,检测霜霉病菌侵染后几种病原相关信号物质,如脱落酸(ABA)、过氧化氢(H2O2)、一氧化氮(NO)、茉莉酸(JA)和乙烯(ETH)等的变化,以探讨葡萄抵御霜霉病菌的信号转导机制。结果表明,H2O2和NO是葡萄感应霜霉病菌的早期信号分子,且抗性较强的品种‘西拉’的变化最为明显;JA和ABA是抗性较差品种‘赤霞珠’应答霜霉病的信号组分。而3个抗性不同葡萄品种的乙烯变化无明显差别。推测H2O2、NO、JA和ABA均参与了葡萄对霜霉病菌的防御反应,但不同品种间信号转导组分可能存在差异。
葡萄; 霜霉病; 信号物质; 抗病性
由葡萄霜霉病菌[Plasmoparaviticola(Berk.etCurtis)Ber.etde Toni]引起的葡萄霜霉病(grape downy mildew)是葡萄生产中最严重的真菌病害之一[1-2]。在酿酒葡萄的栽培和生长过程中极易发生,严重影响着植株的生长和果实的产量及品质,进而也大大制约了葡萄酒的产量和品质[3]。因此,选育抗霜霉病的葡萄品种,研究其致病机理和抗病机制成为农业科学工作者的一项重要任务。
不同葡萄品种对霜霉病菌的抗性存在着明显的差异,沙月霞等发现不同葡萄品种对霜霉病菌的抗性表现出明显差异,‘白比诺’(‘Pinot Blanc’)抗性最强,‘品丽珠’(‘Cabernet France’)抗性最弱[4]。研究表明,植物感病后会发生过敏反应、胼胝质的加厚、保护酶含量的升高、病程相关蛋白的表达等早期的防卫反应以抵御霜霉病菌的侵染,一氧化氮(NO)、过氧化氢(H2O2)、水杨酸(salicylic acid,SA)、茉莉酸(jasmonic acid,JA)、脱落酸(abscisic acid,ABA)和乙烯(ethylene,ETH)等信号物质参与此过程[5-8]。NO和H2O2可协同作用提高苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)和几丁质酶(chitinase)等保护酶的活性,参与番茄对黑色根霉菌的防御反应[9]。据报道,病原菌侵染会引起植物体内源激素含量变化,进而激活植物防御反应基因的表达[10]。外施茉莉酸甲酯(methyl jasmonate,Me-JA)能够有效地控制采后绿熟期番茄果实根霉果腐病症状的发展,同时提高了番茄果实中苯丙氨酸解氨酶、几丁质酶和β-1,3葡聚糖酶的活性[11];利用外源 ABA生物合成抑制剂氟啶草酮(fluridone)和氟草敏(norflurazon)以及ABA缺失突变体等研究发现,增加ABA含量能提高植物对病菌的敏感性[12];葡萄在感染病原菌早期会产生大量乙烯,外施乙烯利(ethephon)增加与致病相关的CH IT4c,PIN,PGIP和GLU等蛋白基因表达和提高了葡萄对白粉病的抗性[13]。但目前有关葡萄受到霜霉病菌侵染后ABA、H2O2、NO和JA等内源信号物质变化的研究鲜有报道。
NO、H2O2、ABA、JA 和乙烯参与多种植物的不同防御反应,那么它们是否与葡萄抵抗霜霉病有关?在霜霉病菌侵染葡萄叶片的过程中其变化怎样?本研究通过检测抗性不同葡萄品种叶片在受到霜霉病菌侵染后NO、H2O2和ABA等内源信号物质的变化,力图寻找与抗病相关的信号物质,为进一步探明霜霉病的抗病机制、选育抗性酿酒葡萄栽培品种和病害防治提供理论基础。
1 材料与方法
1.1 供试菌株
葡萄霜霉病菌采自青岛农业大学生命科学学院葡萄实验基地‘霞多丽’发病叶片。
1.2 供试品种
3个主栽酿酒葡萄品种:‘赤霞珠’(‘Cabernet Sauvignon’)、‘西拉’(‘Syrah’)和‘霞多丽’(‘Chardonnay’)。
1.3 病情调查及病情指数计算
病情分级标准[4]:0级,全叶无病斑;1级,病斑占叶片总面积≤5%;2级,5%<病斑占叶片总面积≤25%;3级,25%<病斑占叶片总面积≤50%;4级,50%<病斑占叶片总面积≤75%;5级,病斑占叶片总面积75%以上,或叶片枯死。
病情指数=[∑(受害级别×该级叶片数)/总叶数×最重发病级别代表数]×100。
1.4 田间霜霉病病情调查
分别于2008年8月下旬至9月底,对烟台蓬莱中粮君顶酒庄3个葡萄品种进行了霜霉病的田间调查,统计病叶率和按照上述分级标准计算病情指数。每株任意选取一个新梢,调查整个新梢叶片的感病性,每个小区每个品种调查100个叶片左右,调查7个小区。
1.5 孢子囊接种浓度的选择
1.5.1 病原菌的采集与繁殖
从田间‘霞多丽’葡萄品种上采回霜霉病叶片,清水冲去旧孢子囊,于20℃和相对湿度100%下培养24 h,待新孢子囊长出后,用毛刷刷下孢子囊,无菌水配制成 2×104、4×104、8×104个/mL和 16×104个/mL孢子囊悬浮液。接种前用载玻片萌芽法测定孢子囊生活力,萌芽率85%以上为有效。
1.5.2 霜霉病菌的接种
采取健康无病的盆栽葡萄植株一年生枝条3~6叶位叶片,用0.1%升汞消毒2 min,无菌水冲洗数次后,用打孔器制成直径1 cm的叶碟,每个品种100片左右,平均分成3份,每个品种各取1份作为一个处理,3次重复,叶背向上平放在湿度为100%的培养基上,用微量移液器进行接种,每个叶片接种30 μ L。将培养皿置20℃培养箱中,7 d后统计发病情况,计算病情指数。
1.6 室内离体叶片接种鉴定
每个品种取3~6叶位叶片100片左右,以8×104孢子囊/mL的菌液对3个品种的离体叶片进行喷雾接种,置于湿度100%、温度20℃的培养箱中培养,3次重复,7 d后统计发病情况并计算病情指数。
1.7 葡萄叶片内源信号物质含量测定
1.7.1 处理
以孢子囊浓度8×104个/mL的菌液对3个不同葡萄品种盆栽的3~6叶位健康叶片背面进行喷雾接种,套袋保湿24 h,按上述分级标准采集3个葡萄品种感染霜霉菌的各级叶片。每个病级采集20个叶片,液氮迅速冷冻后,将叶片敲碎混匀用于试验。
1.7.2 NO含量的测定
用NO试剂盒测定(南京建成生物工程研究所)。取0.1 g处理过的叶片加0.9 mL 0.9%NaCl,匀浆;离心,取上清,沸水浴 5 min;12 000 g离心5 min,取上清,稀释 10倍,在 550 nm 波长下,测定吸光度值,计算出组织中的NO水平。对照和处理都是3次重复的平均值和标准误差。
1.7.3 H2O2含量的测定
参照郝再彬等[14]的方法,取叶片,加预冷丙酮研磨成浆;离心,取上清,依次加入硫酸钛和浓氨水;5 000 r/min离心10 min后弃上清,洗涤5次,用硫酸溶解沉淀,在415 nm波长下,测定吸光度值。对照和处理都是3次重复的平均值和标准误差。
1.7.4 ABA和JA含量的测定
取0.3 g接种处理过的叶片,加1.5 mL 80%甲醇,匀浆;ELISA法测定ABA和JA含量[15],试剂盒购自中国农业大学化控研究室。
1.7.5 乙烯释放量的测定
每个病级都选取叶位和质量相同的2个葡萄叶片,放于100 mL三角瓶中,用3层封口膜将瓶口封好,在20℃下,放置4 h。由瓶内取气1 mL注入GC-2010气相色谱仪测定乙烯含量。气相色谱仪载气为高纯氮气,流速38.7 mL/min,载气温度为150℃;氢火焰离子检测器 FID,检测室温度为200℃,气谱柱为GDX-502填充柱,内径0.53 mm,薄膜厚度1.00 μ m,柱长10 m,柱温80 ℃。乙烯释放量速率以每克鲜重每小时生成的nmol数表示,每个样品重复3次。
1.8 数据统计方法
测定结果用DPS数据处理系统作方差分析。
2 结果与分析
2.1 3个葡萄品种感染霜霉病菌的田间调查
由表1可以看出,3个供试葡萄品种在田间自然状态下均感霜霉病,病情指数范围为 19.50~36.71。但对霜霉病的抗性表现出明显的差异,‘西拉’发病率最低为45.28%,病情指数最小为19.50,对霜霉病抗性最强;‘赤霞珠’抗性最弱,发病率最高,病情指数最大。

表1 田间3个葡萄品种霜霉病自然发病情况1)
2.2 霜霉病菌孢子囊接种浓度的选择
用不同浓度的霜霉病菌孢子囊菌液侵染葡萄离体叶圆片,8×104孢子囊/mL和16×104孢子囊/mL接种霜霉病菌所引起的病情指数最高,达到了极显著水平,能在短时间内区分不同品种对霜霉病的抗性差异(表2)。但16×104孢子囊/mL浓度接种霜霉菌部分葡萄叶片第3天病情指数达到5级,侵染过快不利于信号物质的分析和测定。据此认为8×104孢子囊/mL最佳,并在以下的试验中以此浓度作为合适的处理浓度。
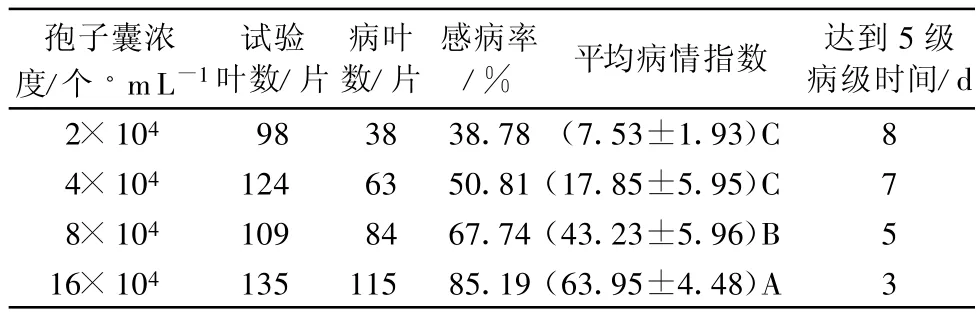
表2 葡萄离体叶圆片对霜霉菌孢子囊接种浓度的敏感性1)
2.3 3个葡萄品种离体叶片接种抗性表现
室内离体叶片接种试验发现3个品种均感霜霉病(表3),但品种间对霜霉病的抗性表现出了显著的差异,病情指数范围为24.36~61.29。其中,‘西拉’对霜霉病抗性最好,病情指数最低;‘赤霞珠’最感病,病情指数最高。表明3个葡萄品种室内离体叶片接种霜霉菌的抗性表现与霜霉病的自然发病情况基本一致,本方法较为可靠。
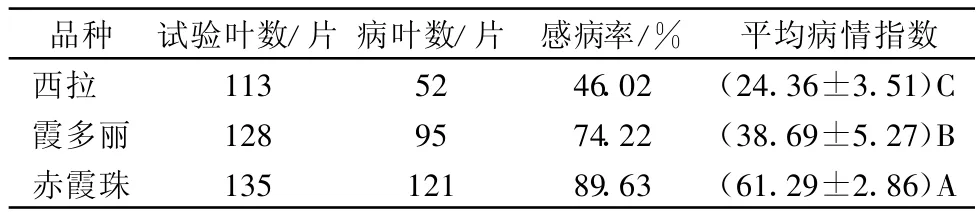
表3 3个葡萄品种离体叶片对霜霉病菌的抗性表现1)
2.4 不同感病期葡萄叶片内源NO和H2O2含量变化
由图1得知,3个葡萄品种叶片接种前(0级)内源NO水平基本一致,病级为1级时,3个品种叶片NO含量增加,且都达到了极显著水平;其中‘西拉’变化最大,增加48.80%。接种前‘西拉’叶片内源H2O2含量最高,接种后叶片内源H2O2含量变化幅度最大,病级为1级时 H2O2含量增加37.73%,达到了极显著水平;‘赤霞珠’和‘霞多丽’含量增加较大,达到了显著水平。

图1 3个葡萄品种不同病级叶片内源NO和H2O2含量变化
2.5 不同感病期葡萄叶片内源JA和ABA含量变化
接种霜霉病菌前‘赤霞珠’JA和ABA含量较高,‘西拉’含量较低;接种后,3个葡萄品种叶片内源JA和ABA含量都有所增加,且存在品种间差异(图2)。‘赤霞珠’病级达到2级时,JA含量达到最大值,变化最明显,增加157.08%,达到了极显著水平;‘霞多丽’和‘西拉’在3级时叶片内源JA含量都达到最大值,‘霞多丽’变化(117.01%)大于‘西拉’(71.50%)。3个品种叶片内源ABA含量均在3级时达到最大值,‘赤霞珠’变化较明显,增加 95.27%,达到了极显著水平;‘霞多丽’和‘西拉’变化较小,差异不显著。
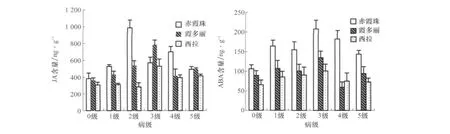
图2 3个葡萄品种不同病级叶片JA和ABA含量变化
2.6 不同感病期葡萄叶片乙烯释放量的变化
由图5可以看出,‘西拉’健康叶片乙烯水平最高,‘赤霞珠’最低;在感病初期不同抗性葡萄叶片乙烯释放量几乎没有变化,5级时都达到了最大值(图3),但品种间差异不显著。
3 讨论
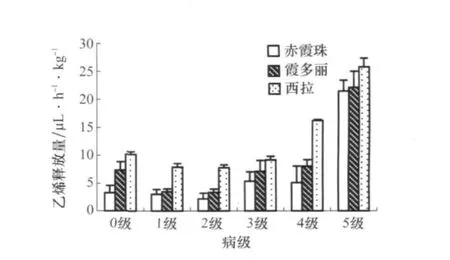
图3 3个葡萄品种不同病级叶片ETH释放量变化
目前我国主栽酿酒葡萄品种多为欧亚种葡萄(Vitis vini f era),对霜霉病抗性较弱。特别是在高湿度的沿海地区,霜霉病严重地影响着葡萄的生长和果实的产量及品质,造成严重的经济损失。本试验对胶东葡萄主栽地区蓬莱的‘西拉’、‘霞多丽’和‘赤霞珠’3个主要酿酒葡萄品种进行了田间自然发病率调查,结果表明‘西拉’抗病性最强,‘赤霞珠’抗病性最弱,室内离体叶片接种试验表明,接种以8×104孢子囊/mL最佳,可在短时间内区分不同品种之间对霜霉菌的抗性差异,且感病情况与田间调查趋势基本一致,这与沙月霞等[4]的研究结果相似。
NO和H2O2含量变化是植物对许多生物或者非生物胁迫的一种普遍的早期反应,在植物的正常生长发育和对环境应答等过程中起着十分重要的作用。最近,Manjunatha等以珍珠粟(pearl millet)为材料,证明NO通过参与和调控过敏反应、胼胝质形成和病程相关蛋白表达等早期防卫反应来增强对霜霉病菌的抗性[16]。Mał olepsza和 Rózalska研究发现番茄叶片感染灰葡萄孢(Botrytis cinerea)后,NO和ROS含量迅速升高,NO和H2O2达到有效的平衡才能增强番茄对灰霉病的抗性[17]。本研究发现葡萄叶片接种霜霉病菌后NO和H2O2含量都有所升高,病级为1级时,3个葡萄品种叶片内源NO和H2O2含量都达到峰值,且这种变化在抗性品种西拉中更为强烈,说明NO和H2O2在葡萄抗霜霉菌的抗性反应中起重要作用,可能均是葡萄应答霜霉病菌侵染过程的信号物质。但在葡萄霜霉病达到5级时,H2O2含量再次增加。推测霜霉病造成叶片干枯或死亡时,大量积累的H2O2对葡萄造成氧化胁迫。
ABA[18]、JAs[19]和乙烯[13]均可作为一种胁迫信号物质,诱导防卫反应以抵御病原菌和环境胁迫。研究发现,黄瓜经褐斑菌诱导后叶片中JA大量积累,最高可达5 000ng/g鲜重[20]。葡萄不同节位叶片中ABA含量不同,26~30节位处最高,达到420 ng/g鲜重[21]。本研究亦发现葡萄叶片内源JA含量高于ABA,接种霜霉病菌后‘赤霞珠’叶片中JA和ABA水平明显升高,JA变化较早且更为显著。推测,JA和ABA可能是参与‘赤霞珠’与霜霉病菌互作过程中的重要信号物质。葡萄叶片感病过程中乙烯几乎没有变化,病级达到5级时才发生变化,且品种间没有显著差异。推测乙烯不是参与葡萄对霜霉病应答的信号分子,乙烯量升高是叶片的衰老和枯死所致。
在植物响应外界各种刺激的过程中,多种信号物质之间的互作和应答(cross-talk),构成复杂的网络系统,共同激活下游的一系列抗性相关反应。徐茂军等的研究表明,JA是作用于NO下游的信号物质[22]。NO和H2O2协同或单独作用诱导棉花细胞对大丽轮枝菌毒素的抗性反应[23]。近期研究发现,蝴蝶兰(Phalaenopsis aphroditaRchb.F.)衰老过程中叶片和萼片NO和H2O2含量迅速增加,利用NO供体和NO清除剂证明NO位于H2O2上游[24]。那么在葡萄和霜霉病互作过程中NO、H2O2、ABA和JA等信号物质在信号转导链中的相互关系怎样?这些信号分子在调控霜霉菌抗性反应中的具体作用机制如何尚有待进一步深入研究。
[1]李亚娟,俞立民.葡萄品种对霜霉病的抗性及叶片溢泌物对游动孢子囊萌发的影响[J].农业科学研究,2008,29(1):25-27.
[2]Slaug hter A R,Hamiduzzaman M M,Gindro K,et al.Betaaminobutyric acid-induced resistance in grapevine against downy mildew:involvement of pterostilbene[J].Eur J Plant Pathol,2008,122(1):185-195.
[3]Trouvelot S,Varnier A L,Allègre M,et al.A beta-1,3 glucan sulfate induces resistance in grapevine againstPlasmopara viticolathrough priming of defense responses,including HR-like cell death[J].Mol Plant Microbe Interact,2008,21(2):232-243.
[4]沙月霞,王国珍,樊仲庆.不同酿酒葡萄品种对霜霉病的抗性分类[J].西北农业学报,2006,15(5):114-117.
[5]Kim Y C,Kim S Y,Choi D,et al.Molecular characterization of a pepper C2 domain-containing SRC2 protein implicated in resistance against host and non-host pathogens and abiotic stresses[J].Planta,2008,227(5):1169-1179.
[6]Mur L A,Carver T L,Prats E.NO way to live;the various roles of nitric oxide in plant-pathogen interactions[J].J Exp Bot,2006,57(3):489-505.
[7]Torres M A,Jones J D,Dangl J L.Reactive oxygen species signaling in response to pathogens[J].Plant Phy siol,2006,141(2):373-378.
[8]Wawrzynska A,Christiansen K M,Lan Y,et al.Powdery mildew resistance conferred by loss of the enhanced disease resistance1 protein kinase is suppressed by a missense mutation in keep on going,a regulator of abscisic acid signaling[J].Plant Physiol,2008,148(3):1510-1522.
[9]Fan B,Shen L,Liu K L,et al.Interaction between nitric oxide and hydrogen peroxide in postharvest tomato resistance response toRhizopus nigricans[J].J Sci Food Agri,2008,88:1238-1244.
[10]Sultana F,Hossain M M,Kubota M,et al.Induction of systemic resistance inArabidopsis thalianain response to a culture filtrate from a plant growth-promoting fungus,Phomasp.GS8-3[J].Plant Biol,2009,11(1):97-104.
[11]石慧,励映聪,罗云波,等.外源茉莉酸甲酯处理对采后绿熟番茄果实根霉果腐病抗病性的影响[J].食品科技,2008(5):255-258.
[12]Flors V,Ton J,Jakab G,et al.Abscisic acid and callose:team players in defense against pathogens[J].J Phytopathol,2005,153:7-8.
[13]Belhadj A,Telef N,Cluzet S,et al.Ethephon elicits protection againstEry siphe necatorin grapevine[J].J Agric Food Chem,2008,56(14):5781-5787.
[14]郝再彬,苍晶,徐仲.植物生理实验技术[M].哈尔滨:哈尔滨工业大学出版社,2002:198-199.
[15]陈康,李杰,唐静,等.一氧化氮参与调节盐胁迫下玉米幼苗脱落酸的积累[J].植物生理与分子生物学学报,2006,32(5):577-582.
[16]M anjunatha G,Niranjan-Raj S,Prashanth G N,et al.Nitric oxide is involved in chitosan-induced systemic resistance in pearl millet against downy mildew disease[J].Pest Manag Sci,2009,65(7):737-743.
[17]Mał olepsza U,Rózalska S.Nitric oxide and hydrogen peroxide in tomato resistance.Nitric oxide modulates hydrogen peroxide level in ο-hydroxyethylorutin-induced resistance toBotrytis cinereain tomato[J].Plant Physiol Biochem,2005,43(6):623-635.
[18]周金鑫,胡新文,张海文,等.ABA在生物胁迫应答中的调控作用[J].农业生物技术学报,2008,16(1):169-174.
[19]Balbi V,Devoto A.Jasmonate signalling network inArabidopsis thaliana:crucial regulatory nodes and new physiological scenarios[J].New Phytol,2008,177:301-318.
[20]石延霞,于洋,傅俊范,等.病原菌诱导后黄瓜叶片中脂氧合酶活性与茉莉酸积累的关系[J].植物保护学报,2008,35(6):486-490.
[21]吴雅琴,常瑞丰,李春敏,等.葡萄实生树开花节位与内源激素变化的关系[J].园艺学报,2006,33(6):1313-1316.
[22]徐茂军,董菊芳,朱睦元.NO通过水杨酸(SA)或者茉莉酸(JA)信号途径介导真菌诱导子对粉葛悬浮细胞中葛根素生物合成的促进作用[J].中国科学,2006,36(1):66-75.
[23]贾芝琪,袁海永,李颖章.大丽轮枝菌毒素对棉花悬浮细胞NO和H2O2的产生和GST基因表达的影响[J].科学通报,2007,52(8):911-917.
[24]Tewari R K,Kumar P,Kim S,et al.Nitric oxide retards xanthine oxidase-mediated superoxide anion generationinPhalaenopsisflower:an implication of NO in the senescence and oxidative stress regulation[J].Plant Cell Rep,2009,28(2):267-279.
Variation of signal substances in grape cultivars in response to Plasmopara viticola
Lin Zhiqiang, Li Xidong, Hou Lixia, Zhang Yinghao, Liu Xin
(College of Life Science,Qingdao Agricultural University,Qingdao266109,China)
Several disease-resistant signal substances,such as abscisic acid(ABA),hydrogen peroxide(H2O2),nitric oxide(NO),jasmonic acid(JA)and ethylene(ETH),in the leaves of 3 grape cultivars,‘Syrah’,‘Chardonnay’and ‘Cabernet Sauvignon’,with different resistance toPlasmopara viticola,were studied in order to detect the signal transduction mechanisms.The results showed that H2O2and NO were involved in the disease response,and‘Syrah’showed strong resistance;JA and ABA were involved in the disease response of the susceptible variety‘Cabernet Sauvignon’.Moreover,the level of ETH had no significant difference among the 3 cultivars used.It was presumed that H2O2,NO,JA and ABA were involved in resistance against the downy mildew disease,but there were significantly different reactions among the three cultivars employed.
grape; downy mildew; signal substances; resistance
S 436.631.1
A
10.3969/j.issn.0529-1542.2010.02.010
2009-04-08
2009-05-26
农业部“948”项目(2006-G26)
*通信作者Tel:0532-88030224;E-mail:liuxin6080@yahoo.com.cn

