通关藤中甾体化合物的电喷雾质谱裂解规律研究
廖 辉,单晓庆,王 林,王 博,伏劲松,王晓玲
(西南民族大学少数民族药物研究所,四川成都 610041)
通关藤中甾体化合物的电喷雾质谱裂解规律研究
廖 辉,单晓庆,王 林,王 博,伏劲松,王晓玲
(西南民族大学少数民族药物研究所,四川成都 610041)
利用电喷雾串联质谱(ESI-MSn)研究从云南产通关藤(Marsdenia tenacissima(Roxb.)Wight et Arn)中分离纯化得到的19种甾体化合物的裂解规律,分析了它们从分子离子出发的多级质谱的裂解碎片,主要报道了tenacigenoside B,tenacigenoside G,tenacigenoside H在 ESI正离子模式下[M+Na]+的裂解途径和碎片离子峰,结合其他16种化合物的裂解实验,说明这些甾体化合物主要丢失C—11和C—12位上的取代基,其次是糖苷上糖顺序断裂。这有助于依据此类化合物结构特点和裂解规律来推断其结构,为此类化合物的快速鉴定提供依据。
通关藤;甾体化合物;裂解电喷雾串联质谱(ESI-MSn)
通关藤(Marsdenia tenacissima(Roxb.) Wight et Arn.)系萝藦科(Asclepiadaceae)牛奶菜属(Marsdenia R.Br.)植物,又名通光藤、通光散、乌骨藤等[1],主产于云南,始载于《滇南本草》,兰茂谓:“奶浆藤又名通光藤,茎心有白奶浆流出,味苦、涩,性寒。主治通乳、利尿、清火”。药用藤、叶,全年可采,以条粗、味苦回甜者为佳。现代药理研究表明,通关藤除了具有平喘、免疫调节、戒毒等作用,还具有良好的抗癌活性。临床上应用的消癌平片和消癌平注射液均为通关藤水提取物制成的抗癌制剂[1]。化学成分研究表明,该植物主要含有抗癌活性的C21孕甾醇及其苷类[2-16]。陈娟娟等[17]对该植物中部分 C21甾体化合物的质谱分析进行了研究。电喷雾质谱提供一种相对简单的方式,使非挥发性溶液相的离子转入到气相而被检测出。本研究采用多级串联质谱(ESI-MS/MS)对该植物中19种C21甾体化合物进行分析,其特征的裂解途径为此类化合物的快速鉴定提供依据。
1 实验部分
1.1 仪器与装置
LCQ Advantage质谱仪:美国 Finnigan公司产品,配有电喷雾电离源(ESI),注射泵自动进样,EDWARDS E2M30泵,LCQ Xcarlibur 2.0软件处理系统;TGL-16台式高速离心机:湖南星科科学仪器有限公司产品;Millipak纯水过滤器:0.22μm,美国Millipore公司产品;AL104电子天平:最大称量110 g,实际分度值0.000 1 g,瑞士Meeler toledo公司产品。
1.2 材料与试剂
通关藤购于云南,经成都生物所赵佐成研究员鉴定为萝藦科牛奶菜属植物通关藤(Marsdenia tenacissima(Roxb.)Wight et Arn.)。将通关藤茎用水提取,乙酸乙酯萃取,萃取物分离纯化得到通关藤苷(Tenacigenoside B、C、D、E、G、H、I、J),Marsdenoside(D、H),Tenacissoside (A、B、C、G),通关藤苷元(Tenacigenin B、11α-O-tigloyl-12β-O-acetyltenacigenin B、11α,12β-Di-O-tigloyl-tenacigenin B、11α-О-2-methylbutyryl-12β-O-acetyltenacigenin B),3-O-6-deoxy-3-O-methyl-β-D-allopyranosyl-(1→4)-β-D-oleandropyranosyltenacigenin C。甲醇:分析纯,购于成都方舟试剂公司;实验用水为超纯水。
1.3 实验条件
电喷雾(ESI)离子源;正离子模式扫描;质量扫描范围 m/z50~2 000;喷雾电压5.0 kV;离子源温度 200℃;毛细管电压 10 V;鞘气(N2):21个单位;溶剂为过滤后的甲醇(分析纯);样品浓度0.5 mL·mol-1。
1.4 样品制备
云南产通关藤茎的水提取物,用乙酸乙酯和正丁醇相萃取,正、反相硅胶柱层析方法分离提纯,经理化常数测定,结合 MS、IR、1H-NMR、13C-NMR、2D-NMR、HMBC以及NOESY等现代波谱学技术,鉴定出19种C21甾体化合物,样品溶液浓度配制为0.5 g·L-1。
2 结果与讨论
19种化合物的结构示于表1和图1。

表1 19种化合物的结构Table 1 Structures of 19 compounds
TenacigenosideG的相对分子质量为1 116,一级质谱全扫描离子[M+Na]+m/z 1 139。它的二级质谱特征丢失产生离子[M+ Na-60](m/z1 079),对应的是12位上基团CH3COO—(60 u)的丢失,另外产生碎片离子m/z1 039和 m/z979。m/z979是前体离子m/z1 079的主要碎片离子(丢失100 u),相应于11位上的 Tig(CH3CH=CCH2CO—)丢失。来自于前体离子 m/z979的碎片离子 m/z817是糖链上末端的葡萄糖(Glc)断裂所致,接着失去第2个葡萄糖(Glc)产生碎片 m/z655。Tenacigenoside G的一级质谱和多级质谱数据示于图2。
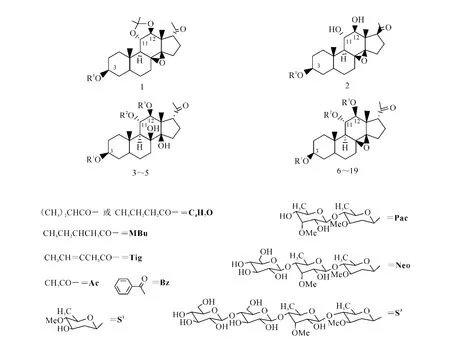
图1 19种化合物的结构图Fig.1 Structures of 19 compounds

图2 Tenacigenoside G的多级质谱数据Fig.2 MS and MSnspectra data of Tenacigenoside G
对 Tenacigenoside B做一级和多级质谱,它的相对分子质量为634,分子离子峰[M+Na]+m/z657。二级质谱也具有特征丢失[M+Na—60]+,即12位上基团CH3COO—丢失产生碎片峰m/z597。碎片离子m/z495是前体离子m/z 597丢失 11位上的 MBu(CH3CH2CHCH3CO—)基团。碎片离子 m/z555是分子离子[M+Na]+m/z657在二级质谱中丢失11位上的MBu(CH3CH2CHCH3CO—)基团所得,裂解数据示于图3。
对化合物 Tenacigenoside H、Tenacigenoside D做了同样的实验研究,结果发现 Tenacigenoside H的裂解与前2个化合物有同样的裂解规律:12位上基团CH3COO—丢失,然后是11位MBu基团和糖链的裂解。裂解途径示于图4,多级裂解图谱示于图5。

图3 Tenacigenoside B的多级质谱数据Fig.3 MS and MSnspectra data of Tenacigenoside B

图4 Tenacigenoside H的主要裂解模式Fig.4 Main fragmentation pathway of Tenacigenoside H

图5 Tenacigenoside H的多级质谱图Fig.5 MS and MSnspectra of Tenacigenoside H
Tenacigenoside D的二级质谱特征丢失发生在11位,产生[M+Na—102]+(丢失102 u) m/z691,对应MBu(CH3CH2CHCH3CO—)基团丢失,m/z531是前体离子 m/z691在12位的丢失,m/z387对应的是前体离子 m/z691丢失糖后的苷元。
Tenacigenoside C、Tenacigenoside E、Tenacigenoside I、Tenacigenoside J、Marsdenoside D、Marsdenoside H、Tenacissoside A、Tenacissoside B、Tenacissoside C、Tenacissoside G、Tenacigenin B、11α-O-tigloyl-12β-O-acetyltenacigenin B、11α,12β-Di-O-tigloyl-tenacigenin B、11α-O-2-methylbutyryl-12β-O-acetyltenacigenin B、3-O-6-deoxy-3-O-methyl-β-D-allopyranosyl-( 1→4)-β-D-oleandropyranosyltenacigenin C的裂解途径与 Tenacigenoside H相似,19种化合物特征裂解列于表2。
3 结 论
在上述19种孕甾醇类化合物中,苷类化合物的多级质谱裂解主要发生在甾体母核的11和12位,随后是3位糖基取代基的常规顺序裂解。而化合物3-O-6-deoxy-3-O-methyl-β-D-allopyranosyl-(1→4)-β-D-oleandropyranosyltenacigenin C的11和12位为羟基取代,裂解首先发生在3位取代基上。因此可以通过失去碎片的先后和大小等质谱信息来快速鉴定此类化合物的特征结构。

表2 19种化合物的特征裂解Table 2 MS2spectra data of the compounds
[1]云南省卫生局.云南省药品标准[S].昆明:云南大学出版社,1996:400.
[2]AENKATA R E,NAGESWARA R E,SANTHARAM S S.Studies onMarsdenia tenacissima (White Nisoth)[J].Indian J Pharm,1976,38: 54-56.
[3]SINGHAL S,MITTAL M,KHARE M P,et al. Chemical constituents ofMarsdenia tenacissim: structure of a new genin drevogenin-Q[J].Indian J Chem,1980:178-182.
[4]SHINGHAL S,KHARE M P,KHARE A.Cissogenin,a pregnane genin fromMarsdenia tenacissima[J].Phytochemistry,1980,19:2 427-2 430.
[5]罗思齐,徐光漪,易大年,等.通光藤中一个新C21甾族化合物的化学结构测定[J],化学学报,1982, 40(4):321-324.
[6]杨仁洲,杨崇仁,周 俊.通光藤甙元甲、乙和丙的结构[J].云南植物研究,1981,3(3):271-278.
[7]LUO S Q,LIN L Z,GEOFFREY A C,et al. Polyoxypregnanes fromMarsdenia tenacissma[J]. Phytochemistry,1993,34(6):1 040-1 051.
[8]QIU S X,LUO S Q,LIN L Z,et al.Further polyoxypregnanes fromMarsdenia tenacissma[J]. Phytochemistry,1995,41(5):1 385-1 388.
[9]蒋 毅,罗思齐.通光藤中新C21-甾体甙的化学结构研究[J].上海医药工业杂志,1996,27(9): 391-395.
[10]陈纪军,张壮鑫,周 俊.通光藤甙 F,G,H和I的结构[J].云南植物研究,1999,21:369-377.
[11]刑旺兴,陈 斌,宓鹤鸣,等.通光藤中两个新C21甾体苷类成分[J].药学学报,2004,39(4): 272-275.
[12]DENG J,LIAO Z X,CHEN D F.Marsdenosides A-H,polyoxypregane glycosidesfrom Marsdenia tenacissima[J]. Phytochemistry, 2005,66:1 040-1 051.
[13]DENG J,LIAO Z X,CHEN D F.Three New Polyoxypregane glycosides fromMarsdenia tenacissima[J].Helvetica Chimica Acta,2005,88: 2 675-2 682.
[14]WANG S,LAI Y H,TIAN B,et al.Two new C21steroidal glycosides fromMarsdenia tenacissima(Roxb.)Wight et Arn[J].Chem Pharm Bull,2006,54(5):696-698.
[15]LI Q F,WANG X L,YU K B,et al.11α,12β-Acetonyltenacissoside F acetonesolvate:a new polyoxypregnane glycoside from the stems of Marsdenia tenacissima[J].Acta Crystallographica Section E:Structure Reports Online,2006,62 (11):O5 255-O5 256.
[16]LI Q F,WANG X L,DINGL S,et al.Polyoxypreganes from the stems ofMarsdenia tenacissima[J].Chinese Chemical Letters,2007,18: 831-834.
[17]CHEN J J,LI X Y,SUN C R,et al.Identification ofpolyoxypregnane glycosides from the
stems ofMarsdenia tenacissimaby high-performance liquid chromatography/tandem mass pectrometry[J].Talanta,2008,77:152-159.
Fragmentation Pathways of Steroids from the Stems ofMarsdenia tenacissimaby ESI-MS/MS
LIAO Hui,SHAN Xiao-qing,WANG Lin,WANGBo,FU Jin-song,WANG Xiao-ling
(Ethnic Pharmaceutical Institute,Southwest University f or N ationalities,Chengdu610041,China)
Total of 19 steroids fragmentation pathways were investigated by electrospray ionization tandem mass spectrometry(ESI-MSn).Those steroids were isolated from the stems ofMarsdenia tenacissima,which collected from Yun Nan province.And the fragmentation pathways of tenacigenoside G,tenacigenoside B,tenacigenoside H were summarized detailly in positive mode[M+Na]+.Combining with the experiment of other 16 compounds,the data reveals the first loss position is C—11 and C—12,then glycosides of C—3 lose orderly.This helps deduce the structures of those compounds according their structural characteristics and loss fragmentations.It also provides the basis for rapid identification of such compounds.
Marsdenia tenacissima;steroids;electrospray ionization tandem mass spectrometry(ESI-MSn)
O 657.63
A
1004-2997(2010)02-0103-07
2009-05-11;
2009-12-09
廖 辉,女(汉族),四川成都人,硕士研究生,天然药物化学专业。E-mail:liaohui327@163.com
王晓玲,女(汉族),四川资阳人,博士,副教授,从事天然药物化学研究。E-mail:wxl3232@sina.com

