血红蛋白固定在Ti0.865O2纳米片层间的直接电化学和电催化
吴益华(上海第二工业大学城市建设与环境工程学院,上海 201209)
血红蛋白固定在Ti0.865O2纳米片层间的直接电化学和电催化
吴益华
(上海第二工业大学城市建设与环境工程学院,上海 201209)
通过对层状纤铁矿型钛酸锂钾进行剥离,可以制备得到Ti0.865O2纳米片溶胶。将Ti0.865O2纳米片作为载体固定血红蛋白(Hb),制备得到Hb/Ti0.865O2/纳米片修饰的热解石墨(PG)电极。在Ti0.865O2纳米片层间,Hb能实现与电极的直接电子转移。在pH值为5.6的磷酸盐缓冲溶液中,该修饰电极的循环伏安曲线上显示出一对可逆的氧化还原峰,式电位为-230 mV (vs.Ag/AgCl)。该修饰电极对H2O2有良好的电催化响应,线性响应范围为50 μM到2.2 mM,灵敏度为10 uA·mM-1·cm-2。
血红蛋白;双氧水;直接电化学;电催化
0 前言
生物传感器是一种以生物活性物质(如酶、抗体、核酸、细胞等)为敏感基元,通过将其固定在信号转换器上构成生物转化器,把生物化学信号转换为相应的物理化学信号的仪器[1]。生物传感器具有选择性好、灵敏度高、分析速度快、成本低等特点,在生物、医学、环境监测、食品、医药与军事医学领域有着重要的应用价值,已引起世界各国极大的关注[2-5]。遗憾的是,在生物传感器中,蛋白质在电极表面通常易被吸附,可能造成构像变化和丧失活性,从而使得蛋白质在电极表面的电子传递能力受到抑制。因此,要实现这些缺乏长程电子通道蛋白质的直接电子转移,需要采取一些特定的方法来达到如下目的:1)蛋白质的活性中心尽可能地接近电极表面;2)使蛋白质分子适当变形但不失活;3)使电极表面与蛋白质分子充分接触;4)通过修饰电极打开电子通道。一个比较有效的方法就是用适当的材料固定蛋白质于电极上,从而促进蛋白质与电极的直接电子传递[6-8]。
很多材料,如聚合物膜[9]、纳米材料[10-11]、表面活性剂[12-13]、类脂膜[14]等都被用于固定蛋白质以制造生物传感器。纳米结构的氧化钛材料也被广泛用于固定蛋白质制造生物传感器。氧化钛纳米材料具有高比表面积、强吸附能力、良好的生物相容性以及优异的热和化学稳定性等一系列优良特性。许多课题组都报道了利用各种纳米结构氧化钛材料作为主体负载蛋白质制造生物传感器的方法。这些纳米结构包括氧化钛纳米颗粒、氧化钛纳米管、介孔氧化钛、氧化钛钠米片等[15-19]。
我们通过对层状纤铁矿型钛酸锂钾进行剥离,制备得到了Ti0.865O2纳米片溶胶,并且用此Ti0.865O2纳米片固定血红蛋白,实现了血红蛋白有效地直接电子转移,同时考察了血红蛋白修饰电极(记为Hb/ Ti0.865O2/PG)对H2O2的电催化行为。
1 试验方法
1.1 试剂
采用分析纯氧化钛,碳酸锂,碳酸钾,浓盐酸,四正丁基氢氧化铵(TBAOH,40 wt %水溶液)。其余试剂和材料还有血红蛋白(Hb, 分子量68 000,等电点pI为6.8,上海华美生物试剂公司)0.1 mol·L-1,pH值为5.6的磷酸缓冲溶液(PBS用Na2HPO4与NaH2PO4溶液按一定比例配制),去离子试验用水,热解石墨电极,铂丝导线,银浆。
1.2 血红蛋白的固定
将按文献[20]制备得到层状纤铁矿型钛酸锂钾(化学式K0.8Ti1.73Li0.27O4)的粉体质子化,得到固体钛酸(H1.07Ti1.73O4·H2O),其步骤如下:将钛酸锂钾与1.0 M 盐酸以1 g/100 mL的固液比进行质子交换反应,并室温搅拌一天。为了使质子化充分,需要重复上述步骤三次,然后离心、水洗、室温风干。将此固体钛酸分散在四正丁基氢氧化铵水溶液中,搅拌大约7天,得到悬浮液,然后在8 000 r/min下离心分离,得到上层氧化钛(Ti0.865O2)纳米片溶胶[21]。调整pH值致8左右;调整浓度为1 mg/ mL,备用。此纳米片溶胶和3.8 mg/mL的血红蛋白溶液等体积混合,再逐滴加入1.0 M稀醋酸。当体系pH值在5.7左右时,引发沉淀生成。在pH值为5.7左右时,血红蛋白带正电荷,并与带正电荷的Ti0.865O2纳米片通过静电力组装在一起。
1.3 电极的制备
将热解石墨(PG)电极分别用粗砂纸打磨,并用氧化铝粉抛光,然后分别在丙酮和去离子水中超声清洗5分钟,最后用银浆将电极和铂丝导线相连。将固定化酶悬浮液滴涂在电极表面,在空气中干燥,即得实验用血红蛋白修饰电极Hb/ Ti0.865O2/PG。电极不用时,在4 ℃空气中保存。
1.4 测试仪器及方法
在日本理学Rigaku D/Max-rB型X射线衍射仪上进行X射线衍射测试。小角度X射线衍射测试条件为:扫描速度为0.6o/min;扫描步长为0.002o。
在CHI440电化学工作站上进行循环伏安和时间电流测试。 所有的电化学测试都是在室温下(22℃±2℃)的三电极电解池中进行。热解石墨为工作电极,铂丝为对电极,Ag/AgCl为参比电极。在检测双氧水的过程中,向工作电极加-0.4 V(vs. Ag/AgCl)的电压,直至得到稳态电流,然后向池中加入一定量的双氧水,并记录电流随时间的变化。在所有的电化学测试前,都要用高纯氮气向溶液鼓泡30分钟来除氧。所有的测试也都是在氮气保护环境中进行的,以排除氧气的干扰。
2 结果与讨论
2.1 结构分析
图1是试验中合成的层状纤铁矿型钛酸锂钾K0.8Ti1.73Li0.27O4和质子化的H1.07Ti1.73O4·H2O的粉末X射线衍射图。所得结果与以前文献[20,22]报道的晶胞参数相同,并已经对衍射结果进行了指标化。
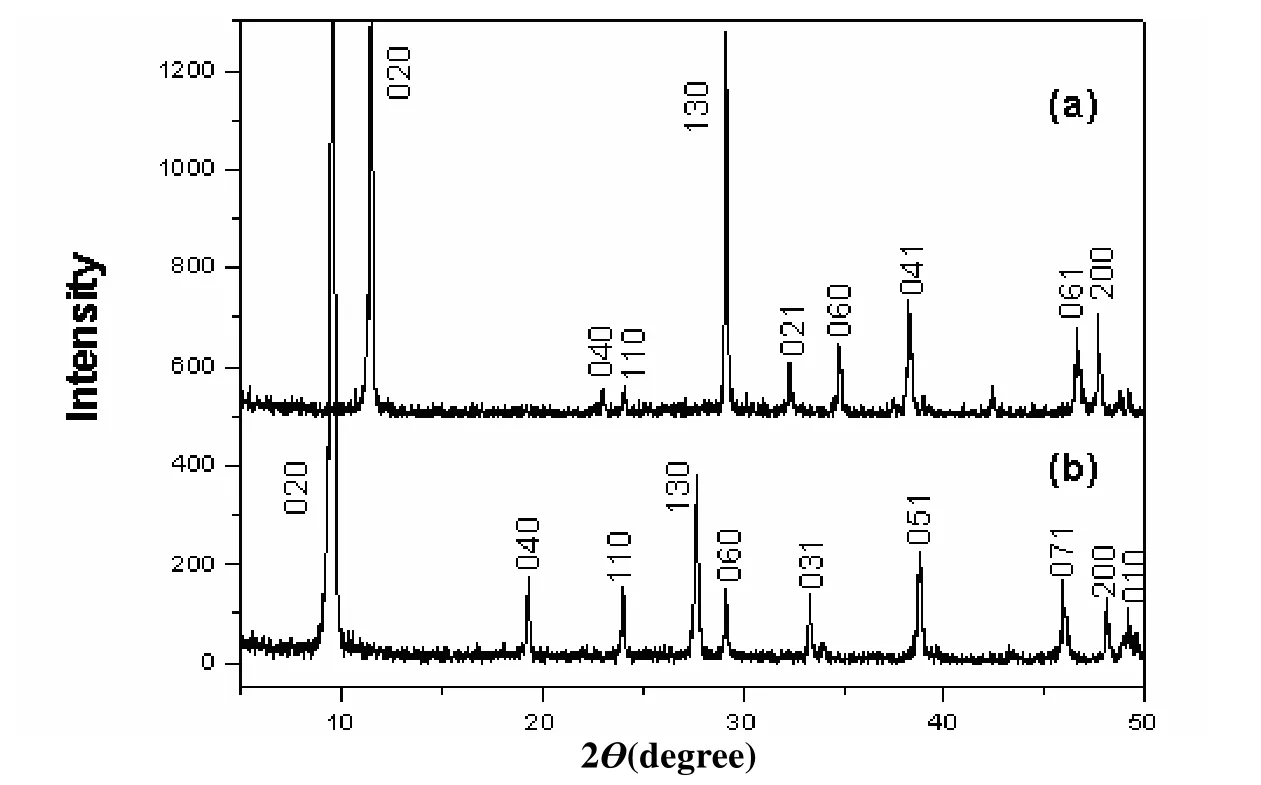
图1 (a) H1.07Ti1.73O4·H2O, (b) K0.8Ti1.73Li0.27O4的粉末X射线衍射图Fig. 1 Powder X-ray diffraction patterns for (a) H1.07Ti1.73O4·H2O, (b) K0.8Ti1.73Li0.27O4
图2 显示的是固定化酶的小角X射线衍射图。低角度出现的比较强的衍射峰,说明了血红蛋白固定在氧化钛无机层的中间。XRD分析表明,对于此种样品,层间距为7.0 nm,减去氧化钛单层厚度0.75 nm,为6.25 nm,略小于蛋白质分子(5.3 nm × 5.4 nm× 6.5 nm)最大轴6.5 nm,因此蛋白质在层间属于单层规则排列。
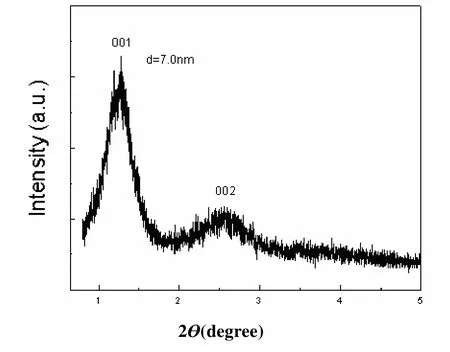
图2 Hb/Ti0.865O2修饰电极的衍射图谱Fig. 2 XRD pattern of Hb/Ti0.865O2modified electrode
2.2 血红蛋白的直接电化学
图3显示的是在浓度为0.1 M,pH值为5.6的磷酸缓冲溶液中Hb/Ti0.865O2热解石墨修饰电极(a)和氧化钛纳米片石墨修饰电极(b)的循环伏安曲线,扫描速度是100 mV· s-1。Hb/Ti0.865O2热解石墨修饰电极有一对形状相似、大小相当的氧化还原峰,分别在-281 mV和-179 mV,说明存在着可逆的电子转移。在扫描电压范围内,氧化钛修饰电极没有电化学响应,是非电活性的,因而可以判断这对氧化还原峰是来源于血红蛋白分子的氧化还原。
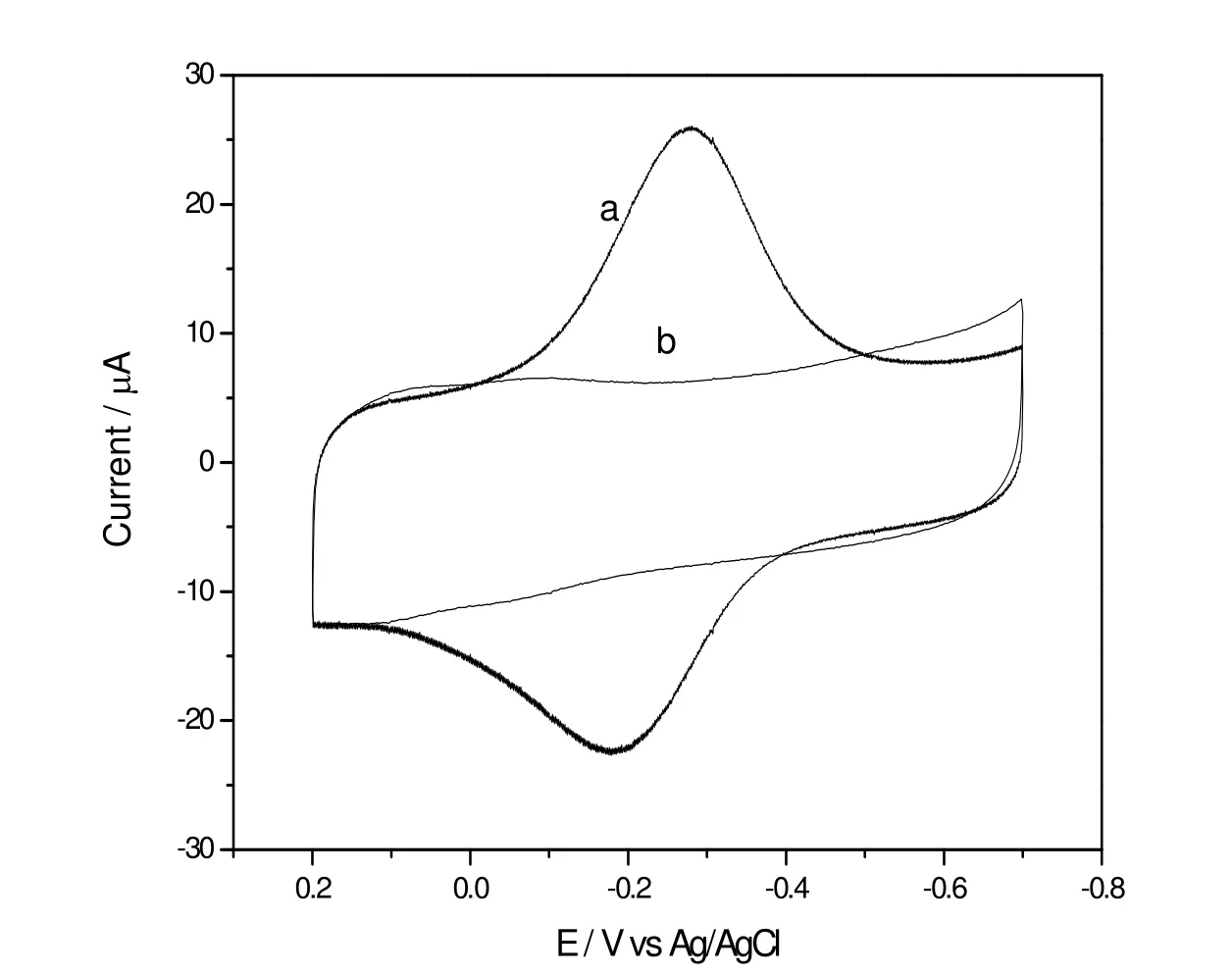
图3在浓度为0.1M, pH为5.6的磷酸缓冲溶液中Hb/Ti0.865O2热解石墨修饰电极a和氧化钛纳米片石墨修饰电极b的循环伏安曲线(扫描速度是100 mV· s-1)Fig. 3 CVs of a titania nanosheets modified electrode, b Hb modified electrode in 0.1M, pH 5.6 PBS at a scan rate of 100 mV· s-1
图4 显示的是在不同扫描速率下,Hb/Ti0.865O2修饰电极的循环伏安曲线。随着扫描速率的增加,峰电流也不断增加,而且呈线形关系,说明这个电极反应是一个表面控制的准可逆过程。
2.3 溶液pH值对电极的影响
固定的血红蛋白的电化学性质和溶液的pH值密切相关。图5显示的是式电位和pH值之间的关系。当pH值在3.3到11之间时,式电位和pH值呈线性关系,斜率是-47mV·pH-1。理论预测含血红素蛋白在发生可逆电子转移时伴随着质子的转移过程,式电位对pH值呈线性关系,在室温时斜率的理论值为-59mV·pH-1。虽然实验值比理论值稍小,但是在误差范围以内。当pH值大于11或者小于3.3时,式电位对pH值明显偏离原来的直线关系,说明蛋白质发生了某种变性,导致了前面的一电子一质子机制的失效。
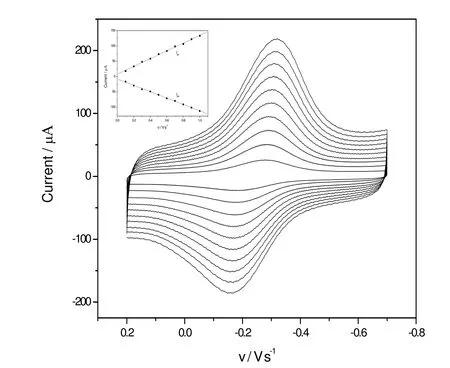
图4 Hb/Ti0.865O2修饰电极在0.1 M, pH值为5.0的乙酸-乙酸钠缓冲溶液中的循环伏安曲线(扫描速度分别为100, 200, 300, 400, 500, 600, 700, 800, 900和1000 mV·s-1;插图表示氧化和还原峰电流对扫描速度的线性关系)Fig. 4 CVs of Hb modified electrode in 0.1M pH 5.6 PBS at a scan rate of 100, 200, 300, 400, 500, 600, 700, 800, 900 and 1000 mV s-1. Inset: Plot of peak current vs. scan rate
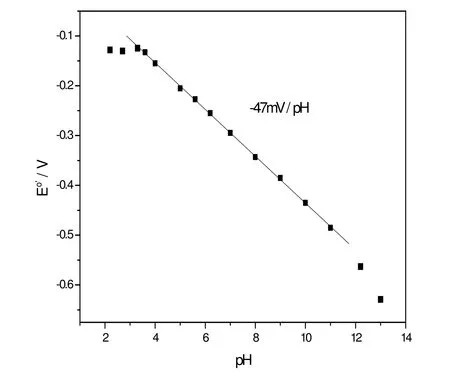
图5 Hb/Ti0.865O2修饰电极式电位对pH值的线性关系Fig. 5 The linear plot of the formal potentials obtained from CV at a scan rate of 200 mV· s-1for the Hb modified electrode vs. pH
2.4 血红蛋白对双氧水的电催化行为
图6描述了恒定电位为-400 mV (vs. Ag/AgCl)时,Hb/Ti0.865O2修饰电极对双氧水浓度变化的时间-电流响应曲线,每次加入双氧水的浓度为50 μM。由图6可见,催化峰电流随H2O2浓度的增大而增大,在一定范围内呈线性关系: ipc= 21.65 + 0.01 c (H2O2),相关系数r = 0. 999。由此可知,修饰电极的检测线性范围为50 μM到2.2 mM,检测限为20 μM,对应的灵敏度为10 uA·mM-1·cm-2。
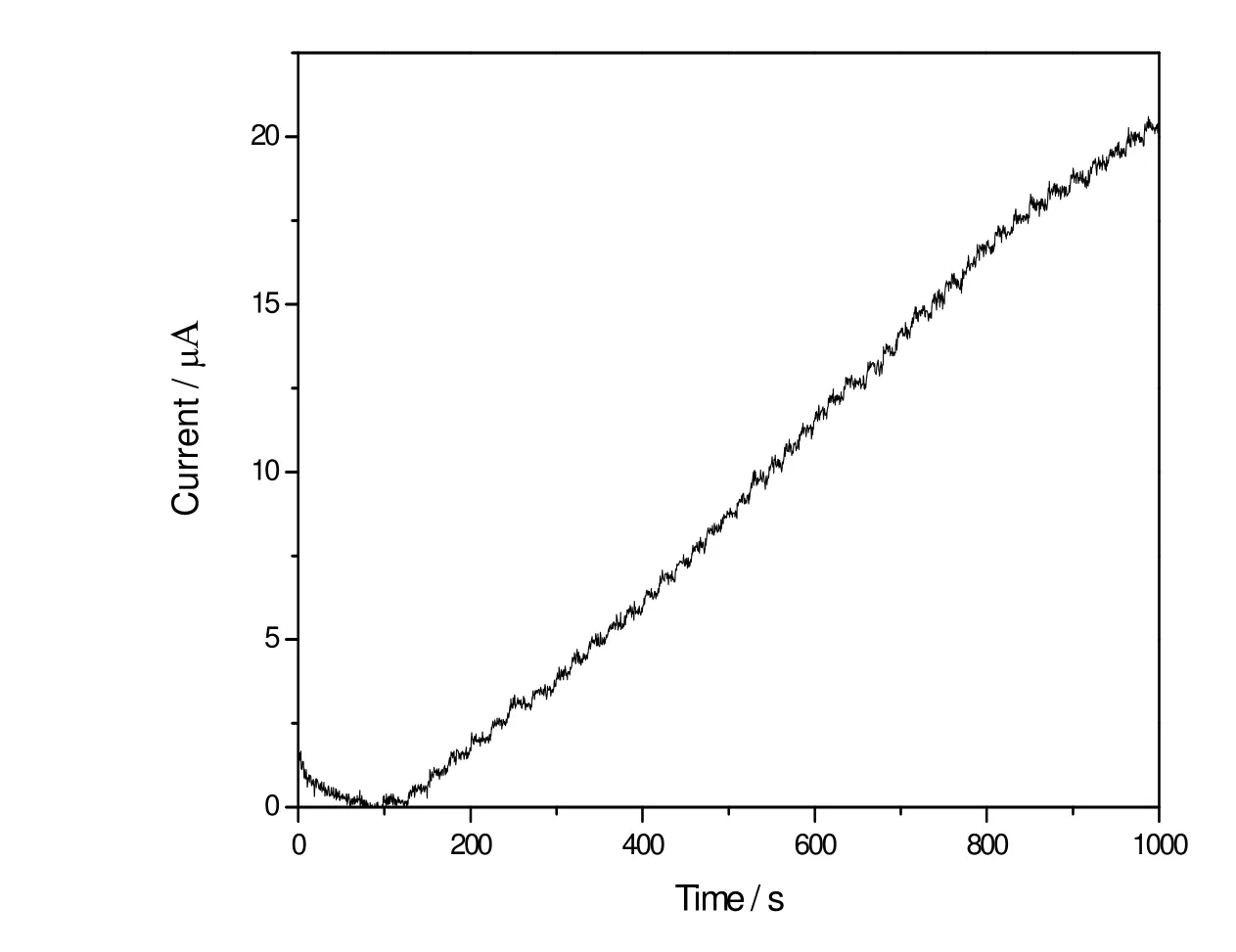
图6 在0.1 M, pH值为5.6的乙酸-乙酸钠缓冲溶液中,-400mV的电压下Hb/Ti0.865O2修饰电极对双氧水的电流响应曲线(每次加入双氧水的浓度为50μM)Fig. 6 Amperometric response of Hb/Ti0.865O2modified electrode at -400 mV upon successive addition of 50 µM H2O2to 0.1M, pH 5.6 PBS buffer solution (pH 5.6)
3 结论
用剥离-重组的方法制备了Hb/Ti0.865O2修饰的热解石墨电极。Hb在此修饰电极上能进行直接电子传递。用循环伏安法研究了Hb的电化学行为。该电极对H2O2表现出良好的电催化性能,催化峰电流在一定范围内与H2O2浓度呈线性关系,可作为生物传感器检测H2O2。
[1]司士辉. 生物传感器:第一版[M].北京: 化学工业出版社, 2003.
[2]WILLNER I, KATZ E. Integration of layered redox proteins and conductive supports for bioelectronic applications [J]. Angew. Chem. Int. Ed., 2000, 39:1180-1218.
[3]KATZ E, HELEG S V, WILLNER B, et al. Electrical contact of redox enzymes with electrodes: novel approaches for amperometric biosensors [J]. Bioelectrochem. Bioenerg., 1997, 42: 95-104.
[4]ARMSTRONG F, HEERING H, HIRST J. Reaction of complex metalloproteins studied by protein-film voltammetry [J]. Chem. Soc. Rev., 1997, 26:169-179.
[5]RUZGAS T, CSOREGI E, EMNEUS J, et al. Peroxidase-modified electrodes: fundamentals and application [J]. Anal. Chim. Acta., 1996, 330: 123-138.
[6]HU N. Direct electrochemistry of redox proteins or enzymes at various film electrodes and their possible applications in monitoring some pollutants [J]. Pure Appl. Chem., 2001, 73:1979-1991.
[7]XU Z, CHEN X, DONG S. Electrochemical biosensors based on advanced bioimmobilization matrices [J]. Trends Anal. Chem., 2006, 25:899-908. [8]GORTON L, LINDGREN A, LARSSON T, et al. Direct electron transfer between heme-containing enzymes and electrodes as basis for third generation biosensors[J]. Anal. Chim. Acta., 1999, 400: 91-108.
[9]ZENG X, WEI W, LI X, et al. Direct electrochemistry and electrocatalysis of hemoglobin entrapped in semi-interpenetrating polymer network hydrogel based on polyacrylamide and chitosan [J]. Bioelectrochemistry, 2007, 71:135-141.
[10]LIANG R, FAN L, WANG R, et al. One-step electrochemically deposited nanocomposite film of CS-Fc/MWNTs/GOD for Glucose biosensorapplication [J]. Electroanalysis, 2009, 21: 1685-1691.
[11]LI Y, LIU X, YUAN H, et al. Glucose biosensor based on the room-temperature phosphorescence of TiO2/SiO2nanocomposite [J]. Biosens. Bioelectron., 2009, 24: 3706-3710.
[12]IMMOOS C, CHOU J, BAYACHOU M, et al. Electrocatalytic reductions of nitrite, nitric oxide, and nitrous oxide by thermophilic Cytochrome P450 CYP119 in film-modified electrodes and an analytical comparison of its catalytic activities with myoglobin [J]. J. Am. Chem. Soc., 2004, 126: 4934-4942.
[13]GUO Z, CHEN J, LIU H, et al. Direct electrochemistry of hemoglobin and myoglobin at didodecyldimethylammonium bromide-modified powder microelectrode and application for electrochemical detection of nitric oxide [J]. Anal. Chim. Acta., 2008, 607: 30-36.
[14]MUNGE B, DAS S, ILAGAN R, et al. Electron transfer reactions of redox cofactors in spinach Photosystem I reaction center protein in lipid films on electrodes [J]. J. Am. Chem. Soc., 2003, 125:12457-12463.
[15]TOPOGLIDIS E, CASS A, GILARDI G, et al. Protein adsorption on nanocrystalline TiO2films: an immobilization strategy for bioanalytical devices [J]. Anal. Chem., 1998, 70: 5111-5113.
[16]ZHOU H, GAN X, LIU T, et al. Electrochemical study of photovoltaic effect of nano titanium dioxide on hemoglobin [J]. Bioeletrochemistry, 2006, 69: 34-40.
[17]LIU A, WEI M, HONMA I, et al. Direct electrochemistry of myoglobin in titanate nanotubes film [J]. Anal. Chem., 2005, 77: 8066-8074.
[18]ZHANG L, ZHANG Q, LI J. Layered titanate nanosheets intercalated with myoglobin for direct electrochemistry [J]. Adv. Funct. Mater., 2007, 17: 1958-1965.
[19]CHEN X, HU J, CHEN Z, et al. Nanoplated bismuth titanate sub-microspheres for protein immobilization and their corresponding direct electrochemistry and electrocatalysis [J]. Biosens. Bioelectron., 2009, 24:3448-3454.
[20]SASAKI T, KOOLO F, IIDA M, et al. A mixed alkali metal titanate with the lepidocrocite-like layered structure. Preparation, crystal structure, protonic form, and acid-base intercalation properties [J]. Chem. Mater., 1998, 10: 4123-4128.
[21]WU Y, GAO Q, GAO L. Immobilization of hemoglobin at the galleries of layered lepidocrocite-related potassium lithium titanate [J]. J. Nanosci. Nanotechnol., 2009, 9:1615-1618.
[22]TANAKA T, EBINA Y, TAKADA K, et al. Oversized titania nanosheet crystallites derived from flux-grown layered titanate single crystals [J]. Chem. Mater., 2003, 15: 3564-3568.
Direct Electrochemistry and Electrocatalysis of Hemoglobin Entrapped in the Galleries of Ti0.865O2Nanosheets
WU Yi-hua
(School of Urban Development and Environmental Engineering, Shanghai Second Polytechnic University, Shanghai, 201209, P.R. China)
Hb/Ti0.865O2nanosheets were prepared by exfoliated from the layered lepidocrocite-related potassium lithium titanate. Hemoglobin (Hb) was entrapp in the galleries of Ti0.865O2nanosheets. The CV (cyclic voltametry) results of the Hb/Ti0.865O2modified pyrolytic graphite electrode showed a pair of well-defined, quasi reversible redox peaks centered at -230 mV (vs. Ag/AgCl) in pH 5.6 phosphate buffer solution. The modified electrode exhibited good electrocatalytic response for monitoring H2O2and have a large linear detection range from 50 µM to 2.2 mM and a sensitivity of 10 µA mM-1cm-2.
hemoglobin; hydrogen peroxide; direct electrochemistry; electrocatalysis
O614.41
A
1001-4543(2010)01-0001-06
2009-09-25;
2009-12-24
吴益华(1981-),男,江苏无锡人,博士,主要研究方向为复合材料,电子邮件:yhwu@eed.sspu.cn。
上海高校选拔培养优秀青年教师科研专项基金(No.egd08011)

