支气管哮喘伴发抑郁大鼠模型的建立
孙宏伟,李承德,毛淑梅,宋玉萍,王艳郁
(1.潍坊医学院心理学教研室,潍坊 261053;2.潍坊医学院药理学教研室,潍坊 261053)
研究报告
支气管哮喘伴发抑郁大鼠模型的建立
孙宏伟1,李承德2,毛淑梅2,宋玉萍1,王艳郁1
(1.潍坊医学院心理学教研室,潍坊 261053;2.潍坊医学院药理学教研室,潍坊 261053)
目的探讨建立支气管哮喘伴发抑郁动物模型的方法。方法选择Wistar大鼠,随机分为对照组与模型组,模型组采用卵蛋白(ovalbumin,OVA)激发法建立哮喘模型,在此基础上给予慢性轻度不可预见性应激(chronic unpredictable mild stress,CUMS)28 d,观察大鼠体质量、体征、肺组织结构、支气管肺泡灌洗液白细胞计数等变化,并用Open-field实验评价大鼠活动度和好奇心,通过糖水消耗实验评价大鼠快感缺乏与否。结果与对照组相比,模型组大鼠体质量增长明显缓慢(P<0.05);肺组织呈哮喘样病理改变;支气管肺泡灌洗液白细胞总数、嗜酸粒细胞及淋巴细胞增多;Open-field实验,大鼠垂直活动得分、水平活动得分显著降低(P<0.05);糖水消耗量明显减少(P<0.05)。结论OVA激发复合CUMS可成功制备支气管哮喘伴发抑郁大鼠模型。
支气管哮喘;抑郁;模型;慢性轻度不可预见性应激;大鼠
支气管哮喘是一种严重的呼吸系统疾病,近年发病率和死亡率持续增加,全世界至少有3亿以上的哮喘病患者。哮喘尚为一种严重的身心疾病,众多患者伴发抑郁情绪,而抑郁在哮喘的发生、发展和预后中发挥着重要的作用,是使哮喘发病率和死亡率升高的一个重要因素[1,2]。鉴于直接进行人体实验的局限性,有关本病发病机制的探索、治疗新方法的评价、新药的研究与开发等深入研究必须通过动物实验进行,但目前支气管哮喘伴发抑郁的动物模型尚属空白,本研究拟通过卵蛋白(ovalbum in,OVA)激发复合慢性轻度不可预见性应激(chronic unpredictable m ild stress,CUMS)建立支气管哮喘伴发抑郁大鼠模型,为该病的深入研究创造条件。
1 材料和方法
1.1 材料
1.1.1 实验动物:选择SPF级雄性W istar大鼠22只,体质量(200±20)g,来源于山东大学实验动物中心[SCXK(鲁)2003-0004]。标准饲料,恒温26℃,通风,环境安静,饲养室及物品消毒等条件下饲养。大鼠适应环境7 d后,随机分为对照组10只、模型组12只,对照组每笼5只,模型组每只单笼孤养。实验过程中对照组因撕咬死亡1只;模型组死亡2只,最后纳入统计的大鼠数量为19只。
1.1.2 药品:OVA购自美国Sigma公司,氢氧化铝购于淄博化学试剂厂。
1.1.3 实验仪器:雾化泵(德国PARI公司),多功能动物实验仪(蚌埠医学院仪器厂),自制游泳箱,自制大鼠敞箱,自制大鼠束缚盒,自制明暗颠倒装置。
1.2 实验方法
1.2.1 模型制备:选择健康雄性W istar大鼠进行open-field实验,剔除水平及垂直活动得分总和低于30分与高于100分者,共纳入22只大鼠,随机分为对照组10只、模型组12只。
(1)对照组:于分组后第1天,每只大鼠腹腔注射生理盐水1 m L,14 d后,每天雾化吸入生理盐水20 m in,流量40 m L/20 min,连续28 d。此后每5 d雾化吸入生理盐水1次,剂量与持续时间同前。
(2)模型组:于分组后第1天,每只大鼠腹腔注射致敏液1 m L(含OVA 100 mg,氢氧化铝200 mg),14 d后,每天雾化吸入1%OVA 20 min,流量40 mL /20 min,连续28 d(此后每5 d雾化吸入OVA 1次,直至实验结束,剂量与持续时间同前)。连续28 d雾化吸入1%OVA后,大鼠继续接受28 d CUMS,包括禁水(48 h),禁食(48 h),夹尾(180 s),束缚(1 h),冷水游泳(4℃,5 min),热环境(45℃),电击足底(电压30 V,电击15 s,间歇5 s,共进行120 s),昼夜节律的重新调整和光照性质的改变(闪光刺激、昼夜颠倒、间断光照),噪音干扰(2 h),居住环境的改变(单笼饲养、鼠笼倾斜、潮湿垫料)等。
1.2.2 模型评价
(1)大鼠体征变化:自实验开始至实验结束,每周测量1次两组大鼠体质量;观察大鼠呼吸、运动、毛发等全身体征变化。
(2)支气管肺泡灌洗液细胞计数及分类:分离左肺,向左支气管注入生理盐水3 m L,然后吸出,重复灌洗5次。将灌洗液2500 r/m in离心,回收细胞进行涂片并瑞氏染色,计数白细胞数量并分类。
(3)HE染色:处死动物后,取两组大鼠右肺组织块置于4%中性甲醛固定,常规石蜡切片,HE染色光镜下观察肺组织变化。
(4)电镜:处死动物后,取两组大鼠右肺组织块各1 mm3置于1%锇酸固定,超薄切片,电镜下观察肺组织变化。
(5)糖水消耗实验:两组大鼠在模型制备前后分别进行该实验1次。先训练动物适应含糖饮水,所有大鼠单笼饲养,每笼同时放置两个水瓶,第1个24 h,两瓶均装有1%蔗糖水,随后的24 h,1瓶装1%蔗糖水,1瓶装纯水。在24 h的禁食禁水后,进行糖水消耗实验:同时给予每只大鼠事先定量好的两瓶水,1瓶1%蔗糖水,1瓶纯水,60 min后,取走两瓶并称重。计算动物的糖水及纯水摄取量。
(6)Open-field实验:自制敞箱,大小为100 cm ×100 cm×80 cm,底面均分为25格,装置由黑色漆料涂满。此实验于模型制备前后分别各进行1次,在8:00~10:00之间在安静的房间内、对所有大鼠平行进行,每只大鼠观察3 min。先将大鼠置于敞箱中心方格内,观察记录大鼠水平运动及及垂直运动得分:以动物穿越方格数为水平活动得分,穿越1格(四爪均进入方格方可记数)为1次,如动物沿线行走,以每10 cm为1次;以后肢直立次数为垂直活动得分:动物两前爪腾空或攀附墙壁,离开底面1 cm为标志,无论动物站立多长时间直至放下双足为1次活动。彻底清洁敞箱后再进行下1只大鼠的观察。
1.3 统计学处理
2 结果
2.1 两组大鼠实验过程中体重变化
模型制备前模型组大鼠体质量与对照组比较差异无显著性(P>0.05);模型制备过程中模型组大鼠体质量增长缓慢,模型制备后,其体质量显著低于对照组(P<0.05),见图1。
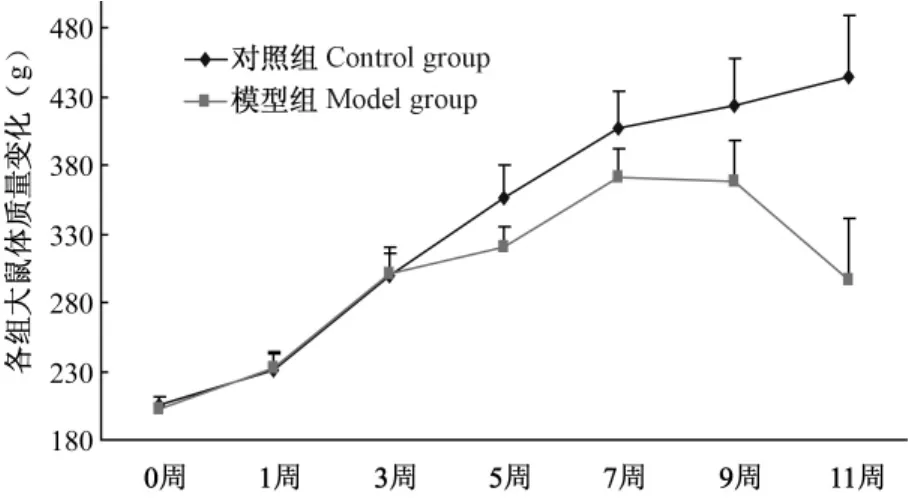
图1 两组大鼠体重变化趋势折线图Fig.1 Changes of body weight curves of the rats
2.2 大鼠体征变化
与对照组大鼠比较,模型组大鼠卵蛋白激发后呼吸加深加快、节律不齐、呈点头呼吸,咳嗽,口周轻度发绀,部分烦躁不安、不停走动,部分安静不动,其毛发无光泽、竖立。接受CUMS后,大鼠活动明显减少。
2.3 肺组织HE染色
对照组大鼠支气管管壁无增厚现象,周围无明显炎症细胞浸润,支气管上皮细胞完整,管腔光滑,无闭塞,肺泡壁清晰完整,间隔形态正常。模型组大鼠支气管管壁内及周围组织可见嗜酸性粒细胞及巨噬细胞,并有大量炎性细胞浸润,上皮细胞水肿、脱落,支气管黏膜皱襞以及平滑肌增生,部分区域可见平滑肌破坏断裂,部分管腔内有分泌物。肺泡壁炎症细胞浸润、增厚,肺泡内见渗出物,部分肺泡呈扩张状态。见图2(彩插11)。
2.4 电镜观察
正常组肺组织未见嗜酸粒细胞浸润,I型肺泡细胞、II型肺泡细胞、正常内皮细胞结构正常。模型组可见嗜酸粒细胞浸润,肺泡周围局部毛细血管断裂,血管内皮细胞线粒体空泡样变,髓样变,嵴断裂,细胞核周隙局部增宽;I型肺泡细胞内高尔基复合体不发达,线粒体髓样变,嵴模糊;II型细胞线粒体空泡样变,颗粒排空现象明显,细胞核周隙局部增宽。见图3。
2.5 支气管肺泡灌洗液细胞计数及分类
模型组大鼠支气管肺泡灌洗液可见多类白细胞,其中白细胞总数、嗜酸粒细胞及淋巴细胞计数均显著高于对照组(P<0.05),见表1。
2.6 糖水消耗实验
模型制备前,模型组大鼠糖水消耗量与对照组比较无显著差异(P>0.05);模型制备后,其糖水消耗量显著低于对照组(P<0.05),见表2。
2.7 Open-field test
模型制备前模型组大鼠水平活动得分及垂直活动得分与对照组比较差异均无显著性(P>0.05);模型制备后,其水平活动得分及垂直活动得分均显著低于对照组(P<0.05),表3。
表1 支气管肺泡灌洗液细胞计数(±s)Tab.1 The white blood cell counts in the BALF(±s)

表1 支气管肺泡灌洗液细胞计数(±s)Tab.1 The white blood cell counts in the BALF(±s)
注:与对照组比较,△P<0.05。Note:compared with the control group,△P<0.05
组别Group n白细胞总数Total white cells×105/L嗜酸粒细胞Eosinophils×105/L淋巴细胞Lymphocytes×105/L对照组Control group 9 40.22±6.95 7.29±0.96 13.34±2.44模型组Model group 10 78.65±8.41△16.88±1.65△20.71±4.53△
表2 应激前后两组大鼠糖水消耗情况变化((±s)Tab.2 The changes of sucrose consumption of the rats before and after CUMS treatment(±s)

表2 应激前后两组大鼠糖水消耗情况变化((±s)Tab.2 The changes of sucrose consumption of the rats before and after CUMS treatment(±s)
注:与对照组比较,△P<0.05。Note:compared with the control group,△P<0.05
组别Group n总液体消耗Total water consumption(m L )糖水消耗Sucrose solution consumption(m L)应激前Before CUMS应激后After CUMS应激前Before CUMS应激后After CUMS对照组Control group 9 22.9±6.4 20.7±5.6 17.2±6.5 16.2±5.9模型组Model group 10 19.4±5.7 18.4±7.5 15.7±4.2 9.7±6.8△
表3 Open-field test两组大鼠活动情况比较(±s)Tab.3 The changes of behavior of the rats in open-field test(±s)

表3 Open-field test两组大鼠活动情况比较(±s)Tab.3 The changes of behavior of the rats in open-field test(±s)
注:与对照组比较,△P<0.05。Note:compared with the control group,△P<0.05
组别Group n 水平活动得分Crossing垂直活动得分Rearing应激前Before CUMS应激后After CUMS应激前Before CUMS应激后After CUMS对照组Control group 9 67.23±12.67 71.54±10.85 21.36±4.76 23.95±3.68模型组Model group 10 70.35±7.82 39.64±17.52△18.54±5.36 10.34±6.40△
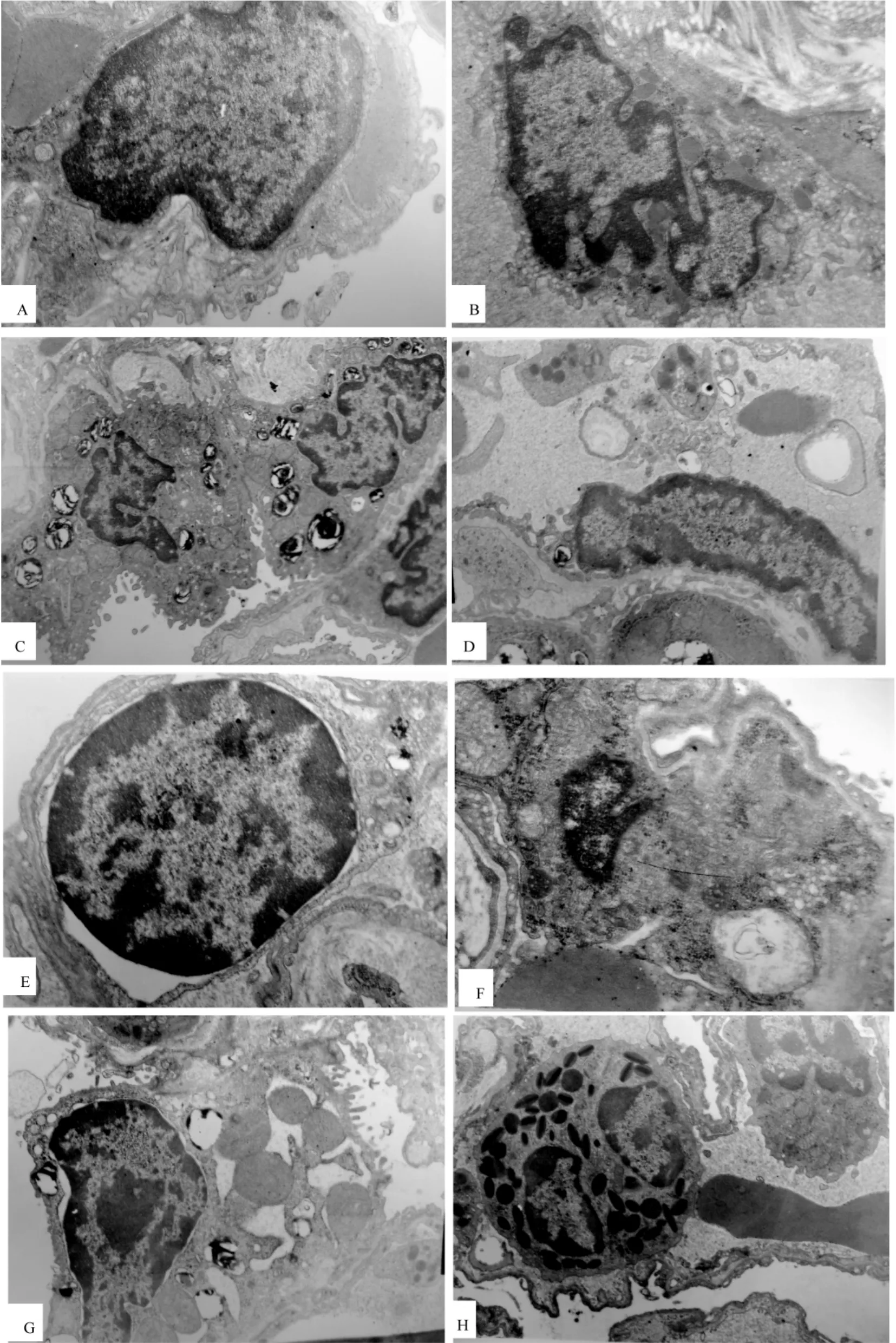
注:A.正常组内皮细胞;B.正常组I型肺泡细胞;C.正常组II型肺泡细胞;D.模型组血管内皮细胞;E.模型组血管内皮细胞;F.模型组I型肺泡细胞;G.模型组II型肺泡细胞;H.模型组嗜酸粒细胞。图3大鼠肺组织超微结构Note:A.An endothelial cell of the control group;B.A normal type I epithelial cell of the control group;C.Normal type II epithelial cells of the control group;D.An endothelial cell of the model group;E.An endothelial cell of the model group;F.A type I epithelial cell of the model group; G.A type II epithelial cell of the model group;H.An eosinophil in the model group.Fig.3 Electron m icroscopic micrographs of the lung tissues
3 讨论
目前采用复合处理,制备在一种疾病基础上伴发抑郁的动物模型已有报道,如洪华等[3]成功制备了脑卒中后抑郁模型,邢东明等[4]成功制备了缺血再灌注卒中后抑郁的动物模型。目前,制备单纯哮喘及单纯抑郁模型的方法均有多种,但制备哮喘伴发抑郁的动物模型的方法尚未见报道,我们拟参考制备单纯哮喘及单纯抑郁动物模型的方法为基础,制备哮喘伴发抑郁动物模型。
目前,建立哮喘模型及抑郁模型的常用动物有大鼠、豚鼠、小鼠、猫、狗等,而W istar大鼠可较好的模拟人类哮喘和抑郁的特征,且价格便宜,故本实验选择W istar大鼠为实验动物。
制备哮喘模型所用方法较多,如Sakai等[5]、Schwarre等[6]、Temelkovski等[7]以不同的方法制备了哮喘模型。其中Temelkovski等以OVA(OVA作为一种免疫原性强的变应原,经常在变态反应性疾病的动物模型中应用[8])腹腔注射致敏动物,然后再经过反复多次抗原微粒激发获得模型,该模型较好的模拟了人哮喘时的多种特征,在近期的研究中被广泛应用[9-11]。本实验参考了Temelkovski等所用的方法略加改进,以OVA致敏大鼠,14 d后,每天雾化吸入OVA溶液,连续28 d激发动物。实验结果表明,大鼠出现了典型的哮喘样呼吸变化,肺组织出现了明显的哮喘样气道损伤,肺灌洗液中嗜酸粒细胞增多,反映了该模型较好地模拟了人类慢性持续哮喘时的特征。
目前制备抑郁模型的方法很多[12]。本实验参考W illner等[13]提出的CUMS法略加改进建立模型,在复制哮喘模型后,对大鼠予以多种CUMS。实验结果显示,经过干预模型组大鼠糖水消耗量显著下降,反映了经过CUMS后,动物快感下降,兴趣丧失,表明其对奖赏的反应性下降。此外,大鼠水平、垂直活动次数是其自主活动度常用的评价指标[14],本研究中Open-field实验结果显示,模型组大鼠水平、垂直活动次数减少,反映了动物的活动度的降低、对新鲜环境的好奇程度降低。此外,大鼠尚出现体质量下降,毛发无光泽、竖立等变化。以上实验结果表明大鼠具备了抑郁的特征。
哮喘后抑郁大鼠模型的建立不同于内源性抑郁的动物模型,必须具备与临床相类似的哮喘病理基础,同时又较好地模拟抑郁症的临床表现,并且能利于观察。本实验中大鼠哮喘后予以孤养,与临床上患者哮喘反复发作住院期间远离家庭和社会,缺少关怀的心理状态较为相似;同时实验中对大鼠予以了多种慢性轻度不可预见性应激,与临床上哮喘患者因哮喘反复发作而经历呼吸困难、剧烈咳嗽、恐惧、治疗失败导致绝望等多种应激过程较为相似。本实验首次将哮喘与抑郁有机结台起来,既兼备了哮喘与抑郁的特征,同时也较好地模拟了其临床发病过程。与普通大鼠抑郁模型相比,更适合用于哮喘伴发抑郁的相关问题研究。
综上所述,本实验制备的动物模型兼备了以下几个特点:①动物同时具备了哮喘及抑郁的双重特性;②具备与临床相似的病理过程;③制备方法可靠、成功率较高。④操作简单、耗资少。
(本文图2见彩插11。)
[1]宋玉萍,孙宏伟,王艳郁.支气管哮喘与情绪的研究进展[J].中国行为医学科学,2006,15(12):1151-1152.
[2]王艳郁,孙宏伟,宋玉萍.心理社会因素影响支气管哮喘的神经免疫机制[J].中国行为医学科学,2007,16(4):379-380.
[3]洪华,黄如训,王庭槐,等.脑卒中后抑郁大鼠模型的建立[J].中国临床康复,2002,6(9):1266-1267.
[4]邢东明,国月英,炎彬,等.缺血再灌卒中后抑郁小鼠模型的建立[J].中国比较医学杂志,2009,19(3):14-19.
[5]Sakai K,Yokoyama A,Kohno N,et al.Effect of different sensitizing doses of antigen in a murine model of atopic asthma[J].Clin Exp Immunol,1999,118(1):9-15.
[6]Schwarze J,Gelfand EW.Respiratory viral infections as promoters of allergic sensitization and asthma in animal models[J].Eur Respir J,2002,19(2):341-349.
[7]Temelkovski J,Hogan SP,Shepherd DP,et al.An improved murine model of asthma:selective airway inflammation,epithelial lesions and increased methacholine responsiveness following chronic exposure to aerosolised allergen[J].Thoax,1998,53 (10):849-856.
[8]刘颖,郑春泉,余洪猛,等.脂多糖对大鼠实验性变应性鼻炎的影响[J].中国实验动物学报,2007,15(4):289-291.
[9]Siddiqui S,Morris J,Avery N,et al.Pulmonary eosinophilia correlates with allergen deposition to the lower respiratory tract in a mouse model of asthma[J].Clin Exp Allergy,2008,38(8): 1381-1390.
[10]Lee CM,Chang JH,Moon DO,et al.Lycopene suppresses ovalbumin-induced airway inflammation in a murine model of asthma[J].Biochem Biophys Res Commun,2008,374(2):248-252.
[11]Van Overtvelt L,Lombardi V,Razafindratsita A,et a1.IL-10-inducing adjuvants enhance sublingual immunotherapy efficacy in a murine asthma model[J].Int Arch Allergy Immunol,2008,145(2):152-162.
[12]郭建友,李昌煜,葛卫红.抑郁症动物模型研究进展[J].中国临床康复,2004,8(10):1932-1933.
[13]Willner P,Towell A,Sampson D,et al.Reduction of sucrose preference by chronic mild unpredictable stress and its restoration by a tricyclic antidepressant[J].Psychopharmacology,1987,93:358-364.
[14]买文丽,王琼,刘新民,等.小鼠自主活动实验中的评价指标[J].中国实验动物学报,2008,16(3):172-175.
Estab lishm ent of a Rat M odel of Bronchial Asthm a Com bined w ith Dep ression
SUN Hong-wei1,LI Cheng-de2,MAO Shu-mei2,SONG Yu-ping1,WANG Yan-yu1
(1.Department of App lied Psychology,2.Department of Pharmacology,Weifang Medical College,Weifang 261053,China)
ObjectiveTo establish a rat model of bronchial asthma combined with depression.M ethods Twenty-two W istar rats were random ly divided into control group and model group.The latter were sensitized with ovalbumin for 4 weeks and followed by CUMS for 4 weeks.Pathological changes of the lung tissue were observed by light m icroscopy and transmission electron microscopy.Eosinophil count and other inflammatory cell count in bronchoalveolar lavage fluid (BALF)were performed.The changes of behavior were detected by open-field test and sucrose solution consumption test. Results Compared with the control group,the body weight of the rats of model group was significantly lower(P<0.05),and the lung tissues were altered,the total cellular score,EOS count and lymphocyte count were significantly increased(P<0.05).The vertical scores,horizontal scores in open-field test decreased significantly(P<0.05).The intake of 1% sucrose solution was significantly decreased(P<0.05).Conlusions This experimental model,established by sensitizing with ovalbumin and followed by CUMS,replicates many of the features of human asthma and depression,and should facilitate studies of pathogenetic mechanisms and potential therapeutic agents.So,it is an appropriate animal model of bronchial asthma combined with depression.
Bronchial asthma;Depression;Model;Chronic unpredictable mild stress(CUMS);Rat
R562.25
A
1005-4847(2010)02-0156-05
2009-09-01
山东省教育厅科技计划项目(编号:J07YE03);山东省自然科学基金资助项目(编号:ZR2009CL045)。
孙宏伟(1962年-),男,博士,教授,硕士生导师,研究方向:临床心理学。

