花生过敏原Ara h 6的分离纯化及鉴定
罗春萍,高金燕,胡纯秋,陈红兵,*,闫 飞
(1. 南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学 中德联合研究院,江西 南昌 330047;3.南昌大学环境与化学工程学院,江西 南昌 330047;4.南昌大学生命科学与食品工程学院,江西 南昌 330047)
花生过敏原Ara h 6的分离纯化及鉴定
罗春萍1,2,3,高金燕4,胡纯秋1,2,陈红兵1,2,*,闫 飞2,3
(1. 南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学 中德联合研究院,江西 南昌 330047;3.南昌大学环境与化学工程学院,江西 南昌 330047;4.南昌大学生命科学与食品工程学院,江西 南昌 330047)
为高效分离纯化花生过敏原Ara h 6,通过脱脂、蛋白浸提、阴离子交换层析分离得到目的蛋白,并用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF/MS)及免疫印迹技术(Western blotting)对其进行鉴定。结果表明,该蛋白为花生过敏原Ara h 6,其分子质量约为15kD,纯度大于95%,得率为22.5%。该方法简单、高效,可为花生过敏的进一步研究提供实验材料。
花生过敏;Ara h 6;分离纯化
Abstract :In order to effectively isolate and purify peanut allergen Ara h 6, peanut was subjected to a series of sequential treatments, namely de-fatting, protein extraction and anion-exchange chromatographic. Sodium dodecyl sulfate polyacrylamide gel electropheresis (SDS-PAGE), matrix-assisted laser desorption/ionization time of flight mass spectrometry (MALDI-TOF/MS) and Western blotting were used for the identification of target protein. The results indicated that the purified target protein was peanut allergen Ara h 6 with a molecular weight of 15 kD. The purity of Ara h 6 was more than 95%, and the recovery rate was 22.5%. Based on these investigations, a simple and efficient approach to purifying Ara h 6 is achieved, which will provide experimental materials for further research on peanut allergy.
Key words:peanut allergy;Ara h 6;isolation and purification
Ara h 6是花生中的过敏原之一,属于2S白蛋白家族,与花生主要过敏原Ara h 2的氨基酸序列有59%的同源性[1]。Ara h 6约占花生蛋白总含量的4.5%[2],其分子质量约为15kD,等电点为5~6[3]。近年来,Ara h 6蛋白在花生过敏反应中的重要作用得到越来越多的关注,因而获得高纯度的具有天然活性的Ara h 6蛋白将为其结构和性质的研究提供必不可少的材料。迄今为止,Suhr[3]、Marsh[4]和Koppelman[5]等用阴离子交换层析结合凝胶层析或高效液相色谱等技术分离了Ara h 6,而只用阴离子交换层析法分离纯化Ara h 6的方法尚未见报导。本实验以花生为研究对象,采用DEAESepharose Fast Flow阴离子交换法分离纯化得到高纯度的花生过敏原Ara h 6,并通过SDS-PAGE电泳、MALDITOF/MS质谱和Western blotting鉴定,旨在为进一步开展花生过敏原Ara h 6的结构与功能等研究提供良好的实验材料。
1 材料与方法
1.1 材料、试剂与仪器
新鲜花生 市购;DEAE-Sepharose Fast Flow GE公司;牛血清白蛋白(电泳纯) 中国医学科学院血液学研究院;兔抗花生过敏原Ara h 6多克隆抗体 实验室自制;HRP酶标羊抗兔IgG二抗 Sigma公司;其他常用生化试剂均为分析纯。
PB-10型pH计 德国Sartorius公司;高速冷冻离心机 Backman公司;蛋白质分离纯化系统 上海青浦沪西仪器厂;迷你型蛋白电泳仪、电转仪、凝胶成像仪 Bio-Rad公司。
1.2 方法
1.2.1 分离纯化与鉴定工作流程图

1.2.2 花生蛋白的粗提
参照Koppelman等[5]和Bernard等[6]的方法对花生进行粗提。
1.2.2.1 花生脱脂
新鲜花生剥壳去红衣,用液氮研磨成细粉末。将花生粉末与丙酮溶液按1:5(m/V)混合,磁力搅拌(4℃)脱脂2h后,4℃、9000r/min离心15min,弃上清,将该沉淀反复脱脂3次,冷风吹干后得脱脂花生粉末。
1.2.2.2 花生蛋白浸提
将脱脂花生粉末与Tris-HCl溶液(50mmol/L,pH7.2)按1:5(m/V)混合,磁力搅拌(4℃)10h后,4℃,9000r/min离心15min,取上清,并收集沉淀。向沉淀中加入Tris-HCl溶液(50mmol/L,pH7.2)反复浸提两次,-20℃保存备用。
1.2.3 离子交换层析分离纯化花生过敏原Ara h 6
参照张英坤等[7]的方法采用阴离子交换树脂DEAESepharose Fast Flow(2.0cm×30cm)进行分离纯化。用Tris-HCl溶液(50mmol/L,pH7.2)平衡柱子,待柱子平衡后,加入12mL花生粗蛋白溶液,并用Tris-HCl溶液(50mmol/L,pH7.2)进行洗脱,洗脱至基线后改用含0~0.2mol/L NaCl的Tris-HCl溶液(50mmol/L,pH7.2)连续梯度洗脱。流速为1.5mL/min,分别收集洗脱峰部分,4min/管,紫外吸收法测定A280nm,检测蛋白质。
1.2.4 分离纯化蛋白的纯度鉴定
采用SDS-PAGE电泳进行蛋白的纯度鉴定[8]。将收集所得的蛋白溶液分别取样,与等体积2×上样缓冲液混合制成电泳样品,采用不连续SDS-PAGE电泳,使用5%浓缩胶和15%分离胶。电泳后,考马斯亮蓝染色、脱色。Quantity one软件灰度扫描分析蛋白纯度。
1.2.5 花生过敏原Ara h 6的质谱鉴定
将纯化的蛋白进行SDS-PAGE电泳,考马斯亮蓝染色,将目的条带割下,加入灭菌蒸馏水,密封,冷冻保存。送至暨南大学生命与健康工程研究院功能蛋白质中心进行MALDI-TOF/MS质谱鉴定。
1.2.6 花生过敏原Ara h 6的血清学鉴定
采用Western blotting鉴定。纯化的Ara h 6蛋白经SDS-PAGE电泳分离后转移至PVDF膜上,用1% TBST室温封闭1h,加入1:5000(V/V)稀释的抗花生过敏原Ara h 6的血清,4℃反应过夜;用TBS洗膜后加1:5000(V/V)稀释的HRP酶标羊抗兔IgG二抗,室温反应2h,洗膜后加显色液4-氯-1-萘酚显色即可。
1.2.7 花生过敏原Ara h 6得率的测定
参照Folin-酚法[9]测定分离所得的蛋白样品浓度,以牛血清白蛋白作为标准蛋白制定标准曲线,并计算Ara h 6蛋白的得率。
2 结果与分析
2.1 花生蛋白粗提物的电泳分析

图1 花生蛋白粗提物SDS-PAGE电泳图Fig.1 SDS-PAGE of the first, second and third extraction products of crude peanut proteins
花生仁经粉碎、脱脂、浸提等操作后获得花生粗蛋白溶液,脱脂花生粉末经3次浸提后所得蛋白粗提物的SDS-PAGE电泳图见图1。粗提物中主要为Ara h 1~3和Ara h 6,其中Ara h 3的含量最高,其次是Ara h 1,Ara h 6的含量比Ara h 2略低。比较脱脂花生粉末反复浸提的结果可知,对该花生粉末经3次提取即可提取花生中的大部分蛋白。第1次提取的粗提物中花生蛋白的含量非常低,这可能是由于花生中存在某种物质抑制了花生蛋白的提取,且该抑制物溶于Tris-HCl溶液,经离心后可被除去。
Ara h 6在花生蛋白中的含量较低,本实验采用多次浸提方法可使原料的利用率提高。且在整个粗提过程中未使用变性剂,始终保持低温的条件,均可使蛋白保留天然活性。此外,经研究发现,花生粗蛋白溶液经反复冻融后,其浓度明显降低。这是因为花生蛋白主要为贮藏蛋白,易发生凝聚现象。因此,花生蛋白粗提后应尽快用于离子交换层析,尽量减少因凝聚而导致其可溶性蛋白含量降低。
2.2 离子交换层析分离纯化花生过敏原Ara h 6
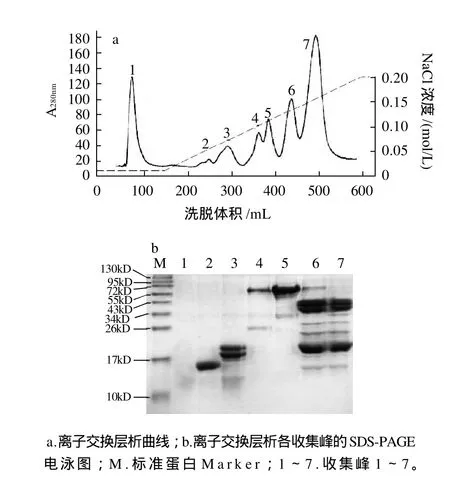
图2 阴离子交换层析分离花生过敏原Ara h 6Fig.2 Anion-exchange chromatographic profile of peanut allergen Ara h6 extract on DEAE-Sepharose Fast Flow column and SDS-PAGE of 7 resultant fractions
在pH7.2的条件下,花生蛋白中的一些碱性蛋白质带正电荷,不能被DEAE-Sepharose Fast Flow柱吸附而直接被洗脱下来,如图2a峰1所示,该蛋白为分子质量小于14kD的小分子蛋白。Ara h 6等酸性蛋白质,在该pH值条件下带负电荷,可被DEAE-Sepharose Fast Flow 柱吸附。蛋白质所带电荷数不同,与树脂的结合力也不同,随着NaCl离子强度的增加,蛋白按结合力的强弱被依次洗脱下来,其洗脱曲线见图2a。其中图2a峰2在NaCl离子强度为0.05mol/L时被洗脱下来,SDSPAGE电泳检测为目标蛋白花生过敏原Ara h 6(如图2b峰2),其分子质量约为15kD,与Koppelman等[5]分离的Ara h 6的分子质量相同,灰度扫描该蛋白纯度大于95%(图略)。
在洗脱过程中随着NaCl离子强度的增加,继Ara h 6后出现的第3个峰即为花生过敏原Ara h 2,SDS-PAGE电泳检测为分子质量约为18kD和20kD的两个条带(图2b),灰度扫描该蛋白纯度约为85%。Ara h 6与Ara h 2的氨基酸序列有59%的同源性,它们的某些性质非常相似,两者的分离纯化是研究的一个难点,Marsh等[4]曾用反相高效液相色谱法分离Ara h 6和Ara h 2。但本实验发现,简单的阴离子交换法即可分离这两种蛋白,且两者的纯度都较高。
在NaCl离子强度达到0.1mol/L时,峰4和峰5被洗脱下来,SDS-PAGE电泳检测为花生过敏原Ara h 1,其中灰度扫描峰5的蛋白纯度约为80%。而在以往的分离Ara h 6的研究中,Suhr等[3]和Koppelman等[5]均先用凝胶层析法除去Ara h 1和其他一些杂蛋白,再用阴离子交换法来纯化Ara h 6粗品。本实验所用的分离方法既得到了目的蛋白Ara h 6,又可得到纯度较高的花生主要过敏原Ara h 1,方法更简单,分离所得的蛋白种类更多。
峰6和峰7含有大量的花生过敏原Ara h 3,该粗品可用于Ara h 3的进一步分离纯化。从离子交换层析的洗脱曲线可以看出,花生过敏原与阴离子交换树脂DEAE-Sepharose Fast Flow的结合能力由弱到强依次为Ara h 6、Ara h 2、Ara h 1、Ara h 3。本实验采用改变盐浓度而不是去改变pH值的方法来进行梯度洗脱,因为盐浓度更容易控制,在实验中利用恒流泵的辅助可以使流入柱的缓冲液中的盐浓度平衡地上升,该方法的重现性非常好。
2.3 花生过敏原Ara h 6的质谱鉴定结果

图3 花生过敏原Ara h 6的质谱图Fig.3 MALDI-TOF-MS spectrum of peanut allergen Ara h 6
MALDI-TOF/MS是通过肽质量指纹谱结合数据库搜寻以分析蛋白质序列而进行蛋白质鉴定,该质谱操作简便、灵敏度高,同许多蛋白分离方法相匹配,且现有数据库中有充足的关于多肽质量/电荷比值的数据,因而被广泛用于分析鉴定未知蛋白质[10]。本实验将分离所得目标蛋白进行胰蛋白酶酶解后,用MALDI-TOF/MS质谱分析获得了一个一级质谱图(图3)和7个二级质谱图(图略)。根据一级和二级质谱数据使用GPS Explore软件(软件版本号:V3.6,美国应用生物系统公司)进行分析,分析后的每一个样品的一级和二级质谱数据再整合成一个文件,使用MASCOT(软件版本号:V2.1,英国Matrix Science公司)搜库软件对NCBlnr数据库进行检索比对,结果发现本实验纯化所得的蛋白与花生过敏原Ara h 6相匹配,匹配度为100%,该过敏原在NCBlnr数据库中的序列号为gil75114094,分子质量为16.9kD,等电点为6.13,肽段序列比对结果见表1。本实验在用SDS-PAGE电泳对目标蛋白进行鉴定的基础上,通过MALDI-TOF/MS质谱鉴定进一步证明了该蛋白为花生过敏原Ara h 6。
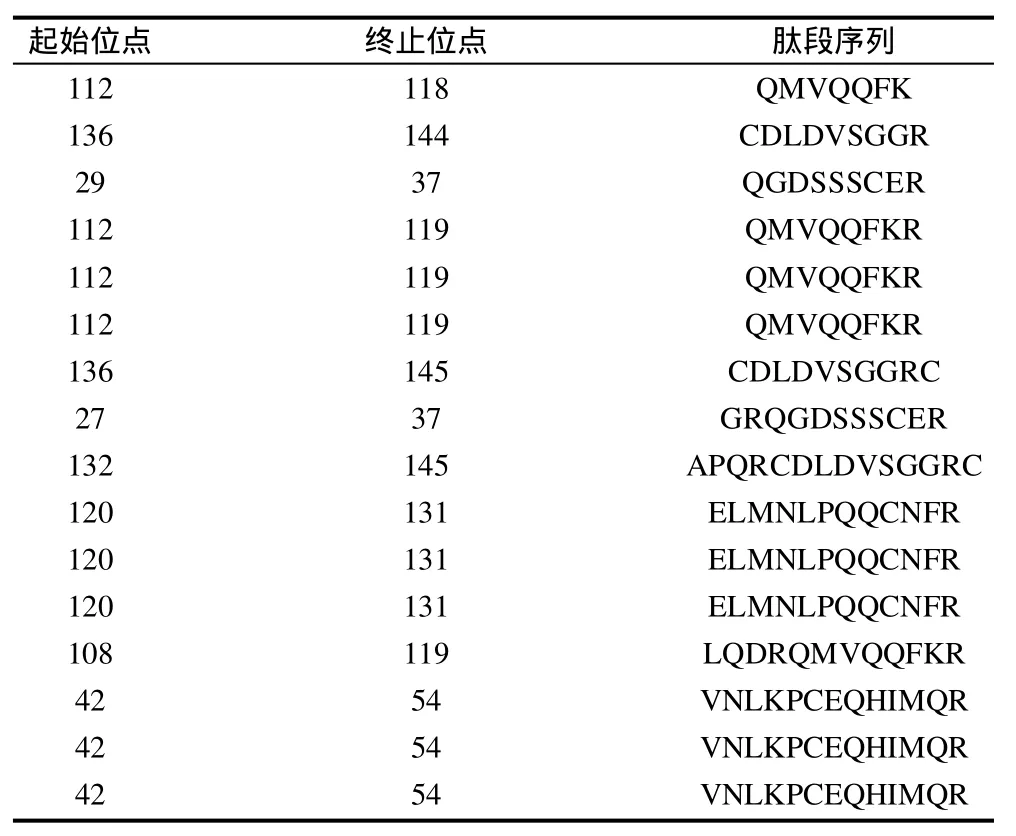
表1 花生过敏原Ara h 6质谱鉴定肽段序列比对结果Table 1 Identification of peptides in peanut allergen Ara h 6 by mass spectroscopy
2.4 花生过敏原Ara h 6的Western blotting分析
Western blotting鉴定蛋白质是根据被测蛋白能否与特异性抗体结合的特性和该蛋白的分子质量,该方法具有高效、简便、灵敏等特点,是检测样品中是否存在蛋白抗原的一种可靠方法[11]。本实验将纯化所得的目标蛋白进行Western blotting检测,结果显示,与SDSPAGE电泳相对应的Ara h 6组分的泳道在分子质量约15kD处出现单一的条带,如图4所示。说明兔抗花生过敏原Ara h 6抗体可以特异性地识别Ara h 6,并且与其他蛋白条带无特异性的识别,进一步证明了本实验分离得到了高纯度的花生过敏原Ara h 6。
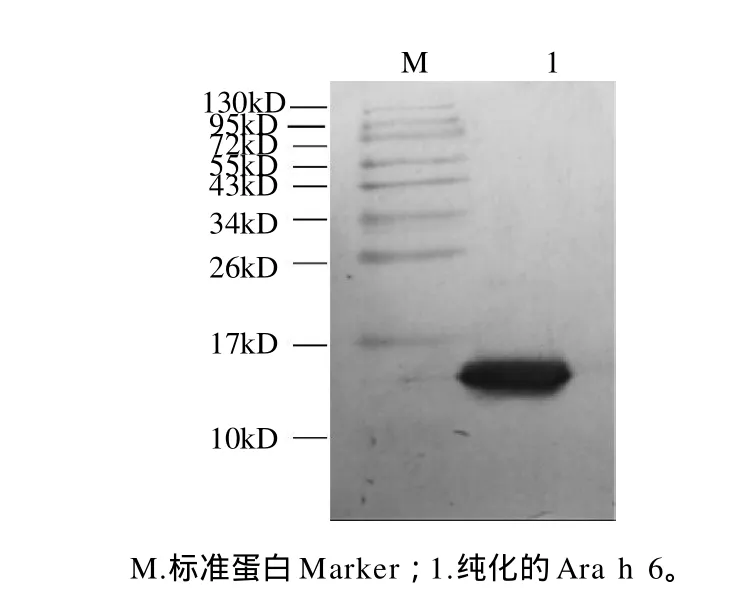
图4 花生过敏原Ara h 6的Western blotting分析Fig.4 Western blotting analysis of peanut allergen Ara h 6
2.5 花生过敏原Ara h 6的得率
花生过敏原Ara h 6约占花生总蛋白含量的4.5%[2],目前报道的该蛋白的纯化方法均比较复杂,很难计算Ara h 6的得率或其得率很低。因此,关于纯化所得花生过敏原Ara h 6蛋白的得率尚未见报道。本实验以Ara h 6占花生总蛋白含量的4.5%为依据计算经分离所得的Ara h 6的得率,阴离子法分离得到的花生过敏原Ara h 6的蛋白含量及得率如表2所示。结果表明,该阴离子交换法分离所得的Ara h 6的得率为22.5%。

表2 阴离子法分离得到的花生过敏原Ara h 6的得率Table 2 Recovery rate of Ara h 6 purified by anion-exchange chromatography
3 结 论
本研究选用新鲜花生为原料,采用阴离子交换法分离得到花生过敏原Ara h 6。经SDS-PAGE电泳检测,目标蛋白的分子质量约为15kD,纯度大于95%,且蛋白得率为22.5%。经MALDI-TOF/MS质谱和Western blotting进一步鉴定该蛋白为花生过敏原蛋白Ara h 6。本实验所用方法的优越性在于采用了简单的离子交换层析法,得到了高纯度的目标蛋白。该方法简单,易操作,成本低,实验所得高纯度的花生过敏原Ara h 6可用于开展该蛋白的结构与功能研究。
[1] KLEBER-JANKE T, CRAMERI R, APPENZELLER U, et al. Selec-tive cloning of peanut allergens including profilin and 2S albumins by phage disply technology[J]. Allergy Immunology, 1999, 119(4): 265-274.
[2] van WIJK F, NIERKENS S, HASSING I, et al. The effect of the food matrix on in vivo immune responses to purified peanutallergens[J].Toxicological Sciences, 2005, 86(2): 333-341.
[3] SUHR M, WICKLEIN D, LEPP U, et al. Isolation and characterization of natural Ara h 6: Evidence for a further peanut allergen with putative clinical relevance based on resistance to pepsin digestion and heat[J].Mol Nutr Food Res, 2004, 48: 390-399.
[4] MARSH J, RIGBY N, WELLNER K, et al. Purification and characterisation of a panel of peanut allergens suitable for use in allergy diagnosis[J]. Mol Nutr Food Res, 2008, 52: 272-285.
[5] KOPPELMAN S J, JONG G A H, LAAPER-ERTMANN M, et al.Purification and immunoglobulin E-binding properties of peanut allergen Ara h 6: Evidence for cross-reactivity with Ara h 2[J]. Clin Exp Allergy, 2005, 35: 490-497.
[6] BERNARD H, MONDOULET L, DRUMARE M F, et al. Identification of a new natural Ara h 6 isoform and of its proteolytic product as major allergens in peanut[J]. J Agric Food Chem, 2007, 55: 9663-9669.
[7] 张英坤, 陈红兵. 离子交换层析法分离花生过敏原Ara h 2的研究[J]. 食品科学, 2006, 27(12): 259-262.
[8] 汪家政, 范明. 蛋白质技术手册[M]. 北京: 科学技术出版社, 2000:77-110.
[9] 李建武, 余瑞元, 袁明秀, 等. 生物化学实验原理和方法[M]. 北京:北京大学出版社, 2001: 216-223.
[10] 陈晶, 付华, 陈益. 质谱在肽和蛋白质序列分析中的应用[J]. 有机化学, 2002, 22(2): 81-90.
[11] 哈洛 E, 莱恩 D. 抗体技术实验指南[M]. 北京: 科学出版社, 2002:161-165.
Purification and Identification of Peanut Allergen Ara h 6
LUO Chun-ping1,2,3,GAO Jin-yan4,HU Chun-qiu1,2,CHEN Hong-bing1,2,*,YAN Fei2,3
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China;3. School of Environmental and Chemical Engineering, Nanchang University, Nanchang 330047, China;4. School of Life Sciences and Food Engineering, Nanchang University, Nanchang 330047, China)
TS201.21
A
1002-6630(2010)15-0076-04
2010-04-20
南昌大学食品科学与技术国家重点实验室目标导向项目(SKLF-MB-200807);
江西省主要学科学术和技术带头人培养项目([2004]234号);教育部新世纪优秀人才支持计划项目(NCET-08-07-04)
罗春萍(1985—),女,硕士研究生,研究方向为生物加工工程。E-mail:went_fly@163.com
*通信作者:陈红兵(1967—),男,教授,博士,研究方向为食品生物技术。E-mail:chbgjy@hotmail.com

