桦褐孔菌多糖IOP3a的分离纯化及其体外抗肿瘤活性研究
陈义勇,顾小红,汤 坚
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.常熟理工学院生物与食品工程学院,江苏 常熟 215500)
桦褐孔菌多糖IOP3a的分离纯化及其体外抗肿瘤活性研究
陈义勇1,2,顾小红1,汤 坚1
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.常熟理工学院生物与食品工程学院,江苏 常熟 215500)
采用水浴浸提,Sevage法去除蛋白分离得到粗多糖,DEAE-SepharoseCL-6B离子交换柱、SepharoseCL-6B和Sephadex G-200凝胶柱层析得到桦褐孔菌均一纯多糖IOP3a,用MTT法研究IOP3a对Jurkat、Daudi肿瘤细胞体外抑制作用。结果表明:IOP3a对肿瘤细胞Jurkat和Daudi的增殖具有明显的体外抑制作用(P<0.01),并且具有量效依赖性,其最大抑制率分别达到71.84%和75.14%。
桦褐孔菌多糖;纯化;体外抗肿瘤
Abstract:Water extraction and deproteinization by Sevag method were carried out for the preparation of a crude polysaccharide extract from Inonotus obliquus, named IOP. IOP was subjected to sequential treatments with DEAE-Sepharose CL-6B anion exchange, Sepharose CL-6B and Sephadex G-200 columns for purification purpose and a polysaccharide fraction, named IOP3a,was obtained, which was identified to contain a single composition. The inhibitory effect of IOP3a on the proliferation of Jurkat and Daudi tumor cells in vitro was evaluated by MTT assay. It was found that IOP3a had an obvious anti-tumor activity in a dose-dependent manner in vitro (P < 0.01) and that the maximum inhibitory ratio of IOP3a on Jurkat and Daudi tumor cells were 71.84% and 75.14%, respectively.
Key words:Inonotus obliquus polysaccharide;purification;anti-tumor activity in vitro
桦褐孔菌(Inonotus obliquus)是一种应用很广泛的药用真菌,主要寄生于白桦树、银桦、赤杨等的树干或树皮下,菌丝体极其耐寒,能耐受-40℃的低温,主要分布在北纬45°~50°地区的北美、芬兰、波兰、俄罗斯的西伯利亚、远东部分地区、勘察加半岛、中国的黑龙江和吉林、日本的北海道等国家和地区[1]。桦褐孔菌多糖具有抗肿瘤活性[2-4]、降血糖活性[5]、免疫调节活性[6-8]、抗氧化、降血脂等功能,在医药工业上有着广阔的应用前景。但是目前关于桦褐孔菌多糖的分离纯化鲜有报道,因此实验就桦褐孔菌多糖IOP3a分离、纯化及其体外抗肿瘤活性进行研究,以期为桦褐孔菌资源的开发及其在医药、保健食品等领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
桦褐孔菌由黑龙江亚布力土产公司提供,经常熟理工学院冀宏研究员鉴定为担子菌亚门、多孔菌科褐卧孔菌属。
Jurkat 细胞(人T淋巴细胞白血病细胞株)、Daudi细胞(人B淋巴细胞瘤细胞),由中国人民解放军军事医学科学院惠赠。
DEAE-Sepharose CL-6B、Sepharose CL-6B、Sephadex G-200填料 Pharmacia公司;小牛血清、四氮甲基偶氮哇盐(MTT)、二甲基亚砜(DMSO) 美国Sigma公司;RPM I1640培养液 美国Gibco公司; 葡萄糖、苯酚、浓硫酸、乙醇等均为国产分析纯。
1.2 仪器与设备
DJ-04粉碎机 上海淀久中药机械制造有限公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器公司;752型紫外-可见分光光度计 上海精密科学仪器有限公司;LD4-ZA型离心机 北京医用离心机厂;SHB-B循环水式真空泵 郑州长城科工贸公司;LGJ-10冷冻干燥仪南京百思威科技有限公司;DG3022型酶标仪 美国Bio-Rad公司;Nu-3500型CO2培养箱 德国Nuaice公司。
1.3 方法
1.3.1 原料预处理
桦褐孔菌经过粉碎后,过40目筛,用体积分数为80%的乙醇溶液在70℃条件下回流2次,每次3h,以有效去除部分醇溶性物质,然后1000r/min离心20min,去除上清液,沉淀经60℃真空干燥,得到预处理桦褐孔菌粉。
1.3.2 桦褐孔菌多糖(IOP)的提取及初步纯化
取经过处理的桦褐孔菌粉,以水作为溶剂提取多糖,提取液离心去掉沉淀,合并滤液,减压浓缩,在滤液中加95%乙醇,使乙醇含量达到80%,静置过夜,次日经过离心后收集沉淀,用乙醇洗涤3次,冷冻干燥。将冷冻干燥后的桦褐孔菌粗多糖分别加入一定量的去离子水溶解,用Sevag法去除游离蛋白:将Sevag试剂(氯仿与丁醇体积比4:1)加入样品中,体积为样品体积的1/4,充分振荡,3000r/min离心30min,去除蛋白形成的沉淀,重复5~6次。上清液浓缩后流水透析2d,去离子水透析2d,3000r/min离心30min,浓缩,冷冻干燥,得到初步纯化的水提粗多糖IOP。
1.3.3 IOP的DEAE-Sepharose CL-6B离子交换分级纯化
将DEAE-Sepharose CL-6B预处理并装柱(2.6cm×37cm),用大量的磷酸盐缓冲液平衡8h,体积流量控制为90mL/h,而后将经过初步分离纯化后的IOP水溶液上柱,依次用pH7.03的磷酸盐缓冲液、0~1.5mol/L KCl(配制于磷酸盐缓冲液)进行线性梯度洗脱,每管9mL自动部分收集器收集,苯酚-硫酸法[9]跟踪检测多糖含量(OD490nm),分别收集单一组分,然后透析脱盐浓缩。
1.3.4 IOP3的Sepharose CL-6B凝胶柱分级纯化
IOP3分别经Sepharose CL-6B(2.6cm×160cm)柱层析,用0.02mol/L KCl溶液洗脱,体积流量控制为20mL/h,每管4mL自动部分收集器收集,苯酚-硫酸法[9]跟踪检测多糖含量(OD490nm)。
1.3.5 IOP3a的Sephadex G-200凝胶柱分级纯化
IOP3a经Sephadex G-200(2.6cm×160cm)柱层析,用0.02mol/L KCl溶液洗脱,体积流量控制为20mL/h,每管4mL自动部分收集器收集,苯酚-硫酸法[9]跟踪检测多糖含量(OD490nm)。再经去离子水透析,最后冷冻干燥,得到水溶性桦褐孔菌多糖纯品(IOP3a)。
1.3.6 IOP3a组分的紫外扫描
将经SepharoseCL-6B柱层析分离得到的IOP3a进行全波长扫描。
1.3.7 IOP3a的体外抗肿瘤活性
1.3.7.1 细胞培养
在37℃、体积分数为5%的CO2孵箱中对Jurkat、Daudi肿瘤细胞在RPMI1640培养液(含10%灭活胎小牛血清、青霉素1×105U/L和链霉素100mg/L)中常规培养,隔天传代,调整细胞生长状态,取对数生长期、生长良好的细胞,再调整细胞密度为1×106个/mL进行实验。
1.3.7.2 IOP3a体外对肿瘤细胞的抑制作用
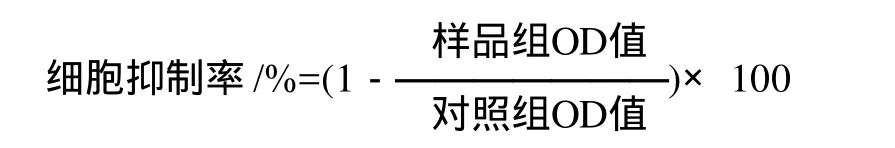
采用 MTT比色法[10],取对数生长期的Jurkat细胞和Daudi细胞,每孔100μL,接种于96孔塑料培养板内,静止培养12h后,对照组加0.9%生理盐水不加IOP3a,样品组每孔内分别加入桦褐孔菌多糖组分IOP3a,使其终质量浓度分别为0.7、2.3、7、70、200μg/mL,每个质量浓度设3个平行孔,然后将培养板移入CO2培养箱中,在37℃、5% CO2以及饱和湿度条件下培养24h后,每孔内分别加入MTT试剂20μL,其终质量浓度为500mg/L。37℃继续孵育6h后,终止培养,吸取弃除上清液后,每孔加入100μL二甲基亚砜(DMSO),轻轻振荡10min,使MTT还原产物完全溶解,用酶标仪在570nm波长处测定对照组和样品组各孔OD值,按以每组3个孔的平均值作为各组的平均OD值,根据下列公式计算肿瘤细胞Jurkat和Daudi的抑制率。
1.4 数据分析
采用SAS软件AVOVA(P<0.05)程序进行显著性分析,Duncan程序进行多重比较。
2 结果与分析
2.1 IOP的DEAE-SepharoseCL-6B离子交换分级纯化
IOP经过DEAE-SepharoseCL-6B柱分离所得洗脱曲线见图1。洗脱得到组分IOP1、 IOP2、 IOP3、IOP4,收集各组分,用自来水透析(截留分子质量为120kD)48h,然后用去离子水透析24h,冷冻干燥后计算可知,IOP1、 IOP2、 IOP3、 IOP4分别占总洗脱量的32.2%、 40.3 %、 14.7%、12.8%,IOP经DEAESepharoseCL-6B柱分离纯化后,多糖的回收率达85.6%(表 1)。
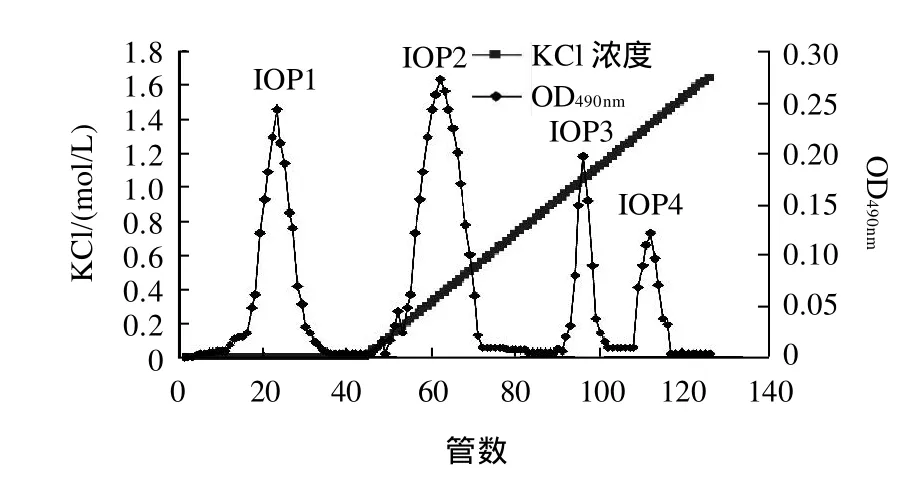
图1 IOP的DEAE-SepharoseCL-6B柱层析洗脱曲线Fig.1 Elution profile of IOP on DEAE-SepharoseCL-6B column

表1 IOP经DEAE-SepharoseCL-6B柱层析各组分所占比例和回收率Table 1 Ratio and recovery rate of each fraction (IOP 1 through 4) of IOP in the purification on DEAE-SepharoseCL-6B column
经过初步的抗肿瘤实验,比较IOP四个组分的抗肿瘤活性,证明IOP3的抗肿瘤活性最强,因此将IOP3进一步分离纯化,得到单一组分,并进一步研究单一组分的体外抗肿瘤活性。
2.2 IOP3的SepharoseCL-6B凝胶柱分级纯化
利用SepharoseCL-6B凝胶柱对IOP3组分进行进一步的分离纯化,其IOP3组分的洗脱结果如图2所示。
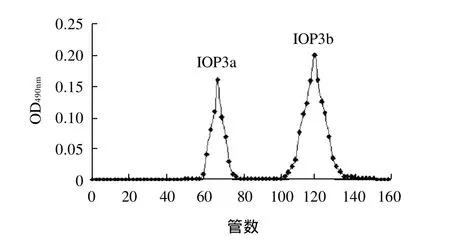
图2 IOP3的SepharoseCL-6B层析洗脱曲线Fig.2 Elution profile of IOP3 on SepharoseCL-6B column
由图2可以看出,IOP3组分经过凝胶柱色谱洗脱分离,得到2个相对分子质量不同的组分IOP3a、 IOP3b。
2.3 IOP3a 的Sephadex G-200凝胶柱分级纯化
经过初步的抗肿瘤活性筛选,比较IOP3a和IOP3b的体外抗肿瘤活性,结果表明IOP3a的体外抗肿瘤活性强于IOP3b,因此IOP3b暂不做下一步的研究。为检验所收集的IOP3a是否为均一的组分,对IOP3a进行了第二次凝胶柱层析,结果如图3所示。
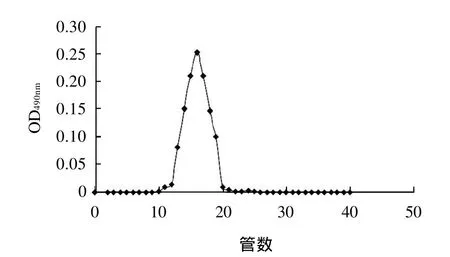
图3 IOP3a的Sephadex G-200柱层析洗脱曲线Fig.3 Elution profile IOP3a on Sephadex G-200 column
由图3可知,IOP3a经第二次凝胶柱层析只洗脱分离出一个单一的峰,表明IOP3a为相对分子质量分布均一的多糖组分。
2.4 IOP3a组分的紫外扫描图谱
为进一步验证IOP3a的纯度,将经SepharoseCL-6B柱层析分离得到的IOP3a进行全波长扫描,其扫描结果见图4。
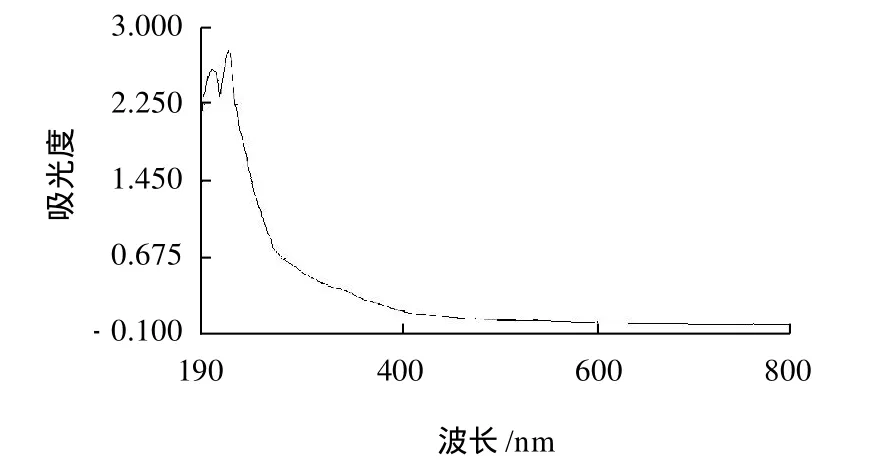
图4 IOP3a紫外扫描图Fig.4 UV absorption spectrum of IOP3a
由图4可以看出,IOP3a组分在特征吸收峰260nm和280nm波长处均无吸收,表明该组分不含有核酸及蛋白质。
2.5 IOP3a对Jurkat细胞增殖的影响
表2 桦褐孔菌多糖IOP3a对Jurkat细胞的抑制作用(±s,n=3)Table 2 Inhibitory effect of IOP3a on Jurkat cells (± s,n=3)
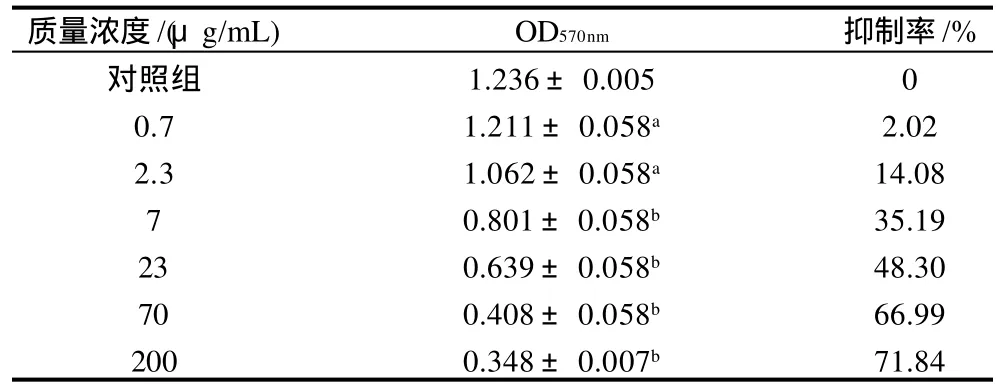
表2 桦褐孔菌多糖IOP3a对Jurkat细胞的抑制作用(±s,n=3)Table 2 Inhibitory effect of IOP3a on Jurkat cells (± s,n=3)
注:a.与对照组比较差异显著(P<0.05);b.与对照组比较差异极显著(P<0.01)。下同。
质量浓度/(μg/mL) OD570nm 抑制率/%对照组 1.236±0.005 0 0.7 1.211±0.058a 2.02 2.3 1.062±0.058a 14.08 7 0.801±0.058b 35.19 23 0.639±0.058b 48.30 70 0.408±0.058b 66.99 200 0.348±0.007b 71.84
从表2可以看出,IOP3a对肿瘤细胞Jurkat的增殖具有明显的抑制作用,而且随着多糖质量浓度的增加呈现出作用增强的趋势,具有量效依赖性,与对照组相比有显著性差异(P<0.01)。
2.6 IOP3a对Daudi细胞增殖的影响
表3 桦褐孔菌多糖IOP3a对Daudi细胞的抑制作用(±s,n=3)Table 3 Inhibitory effect of IOP3a on Daudi cells (±s,n=3)

表3 桦褐孔菌多糖IOP3a对Daudi细胞的抑制作用(±s,n=3)Table 3 Inhibitory effect of IOP3a on Daudi cells (±s,n=3)
质量浓度/(μg/mL) OD570nm 抑制率/%对照组 1.208±0.019 0 0.7 0.963±0.012b 20.25 2.3 0.614±0.058b 49.18 7 0.351±0.058b 65.89 23 0.395±0.058b 67.29 70 0.318±0.058b 73.65 200 0.300±0.141b 75.14
从表3 可以看出,IOP3a对肿瘤细胞Daudi的增殖具有明显的抑制作用,而且随着多糖质量浓度的增加呈现出作用增强的趋势,具有量效依赖性,与对照组相比有显著性差异(P<0.01)。
3 结 论
IOP经过离子交换层析和凝胶过滤层析得到均一的多糖组分IOP3a。
IOP3a对肿瘤细胞Jurkat和Daudi的增殖具有明显的体外抑制作用(P<0.01),其最大抑制率分别达到71.84%和75.14%,而且随着多糖质量浓度的增加呈现出作用增强的趋势,具有量效依赖性。
[1] 黄年来. 俄罗斯神秘的民间药用真菌: 桦褐孔菌[J]. 中国食用菌,2002, 21 (4): 7-8.
[2] KIM Y O, HANB S B, LEE H W, et al. Immuno-stimulating effect of the endo-polysaccharide produced by submerged culture of Inonotus obliquus[J]. Life Sciences, 2005, 77: 2438-2456.
[3] JAROSZ A, SKORSKA M, RZYMOWSKA J, et al. Effect of the extracts from fungus Inonotus obliquus on catalase level in Hela and Nocardia cells[J]. Acta Biochem Polon, 1990, 37(1): 149-152.
[4] KIM Y O, PARK H W, KIM J H, et al. Anti-cancer effect and structural characterization of endo- polysaccharide from cultivated mycelia of Inonotus obliquus[J].Life Sciences, 2006, 79: 72-80.
[5] MIZUNO T, ZHUANG C, ABE K, et al. Antiumor and hypo-glycemic activities of polysaccharides from the scleritia and mycelia of Inonotus obliquu[J]. Int J Med Mushrooms, 1999, 1(4): 301-316.
[6] BABITSKAIA V G, SHCHERBA V V, IKONNIKOVA N V. Melanin complex of the fungus Inonotus obliquus[J]. Priklbiokhim Microbiol,2000, 36(4): 439-442.
[7] WASSER S P. Medicinal mushrooms as a source of antitumor and immunmodulating polysaccharides[J]. Appl Microbiol Biotechnol, 2002,60: 258-274.
[8] RZYMOWSKA J. The effect of aqueous extracts from Inonotus obliquus on the mitotic index and enzyme activities[J]. Boll Chim Garm, 1998,137(1): 13-15.
[9] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 2003.
[10] CAO Wei, LI Xiaoqing, LIU Li. Structure of an anti-tumor polysaccharides from Angelica sinensis (Oliv.) Diels[J]. Carbohydrate Polymers,2006, 66: 149-159.
Isolation, Purification and Anti-tumor Activity of a Polysaccharide, IOP3a from Inonotus obliquus
CHEN Yi-yong1,2,GU Xiao-hong1,TANG Jian1
(1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. School of Biology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China)
O629.12;R730
A
1002-6630(2010)15-0091-04
2009-12-24
陈义勇(1974—),男,讲师,博士研究生,研究方向食品科学与天然活性成分。E-mail:chenyyxp@126.com

