芬太尼类似物结构修饰中高活性基团研究
周博宇 胡文祥*
北京首都师范大学化学系(100048)
镇痛药是一类作用于中枢神经系统,选择性减轻痛觉而不影响其他感觉的药物,其中主要是一些阿片受体镇痛剂(Opioid Agents)。1805年德国药师Sertürner从鸦片中分离出了一种称为吗啡的(morphine)化学物质,其具有良好的镇痛、镇静效果,虽然它同时具有很强的成瘾性及呼吸抑制、血压降低、恶心、呕吐、便秘、排尿困难等不良反应[1],但200年来一直用于临床。1923年morphine的化学结构阐明后,有关化学家们开始对morphine结构进行简化,以期发展成结构简单可以人工合成的镇痛药。根据吗啡的结构分析,可将其按化学结构类型分为吗啡喃类、苯吗喃类、哌啶类、氨基酮和氨基四氢奈类等[2]。哌啶类合成镇痛药按化学结构又可分为4-苯基哌啶类和4-苯胺基哌啶类[3]。
1 芬太尼及其他的重点类似物
在研究4-苯胺基哌啶类合成镇痛药的基础上,20世纪60年代初,Janssen[4]合成的一种起效快、强度高和作用时间适宜的麻醉性镇痛药芬太尼(Fentenyl),其镇痛强度为吗啡的200倍左右,属高效麻醉镇痛剂(图1)。
研究结果表明,芬太尼是一个主要作用于中枢神经系统的μ型阿片受体的激动剂,给药后能够产生全身麻醉镇痛药效,但也导致流汗、呼吸急促、四肢无力等不良反应,严重时会造成中枢神经系统紊乱,瘫痪、甚至威胁生命安全。因此,为了减少不良反应,人们开展了芬太尼结构修饰的一系列研究工作。
自芬太尼类化合物的镇痛活性被发现后,人们对其结构进行了多种改进,以便更好地研究芬太尼类化合物的构效关系。近年来,对强效麻醉性镇痛剂芬太尼的结构改变研究发现,在芬太尼分子中哌啶环上3-位引入甲基[5-7](图2)或4-位引入某些极性基团[8,9](图3)均能导致镇痛活性显著提高。3-位引入甲基后,使其分子形状更趋固定,结构更接近于吗啡,相当于吗啡“C”环的一部分[10]。3-甲基芬太尼、4-甲氧甲基芬太尼,4-乙酰基芬太尼和4-甲氧羰基芬太尼的镇痛强度分别为芬太尼的19、15.9、19.3和34.4倍[11]。量子化学计算和光晶体结构研究认为,这些基团引入后提高活性的主要原因是它们改变了分子的构象和活性部位的电子结构从而有利于与受体的结合[12-15]。
因此,寻找高活性基团,主要围绕着3-甲基芬太尼类和4-甲氧羰基芬太尼类化合物的1-位或者4-位取代酰胺基团进行结构修饰研究。
2 芬太尼类化合物1-位取代基结构修饰

图1 芬太尼结构

图2 3-甲基芬太尼
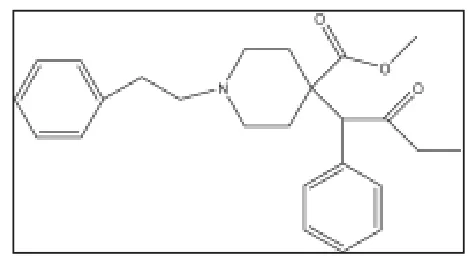
图3 4-甲氧羰基芬太尼

图4 羟甲基芬太尼
不管是芬太尼、3-甲基芬太尼、4-甲氧羰基芬太尼,还是3-甲基-4-甲氧羰基芬芬太尼,其哌啶环1-位上的结构修饰,具有非常重要的意义。构效关系研究已经表明,1-位与氮原子相连的两个亚甲基后连接芳香环、不饱和基团及具有负电荷中心的基团,对活性有重要的贡献[15]。因此,对芬太尼类化合物的1-位结构修饰非常有意义。
2.1 3-甲基芬太尼类化合物1-位结构修饰
通过对3-甲基芬太尼1-位结构的修饰中发现,1-位侧链基团的结构与镇痛活性以及麻醉活性的大小有密切关系。研究表明,3-甲基芬太尼哌啶环上的氮原子与1-位取代基苯环间的距离以两个碳原子为最好,大于或小于两个碳链,均导致镇痛作用明显下降[5]。和在镇痛活性中的情况相类似,1-位氮原子间隔两个碳原子连接一适宜活性基团显示出强效麻醉活性。
该基团为环状基团时以苯基活性最强(3-甲基芬太尼)。苯基被不同杂环基团取代除4-咪唑基和1,3-二氧六环基取代化合物麻醉活性接近于3-甲基芬太尼外,其余化合物的麻醉活性均显著降低。苯基被不同胺基取代为N-甲基苯胺基取代化合物具有与3-甲基芬太尼相当的强效麻醉活性。
20世纪70年代末,由中科院上海药物所朱有成等在3-甲基芬太尼(图4)的1-β-位上引入一个羟基,发现其麻醉镇痛活性显著增强[16]。实验数据证明,在目前已知的3-甲基芬太尼类化合物中,羟甲芬太尼的作用强度最强[17],镇痛活性为芬太尼的28倍,吗啡的6318倍[18]。其顺式异构体在小白鼠上的镇痛效能是吗啡的7000倍(ip,热板法)[5]。羟基被酯化或被其他基团取代均导致麻醉活性降低。其中活性最强的巯基取代化合物的麻醉活性也仅为相应羟基化合物(Hofentanyl)的1/4。表明β-羟基对于产生强效麻醉活性有重要的作用[16]。
有趣的是,苯基被某些取代乙烯基替代后也显示出很强的镇痛麻醉活性,北京药物化学研究所朱国政[19]等曾对3-甲基芬太尼1-位侧链进行改变,以取代乙烯基,氰基替代1位侧链上的β-苯基,发现1-位β-乙烯基引入芳环后活性较差,而引入Cl、CH3这样的小集团可保持高镇痛强度,与3-甲基芬太尼相当或接近。以氰基代替苯基镇痛活性下降。表明某些取代乙烯基是可替代1-β-苯基导致产生强效麻醉活性的一种有效结构。
对3-甲基芬太尼的l-苯乙基用不同直链烷烃进行取代,结果表明碳链长度为2~8个碳原子的取代衍生物均有较强的镇痛活性,为吗啡的2~l80倍。其中以5~6个碳原子长度的直链烷烃取代物镇痛活性为最强,小鼠扭体试验的镇痛效能分别为吗啡的l67和126倍,但都未超过3-甲基芬太尼的作用强度。这与在芬太尼系列及4-取代芬太尼系列中的情况是一致的[17],见表1。
从表1可以看出,3-甲基芬太尼类化合物哌啶环1-位取代基与苯乙基相当的活性有、、、、、、、、、、、、、,主要是烯烃、取代烯烃和芳香烃类。另外,接连苯乙基的亚甲基被羟基取代即,活性最强,被巯基取代活性相当,但相应的取代烯烃结构活性反而下降,见表2和表3。
表2中所列的结构几乎都是3-甲基芬太尼类活性最强的。从表2和表3中可以看出:①二苯羟乙基的活性与苯羟乙基相当,但随亚甲基链的增加而减弱;②1-位上的大基团似乎不影响活性;③亚甲基β-位上含氧原子基团,对活性的提高有较大的贡献;④顺式异构体较反式异构体活性强,约强1个数量级。
2.2 4-甲氧羰基芬太尼类化合物1-位结构修饰
芬太尼类化合物哌啶环4-位引入个适当的极性基团能大大增强该类化合物的镇痛活性。如在4位上引入甲氧甲基、苯基、甲氧羰基,乙酰氧基等。最令人兴奋的是,4位引入甲氧羰基基团的芬太尼类化合物结构类型,是迄今为止所发现的麻醉镇痛强度最强的结构类型,其镇痛活性强度较之4-甲氧甲基对活性有更重要的作用[20]。
研究表明,哌啶环位1-取代基中β位上基团的结构与性质对镇痛活性有显著影响。值得注意的是,一系列取代烯丁基化合物显示了很强的镇痛活性。烯丁基的乙基链上引入甲基,镇痛活性略有降低;而双键上引入甲基或氯原子能保持或增加活性。在该类化合物中,1-β-苯乙基的苯环可以用取代乙烯基替代。当双键与哌啶环环碱性氮原子之间由相隔两个碳原子缩短到相隔一个碳原子时,镇痛活性则显著降低,这与芬太尼系列中1-苄基化合物的活性显著低于1-β-苯乙基化合物相一致。如果1-位取代是烷基链,化合物活性可能与烷基链的长短有关,而且主链为烷基的化合物活性明显低于相应的含烯键化合物。这表明1-β-烯乙基烯键的存在对产生强效镇痛活性有重要作用。其他1-β-取代基为多重键的化合物,其镇痛活性均低于相应1-β-乙烯乙基化合物,活性随重键的极性增大而减弱[21]。

表1 1-位取代-3-甲基芬太尼类化合物结构与活性数据(一)


(续表1)


表2 1-位取代-3-甲基芬太尼类化合物结构与活性数据(二)[16]

表3 1-位取代-3-甲基芬太尼类化合物结构与活性数据(三)[5]

在1-β取代胺基乙基的化合物中,取代基为脂肪烃的化合物未显示出镇痛活性,而取代基为苯基时,特别是N-甲基苯胺基化合物显示出强效活性。显然,在取代芬太尼化合物中,1-位侧链位置存在适宜活性基团对产生强效麻醉活性是必须的[23]。当苯胺基为其电子等排体的苯氧基取代,镇痛活性显著降低其原因是由于氮原子与氧原子之间的电性差异,还是由于苯环在空间的排布不同,有待探讨。1-β-苯乙基的苯环以某些芳、杂或脂环取代仍能保持强效镇痛活性[21]。
如果在4-甲氧羰基芬太尼化合物1-位苯环的对位引入某些烷化基团后,尽管仍然保持其吗啡样镇痛活性,但其镇痛强度远远低于4-甲氧羰基芬太尼本身,这说明一位苯环位置上的取代基的空间效应对镇痛活性有较大影响[22],见表4。

表4 1-位取代-4-甲氧羰基芬太尼类化合物结构与活性数据[21]


(续表4)

表5 1-位取代-3-甲基-4-甲氧羰基芬太尼类化合物结构与活性数据[22]

从表4可以看出,哌啶环1-位N上β亚甲基上直接连接烯烃、取代烯烃、芳香基(六元或五元环)活性较高,比3-甲基芬太尼类化合物高,其活性基团强弱程度几乎与3-甲基芬太尼类化合物相一致。
2.3 3-甲基-4-甲氧羰基芬太尼类化合物1-位结构修饰
3-甲基4-甲氧羰基芬太尼类化合物是一类镇痛活性强度与3-甲基芬太尼类和4-甲氧羰基芬太尼类相当的强效麻醉性镇痛剂。比较一组1-位取代基相同的3-甲基4-甲氧羰基基芬太尼类、3-甲基芬太尼类和4-甲氧羰基芬太尼类化合物的镇痛活性,发现前者的构效关系更类似于3-甲基芬太尼类。二者1-位上的苯乙基被取代烯丁基替代后镇痛活性明显降低,而被2-羟基-2-苯乙基替代后活性提高[24],见表5。
表5数据表明,3-甲基-4-甲氧羰基芬太尼类化合物与4-甲氧羰基芬太尼类化合物相比,镇痛活性并没有提高。其顺式异构体的活性与4-甲氧羰基芬太尼类化合物相当,而反式异构体的活性则与3-甲基芬太尼类化合物相当。
3 芬太尼类似物的高效活性基团总结
根据上述几个表的数据,我们对芬太尼类似物的取代基高效活性基团做了初步总结(图5):

图5 芬太尼类活性化合物的基本架构
下面是已经合成过并具有高镇痛的基团:
R1=、、、、、、、、、、、、、、、、等;R2= H、-CH3;R3=、、-CH2OCH3、、等;R4=-CH2CH3、-CH2=CH2、-CHFCH3、、、、、等;R5=、、、、、、、等。
半个世纪以来,人们对芬太尼类化合物进行了构效关系和结构修饰研究,合成了大量的具有高活性的物质,一般认为具有高活性的化合物应具备如下结构:①1-位哌啶环上的氮原子和4-位酰胺上的酰基是镇痛活性所必需的。②R1基团必须是不饱和基团或具有π电子云结构的负电荷中心基团:芳香基、取代烯或环烯基、酰基等基团,其中R1和哌啶环之间必须具有2个亚甲基,多于或少于两个亚甲基活性降低,同时α位亚甲基如果连接非氢以外的其他基团活性也减低。③R2为氢原子或甲基,乙基或体积更大基团活性降低。④R3为甲氧羰基、乙酰基、甲氧甲基、乙酰氧基、芳香基等基团,基团体积增大,活性降低;其中甲氧羰基活性最高,甲氧甲基活性最低,但甲氧甲基安全比最大。⑤R4为丙基、丙烯基、环丙基及其他的卤代酰基、噻吩基、呋喃基等,基团体积过小(如H、乙基等)或者过大都会使活性降低;其中环丙基活性最高,但安全性最小。⑥R5为芳香基团或具有一定刚性结构的小分子不饱和基团,对结构起到支撑作用。⑦R3为氢,R2为甲基时,活性大大增加;当R2为氢,R3为甲氧羰基时,活性也大大增加;当R2为甲基,R3为甲氧甲基时活性与其中一个基团为氢时相当。R2为甲基,R3为氢或者甲氧羰基时,化合物有旋光异构和顺反异构现象,其中,顺式结构活性高于反式结构的活性。
[1] 尤启东. 药物化学[M]. 2版.北京:化学工业出版社,2008.
[2] 郭宗儒,文升,李安良.药物化学[M].2版.北京:高等教育出版社,2005.
[3] 文升,李安良. 药物化学[M]. 北京:高等教育出版社,1999.
[4] Janssen PAJ. A review of the chemical features associated with strong morphine - like activity[J].Bri J Anaesth,1962,34(4): 260-268.
[5] 朱友成,方苏南.强效镇痛剂研究——3-甲基芬太尼类衍生物的合成及镇痛活性[J].药学学报,1981,16(2):97.
[6] Riley TN,Hale DB,Wilson MC. 4-Anilinopiperidine analgesics l.Synthesis and analgesic activity of certain ring methylated 4-propananilido-piperdines[J]. J Pharm Sci,1973,62(8): 983.
[7] Van Bever WF,Niemegeers CJ,Janssen PA. Synthetic analgesics Synthesis and pharmacology of the diastereoisomers of N-[3-methyl-1-(2-phenylethyl)-4-piperldyl]-N-phenylpropanamide and N-[3-methyl-1-(1-methyl-2 -phenyethyl)-4-piperidyl]-N-phenylpropanamide[J]. J Med Chem,1974,17(10):1047-1051.
[8] Van Dacle PG,De Bruyn MF,Boey JM,et al. Synthetic analgesics:N-(1-[2-arylethyl]-4-substituted-4-pi;eridinyl)- N-arylakan -amides[J]. Arzneimittelforschung,1976,26(8): 1521-1531.
[9] 陈常英,李玉林,等.芬太尼类化合物中4-位取代基作用的研究[J].物理化学学报,1990,6(1):17-22.
[10] 嵇汝运.神经系统药物化学[M]. 北京:科学出版社,1965.
[11] Van Bever WF,Niemegeer CJ,Schellkens KH,et al. N-4-substituted 1-(2-aryl-ethyl)-4-piperidinyl-N-phenylpropanamides,a novel series of extremely potent analgesics with unusually high safety margin[J].Arzneimittelforschung,1976,26(8):1548-1551.
[12] 陈常英,黎乐民.3-甲基芬太尼和芬太尼的电子结构与生物活性强度比较研究[J]. 科学通报,1984,29(7):411.
[13] Portoghese PS. Stereoisomeric ligand receptor probes[J]. Acc Chem Res,1978,11(1):21.
[14] Chen CY,Li LM. Structure-activity relationship and the mechanism of analgesia of the analgesic drug 3-methyl fentanyl and its analogs[J].Inlern J Quanlum Chem,1983,23(4): 1597-1608.
[15] 胡建国,李玉林,陈冀胜. 4-取代芬太尼类化合物的晶体结构和构效关系[J]. 药学学报,1987,22(11):864.
[16] 杨玉龙,朱新文.3-甲基芬太尼衍生物的合成极其麻醉活性[J].中国药科大学学报,1993,24(5):257-263.
[17] 翁坚慧,徐修容,朱有成,等.3-甲基芬太尼衍生物构效关系及受体结合特征研究[J].药学学报,1990,25(3):178-185.
[18] Chi ZQ. Studies on the action of 3-methyl fentanyl derivatives on the opiate receptors[J].US-Chin Pharmacol Symposium,1979:253-287.
[19] 朱国政,李云祥,颜松民.3-甲基芬太尼衍生物的合成及镇痛活性[J].药学学报,1990,25(11):811-814.
[20] 杨玉龙 ,卢志英.4-甲氧甲基芬太尼类似物的合成极其镇痛活性[J].药学学报,1991,26(7):493-498.
[21] 杨玉龙,朱新文,朱国政,等.4-甲氧羰基-4-N-丙酰苯胺基哌啶1位衍生物的合成及其镇痛作用[J].药学学报,1990,25(4):253-259.
[22] 易毛,朱国政,李建国,等.4-甲氧羰基芬太尼1-位衍生物的合成及生物活性[J].药学学报,1992,27(10):734-737.
[23] 杨玉龙,宋炳生,朱新文,等.一些4位取代芬太尼衍生物对小鼠的麻醉活性[J].华西药学杂志,1998,13(2):80-82.
[24] 温素姐,杨玉龙, 邵华宙,等.3-甲基-4-甲氧羰基芬太尼类似物的合成与镇痛活性[J].中国药科大学学报,1992,23(4):196-202.
[25] 刘小利,王陆瑶,胡文祥.μ阿片受体的三维结构预测及活性位点分析[J]. 化学通报,2009,72(2): 133-137.
[26] Wang L,Hu WX,Liu XLl. The modeling of three-dimensional structure of human μ-opioid receptor and the study of molecular docking of fentanyl analogs[J]. Comput Applied Chemy,2009,26(6):746-750.

