白色噬琼胶菌QM38β-琼胶酶基因agaD02的克隆与表达
王 静, 马吉飞 , 苗婷婷, 李兆杰, 杜宗军
(1. 威海出入境检验检疫局, 山东 威海 264200; 2. 山东大学 威海分校 海洋学院, 山东 威海 264209)
白色噬琼胶菌QM38β-琼胶酶基因agaD02的克隆与表达
王 静1, 马吉飞2, 苗婷婷2, 李兆杰1, 杜宗军2
(1. 威海出入境检验检疫局, 山东 威海 264200; 2. 山东大学 威海分校 海洋学院, 山东 威海 264209)
从白色噬琼胶菌(Agarivorans albus) QM38基因组中扩增到一段编码β-琼胶酶的DNA序列, 命名为agaD02。序列相似性分析的结果表明, 基因agaD02和弧菌Vibrio sp. JT0107 及Vibrio sp. PO-303的琼胶酶基因具有同源性, 其相似性程度分别为98.7%和97.4%, 而同GenBank中的其他序列同源性很低。对此基因的序列进行了分析, 结果表明, 其开放阅读框长度为2 868 bp, 编码的蛋白质包含955个氨基酸, 在蛋白数据库中的编号为ABM90422, 推测其分子质量为106 ku, 等电点为4.87。利用网上数据库资源和生物学软件对预测的琼胶酶蛋白序列进行了同源性分析和结构分析。设计两端含酶切位点的特定引物, 克隆agaD02基因, 构建入表达载体pET24a(+), 转化大肠杆菌BL21(DE3), 转化后提取质粒进行酶切和电泳验证, 转化后的大肠杆菌经诱导可产生胞外琼胶酶。
琼胶酶; 白色噬琼胶菌(Agarivorans albus); 克隆; 序列分析; 表达
琼胶(琼脂)主要是由石花菜、江蓠等红藻提取出来的一种多糖, 和卡拉胶、褐藻胶是目前世界上用途最广泛的3种海藻胶。琼胶酶能够水解琼胶多糖, 在这些海藻的单细胞分离、酶解破壁制备原生质体等过程中具有重要的使用价值, 是一种海藻遗传工程的工具酶; 同时, 琼胶酶在分子生物学方面也多有应用[1]。 根据琼胶酶降解琼脂糖的作用方式不同, 可以把它们分为两类[2,3]: α-琼胶酶(EC3.2.1.-),作用于琼脂糖的 α(1→3)糖苷键, 产物为琼寡糖(agarooligosaccharides); β-琼胶酶(EC3.2.1.81)水解 D-半乳糖残基和3,6-内醚-α-L-半乳糖残基之间的β(1→4)糖苷键, 产物为新琼寡糖(neoagarooligosaccharades)。在对琼胶寡糖的研究中发现, 这些寡糖具有多种生理活性, 一定分子量的降解产物具有抗炎、抗病毒、增强免疫等作用。新近的研究结果表明, 新琼寡糖具有益生作用, 无论在体内或者体外的厌氧环境下, 都能够显著促进双歧杆菌(bifidobacteria)和乳酸杆菌(lactobacilli)的生长[4]。
自从Gran于1902年首先报导了能够降解琼胶的细菌以后, 研究者们已经分离纯化出了多种海洋细菌产生的琼胶酶, 并对其酶学性质进行了研究。1993年, Sugano等[2]提纯了弧菌(Vibrio sp. JT0107)的胞外琼胶酶。1998年, Toshiyoshi等[5]对弧菌Vibrio sp. Strain PO-303所产生的琼胶酶系进行了系统的分离, 发现这个菌株能够产生 4种胞外的琼胶酶组分。随着分子生物学技术的发展和对海洋微生物研究的重视, 海藻多糖降解酶的研究蓬勃兴起,多种海藻多糖降解酶得到分离纯化, 其基因得到了克隆、测序和表达。1993年, Sugano等[6]从弧菌JT0107的基因组克隆了agaA基因。Ohta等[7]对来源于Agarivorans sp.JAMB-A11中的一种 β-琼胶酶在枯草杆菌中进行了重组表达。 Dong等[8,9]克隆了弧菌Vibrio sp. Strain PO-303的agaA基因和agaC基因。2007年, Dong等[10]克隆了Vibrio sp. PO-303琼胶酶AgaD的基因并且在大肠杆菌中将此琼胶酶进行了表达。
作者近年来对山东近海产琼胶酶的海洋细菌进行了系统的分离, 其中菌株 QM38产生的胞外琼胶酶活力很高, 16S rDNA 序列分析表明, 此菌为白色噬琼胶菌(Agarivorans albus)[11]。白色噬琼胶菌是日本学者2004年首先分离鉴定的新属新种[12]。作者报道了白色噬琼胶菌(Agarivorans albus)QM38一条编码 β-琼胶酶的基因 agaD02的克隆、序列分析和表达。
1 材料与方法
1.1 菌株与质粒
白色噬琼胶菌 (Agarivorans albus) QM38 由本实验室分离保存; 质粒pMD19-T Simple购于宝生物工程(大连)有限公司。
1.2 主要试剂
UNIQ-10 柱式细菌基因组 DNA抽提试剂盒购自上海生工生物工程有限公司; DNA Marker、Taq 酶、LA Taq DNA聚合酶、PCR缓冲液、dNTP、BamH I、Hind III、Aat Ⅱ、DNA 凝胶回收试剂盒、质粒提取试剂盒购于宝生物工程(大连)有限公司。
1.3 培养基
白色噬琼胶菌(Agarivorans albus) QM38的培养采用海洋细菌 2216培养基; 大肠杆菌培养基为 LB培养基; 含重组质粒(pMD19)的大肠杆菌培养基添加氨卞青霉素(100 mg/L); 含重组质粒(pET24a)的大肠杆菌培养基添加卡那霉素(30 mg/L)。
1.4 细菌DNA的提取
细菌接种液体培养基, 28℃振荡培养24 h, 取适当菌液, 放入微量离心管中, 离心得到菌体, 按照细菌基因组DNA提取试剂盒的操作说明进行。
1.5 白色噬琼胶菌QM38 agaD02基因的克隆与序列测定
1.5.1 PCR引物[13]
根据 GenBank中的细菌 Vibrio sp.琼胶酶 agaB的基因序列(序列收录号 D21202), 设计了一对引物,交由上海生工生物工程有限公司合成。其序列如下:
正向引物 QM38-3a: 5′-CCACTTAGCACTAGAGCCCGTAA- 3′
反向引物 QM38-3b: 5′-TGTACCTAGCAGATTGCACTCCC-3′
1.5.2 PCR反应条件
利用引物QM38-3a 和QM38-3b进行PCR扩增的条件是: 在 100 µL的 PCR 反应体系中含有:1×PCR 缓冲液, 1.5 mmol/L MgC12, 4×dNTP 混合物各 200 µmol/L, 引物各 0.5 µmol/L, TaKaRa LA Taq 1 µL(5 U/µL), 2 µLDNA 原液。PCR 反应条件为: 96℃ 预变性 6min; 接 94 ℃ 变性 30 s, 52 ℃复性45 s, 72℃延伸3 min, 30个循环; 最后72 ℃ 温育6 min。
PCR扩增产物经电泳检测后, 直接交由上海生工生物工程技术公司进行纯化和序列测定。
1.6 利用分子生物学软件对 agaD02基因进行分析
利用Primer premier 5.0 软件对agaD02的基因序列进行分析, 将琼胶酶基因的核苷酸序列翻译成氨基酸序列; 利用 DNAStar 软件分析 agaD02基因编码的蛋白质的分子质量与等电点; 通过 http://www.ncbi.nlm.nih.gov/BLAST/ 网站对 agaD02进行序列相似性搜索, 利用网上数据库资源进行 agaD02基因及其表达产物的结构分析。
1.7 琼胶酶agaD02基因的克隆与表达
1.7.1 引物设计
根据琼胶酶agaD02基因的序列, 设计出一对引物。上游引物添加BamH I酶切位点, 下游引物添加Hind III酶切位点。下游引物不包括终止密码子, 因为载体质粒上有终止密码子。
上游引物 BD02-F: 5′-GGATCCATGGTAGAAGTTATGAAATTTA-3′
下游引物 BD02-R: 5′-AAGCTTTTTTTTGTAACGAAGCATGT-3′
1.7.2 PCR扩增
PCR条件同 1.5.2, 获得的 PCR产物纯化后与pMD19-T Simple载体连接, 得到重组质粒, 并进行测序分析。
1.7.3 表达质粒的构建和转化
将上述重组质粒, 用 BamH I/Hind Ⅲ进行双酶切后, 电泳, 切胶回收纯化, 得到琼胶酶基因agaD02的DNA。利用连接试剂盒中的Ligation Mix将酶切好的质粒pET24a和琼胶酶agaD02基因进行连接后, 热转化至 E.coli BL21中, 涂布于含卡那霉素30 mg/L的LB培养平皿中, 于37 ℃培养过夜。
1.7.4 pET24a- agaD02表达质粒的鉴定
挑取转化菌单菌落, 培养, 保存菌种, 提取表达质粒, 利用PCR的方法进行鉴定。对PCR鉴定过的质粒以BamH I/Hind Ⅲ双酶切鉴定。将经过鉴定的质粒转化至BL21宿主细胞中, 筛选阳性克隆。
1.7.5 琼胶酶AgaD02的诱导表达
从新鲜的划线平板中挑取单克隆, 接入 2 mL含有适当抗生素的 LB 培养基中, 37 ℃振荡过夜培养, 取1 mL培养液l接种入50 mL 新鲜培养基, 37℃摇床培养至A600nm到0.4~1。加入IPTG 储液至终浓度1 mmol/L, 继续培养2~3 h。然后, 取一滴培养液置于LB固体平板上, 37 ℃过夜培养, 取出后用碘液染色, 定性观察是否有琼胶酶产生。
2 实验结果
2.1 细菌QM38琼胶酶基因的PCR扩增
利用上海生工 UNIQ-10 柱式细菌基因组 DNA抽提试剂盒提取细菌Agarivorans albusQM38基因组DNA, 利用引物QM38-3a和QM38-3b, 以基因组DNA为模板, 进行PCR扩增, 扩增产物经电泳检测,得到一条长约300 0 bp的片段, 如图1所示。
将 PCR产物送上海生工生物工程公司测序, 得到的序列长度为 3029bp, 将此序列输入 GenBank,获得收录号为EF199908。将此基因命名为agaD02。
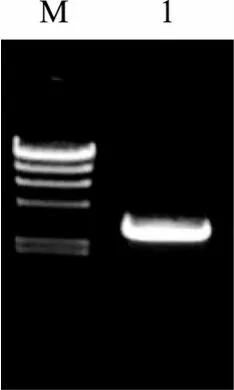
图1 白色噬琼胶菌QM38基因组进行琼胶酶基因的PCR扩增产物电泳图Fig. 1 PCR amplification of the agarase gene from Agarivorans albus QM38M. λ-Hind Ⅲ DNA Marker 大小分别为: 23 130, 9 416, 6 557, 4 361,2 322, 2 027, 564和125 bp; 1. QM38琼胶酶基因agaD02的PCR结果M. λ-Hind Ⅲ DNA Marker: 23 130, 9 416, 6 557, 4 361, 2 322, 2 027,564, 125 bp; 1. Electrophoresis of PCR resulth of agarase gene agaD02
2.2 白色噬琼胶菌 QM38琼胶酶基因agaD02的序列分析
利用生物软件和网上数据库资源对得到的序列进行了分析, 结果如下。
通过对细菌QM38的琼胶酶基因agaD02进行序列相似性比较, 在 GenBank数据库中, 只有两条序列与 EF199908有相似性[13], 一条是弧菌Vibriosp.JT0107编码 β-琼胶酶的agaB基因, 这两条基因相似性有98.8%; 另外一条是弧菌Vibriosp. PO-303编码琼胶酶的agaE基因, 相似性为 97.4%, 而和数据库中其他的琼胶酶基因相似性很低。从GenBank数据库中调取相关菌株的琼胶酶基因序列, 和白色噬琼胶菌 QM38的琼胶酶基因agaD02一起, 利用Mega (4.1)软件构建系统发育树, 见图2。
由测序结果可知, 白色噬琼胶菌agaD02基因序列包含有一个286 8 bp的读码框架, 对此基因进行分析发现,agaD02基因编码的蛋白质包含955个氨基酸, 命名为 AgaD02, 在蛋白质数据库中的编号为ABM90422, 此蛋白由955个氨基酸组成, 预测其分子质量为106 ku, 其等电点为4.87。通过http://www.cbs.dtu.dk/services/SignalP/ 网站对其信号肽结构进行分析, 结果显示, 在此蛋白的N末端, 存在一段信号肽序列, 最可能的位置是第1~35个氨基酸残基。登录 http://www.ebi.ac.uk/interpro/, 利 用 Interpro Scan对其进行蛋白质家族的分析。结果显示, 由于同源结构信息太少, 仅能推测琼胶酶AgaD02蛋白N末端存在信号肽序列。
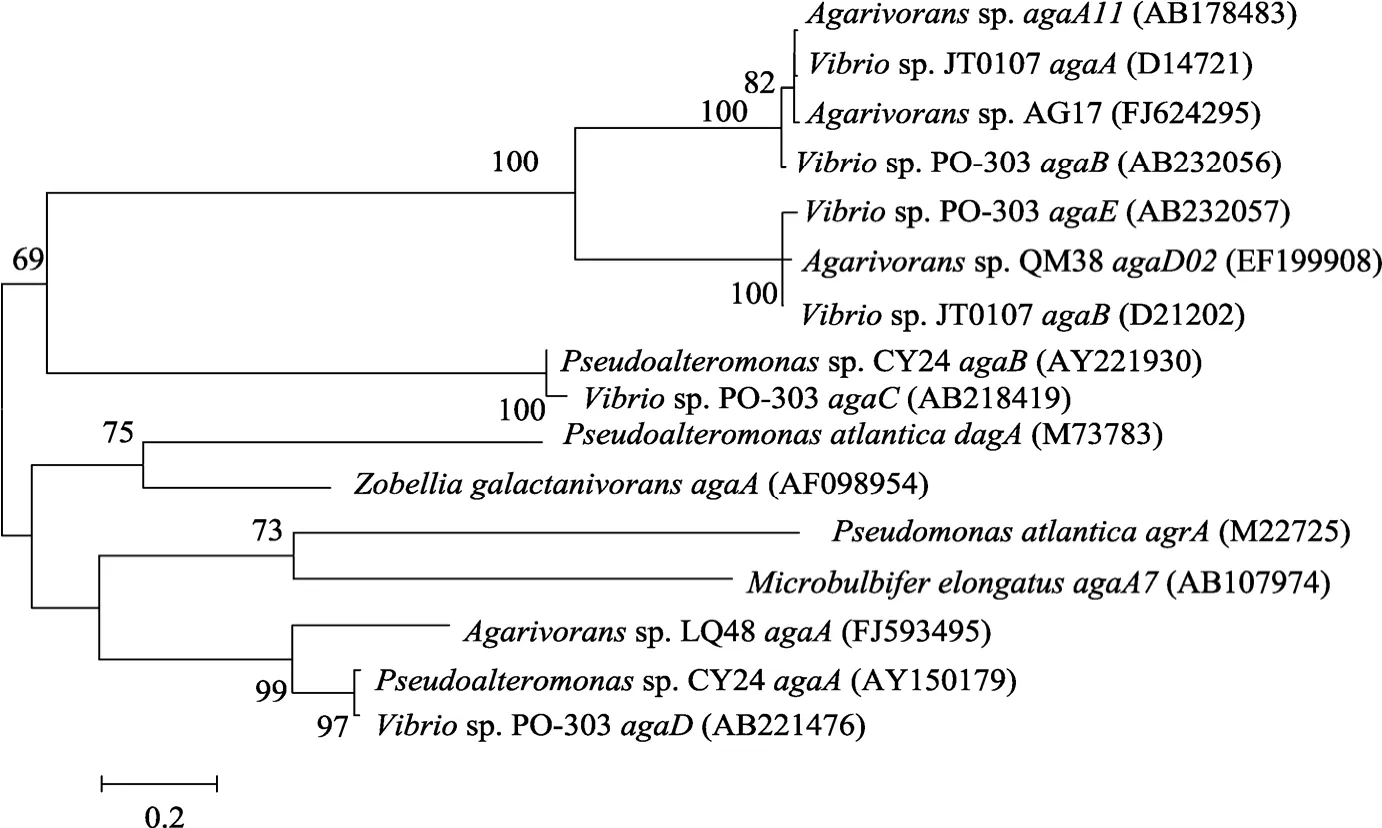
图2 白色噬琼胶菌QM38及相关菌株琼胶酶基因的系统发育分析Fig. 2 Phylogeny tree of agarase genes from Agarivorans albus QM38 and other related strains
对细菌QM38的琼胶酶基因agaD02编码的蛋白质三维结构进行了初步分析, 登录同源模建网站http://swissmodel.expasy.org//SWISS-MODEL.html,利用First Approach Mode方法进行模建。结果显示未发现模板, 即相关酶类还没有建立三维结构。
通过以上对于agaD02基因以及其编码的蛋白质AgaD02的研究, 可以看出, 这条基因是比较独特的编码琼胶酶的基因。它所编码的琼胶酶, 是一个新的蛋白, 对它的结构和功能的研究很少, 如果能进行结构与功能的研究, 得到其催化特性, 将能够获得许多新的数据与材料。
2.3 QM38琼胶酶基因的PCR扩增、克隆与重组质粒的提取鉴定
使用前述设计的表达引物, 以细菌 QM38基因组DNA为模板进行PCR扩增, 发现有一条扩增片段,大小符合预期。将PCR回收产物与pMD19-T simple连接, 热转化至Escherichia coliJM109中, 涂布平板过夜培养菌体。挑取两个阳性克隆菌体, 提取质粒进行电泳检测。对两个阳性克隆质粒 BD02-pMD19-1和 BD02-pMD19-2进行测序, 结果表明,BD02-pMD19- 1质粒在agaD02基因开放阅读框的第541和2827处发生点突变, 都是A突变为G。这将导致编码的蛋白质的第181位和第 943位的两个赖氨酸变为谷氨酸。BD02-pMD19-2质粒序列正常,可以用于下一步的亚克隆。
2.4 重组表达载体的建立、转化与表达质粒的鉴定
BD02-pMD19-2质粒经过双酶切, 回收以后, 与酶切好的pET24a(+)载体连接, 然后, 连接液转化E.coliBL21, 涂布于含卡那霉素30 mg/L的LB培养平皿中, 37℃培养箱恒温过夜培养。随机挑取转化菌单菌落, 培养, 提取表达质粒, 利用 PCR的方法进行鉴定。取PCR反应阳性的两个质粒以BamH I/HindⅢ双酶切鉴定, 进行琼脂糖凝胶电泳验证(图 3)。将经过鉴定的质粒转化至BL21宿主细胞中, 筛选阳性克隆。
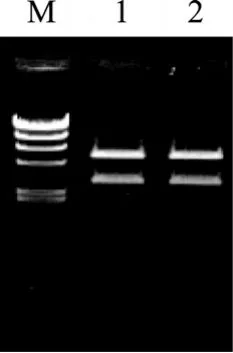
图3 pET24a- agaD02重组载体的BamH I/Hind Ⅲ双酶切电泳鉴定结果Fig. 3 Recombinant vector pET24a- agaD02 digested by BamH I/Hind ⅢM. λ-Hind Ⅲ DNA Marker 大小分别为 23 130, 9 416, 6 557, 4 361,2 322, 2 027, 564和125 bp; 1, 2. pET24a- agaD02表达质粒样本的双酶切M. λ-Hind Ⅲ DNA Marker: 23 130, 9 416, 6 557, 4 361, 2 322, 2 027, 564, 125 bp; 1, 2. Electrophoresis of recombinant plasmids PET24a-agaD02 digested with restriction enzymes
2.5 琼胶酶AgaD02的诱导表达
构建好的表达菌株BD02, 经过IPTG诱导以后,在培养液中能够检测到胞外的琼胶酶活性。培养平板用碘液染色观察[14], 可以观察到透明水解圈(图 4),证明表达成功。
3 讨论
由于琼胶酶及其降解产物具有很重要的应用价值, 近年来关于琼胶酶的研究工作也越来越多, 新的酶蛋白不断被分离, 新的基因也不断被克隆得到。Sugano 等[2]对弧菌 JT0107产生的琼胶酶系进行了系统的研究, 随后, 他们克隆到这个琼胶酶的基因agaA, 并且在大肠杆菌中进行了表达[6]。1994年,Sugano 等[13]从弧菌JT0107的基因组DNA克隆到另外一条编码琼胶酶的基因(agaB), 它编码一个由955个氨基酸组成的琼胶酶。另外一株弧菌, Vibrio sp.PO-303, 近年来也得到了系统的研究[8~10]。

图4 含有pET24a- agaD02表达质粒的大肠杆菌分泌出胞外琼胶酶Fig. 4 Agarase expressed in E. coli BL21 were detected by staining the plate with Lugol’s solution
噬琼胶菌属 (Agarivorans) 是 2004年建立的新属, 目前这个属只有白色噬琼胶菌1个种, 这个种最显著的表型特征是能够降解琼胶和产生白色色素。2005年, Ohta等[7]从 Agarivorans sp. JAMB-A11基因组中克隆到一条编码 β-琼胶酶的基因, 并且在枯草芽孢杆菌中进行了表达。这条基因有298 8 bp, 编码的蛋白由995个氨基酸构成, 理论分子质量为107 ku, 其核酸序列与弧菌JT0107的agaA基因有98.6%的相似性。
根据既有的研究经验, 一株细菌往往具有编码多个琼胶酶的基因序列。作者根据弧菌 JT0107的agaB基因设计引物, 成功地在 Agarivorans albus QM38细菌中克隆到 agaD02基因, 构建表达载体,实现agaD02基因在大肠杆菌中的表达。这个基因的成功表达, 对于这种琼胶酶的分离纯化以及大规模生产, 对酶蛋白的结构与功能的研究都会有推动作用。
[1] 杜宗军, 王祥红, 李筠, 等. 琼胶酶研究进展[J]. 微生物学通报, 2003, 30(1): 64-67.
[2] Sugano Y, Terada I, Arita M, et al. Purification and characterization of a new agarase from a marine bacterium, Vibrio sp. strain JT0107[J]. Applied and Environmental Microbiology, 1993, 59(5): 1 549-1 554.
[3] Duckworth M, Turvey J R. The specificity of an agarase from a Cytophage species[J]. Biochem J, 1969,113: 693-697.
[4] Hu B, Gong Q H, Wang Y, et al. Prebiotic effects of neoagaro-oligosaccharides prepared by enzymatic hydrolysis of agarose[J]. Anaerobe, 2006, 12: 260-266.[5] Toshiyoshi A, Michio H, Zhang L, et al. Purification and characterization of agarases from a marine bacterium, Vibrio sp. PO-303[J]. J Mar Biotechnol, 1998, 6:260-265.
[6] Sugano Y, Matsumoto T, Kodama H, et al. Cloning and sequencing of agaA, a unique agarase 0107 gene from a marine bacterium, Vibrio sp. strain JT0107[J]. Applied and Environmental Microbiology, 1993, 59(11):3 750-3 756.
[7] Ohta Y, Hatada Y, Ito S, et al. High-level expression of a neoagarobiose-producing beta-agarase gene from Agarivorans sp. JAMB-A1l in Bacillus subtilis and enzymatic properties of the recombinant enzyme[J].Biotechnol Appl Biochem, 2005, 41: 183-191.
[8] Dong J, Hashikawa S, Konishi T, et al. Cloning of the novel gene encoding beta-agarase C from a marine bacterium, Vibrio sp. strain PO-303, and characterization of the gene product[J]. Appl Environ Microbiol,2006, 72(9): 6 399-6 401.
[9] Dong J, Tamaru Y, Araki T. A unique beta-agarase,agaA, from a marine bacterium, Vibrio sp. strain PO-303[J]. Appl Microbiol Biotechnol, 2007, 74 (6):1 248-1 255.
[10] Dong J, Yutaka T, Toshiyoshi A. Molecular cloning,expression and characterization of a beta-agarase gene,agaD, from a marine bacterium, Vibrio sp. strain PO-303[J]. Biosci Biotechnol Biochem, 2007, 71(1):38-46.
[11] 杜宗军, 赵苑, 李美菊, 等. 青岛近海琼胶降解细菌的筛选和多样性分析[J]. 中国海洋大学学报, 2007,37(2): 277-282.
[12] Kurahashi M, Yokota A. Agarivorans albus gen. nov.,sp. nov., a γ-proteobacterium isolated from marine animals[J]. Int J Syst Evol Microbiol, 2004, 54: 693-697.
[13] Sugano Y, Matsumoto T, Noma M. Sequence analysis of the agaB gene encoding a new beta-agarase from Vibrio sp. strain JT0107[J]. Biochim Biophys Acta,1994, 1218(1): 105-108.
[14] 杜宗军, 王鹏, 李筠, 等. 两株琼胶酶高产细菌的筛选和鉴定[J]. 海洋科学, 2002, 26(3): 1-4.
Cloning and expression of the beta-agarase gene agaD02 from Agarivorans albus QM38
WANG Jing1, MA Ji-fei2, MIAO Ting-ting2, LI Zhao-jie1, DU Zong-jun2
(1. Weihai Entry-Exit Inspection And Quarantine Bureau, Weihai 264200, China; 2. College of Marine Science,Shandong University at Weihai, Weihai 264209, China)
Feb., 12, 2010
aragase; Agarivorans albus; clone; sequence analysis; expression
The β-agarase gene, agaD02, was amplified by PCR using genomic DNA of Agarivorans albus strain QM38 as a template. The agaD02 gene consists of an open reading frame of 2868 bp encoding β-agarase, a protein of 955 amino acids and a molecular weight of 106 kD. The PI of the agarase is 4.87. The accession numbers for agaD02 in GenBank was EF199908. We found that the agaD02 gene shared 98.7% sequence identity to the agaB gene of Vibrio sp.JT0107 and 97.4% identity to the agaE gene of Vibrio sp. PO-303. The deduced amino acid sequence of the agaD02 gene was compared with entries in the DDBJ database. According to the sequence of agaD02 gene, a pair of primers were designed and synthesized. After PCR amplification, the product was cloned into pMD19-T simple vector using TA cloning. The recombinants were sequenced and identified by restrictive endonuclease digestion. The target gene sequences were then subcloned into a highly efficient eukaryotic expression vector pET24a(+).After confirmation by double restrictive endonuclease digestion, the expression vectors were transformed into E. coli BL21(DE3). The recombinants E. coli BL21 (pET24a-agaD02) were induced by IPTG on Petri dish and were stained with Lugol iodide solution after being cultured for 24 h at 37℃. A clear zone was observed around the colony of the recombinants E. coli, confirming that the pET24a-agaD02 expression vectors were successfully constructed.
Q936
A
1000-3096(2010)08-0006-05
2010-02-12;
2010-06-03
山东省自然科学基金项目 (ZR2009EQ009); 国家海洋局海洋生物活性物质与现代分析技术重点实验室开放基金项目(MBSMAT-2009-07);山东大学自主创新基金资助
王静 (1975-), 女, 山东威海人, 工程师, 从事海洋生物学研究, E-mail: wangjing7548@sohu.com; 杜宗军, 通信作者, 博士,副教授, E-mail: duzongjun@yahoo.com
(本文编辑: 梁德海)

