动态高压微射流技术对可溶性大豆多糖结构的影响
章文琴,刘成梅,*,刘 伟,万 婕
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2. 南昌大学中德食品工程中心,江西 南昌 330047)
动态高压微射流技术对可溶性大豆多糖结构的影响
章文琴1,2,刘成梅1,2,*,刘 伟1,2,万 婕1,2
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2. 南昌大学中德食品工程中心,江西 南昌 330047)
研究动态高压微射流技术(DHPM)处理对可溶性大豆多糖(SSPS)组分、相对分子质量、外观形态及单糖组成的影响。结果表明:经DEAE-Cellulose离子交换从大豆粗糖中纯化得到SSPS-1和SSPS-2两个组分,高效凝胶渗透色谱(HPGPC)分析表明SSPS-1为含少量蛋白的杂多糖,SSPS-2为高结合蛋白含量的单一多糖;SSPS-1经DHPM处理后,相对分子质量由7.33×105减少至5.11×105;电镜扫描观察其形貌由针状排列结构变成末端膨大呈球形的“火柴棒”状有序排列结构;气相色谱分析单糖组成表明:SSPS-1主链中单糖L-鼠李糖和D-半乳糖醛酸的含量分别降低9.4%、17.1%,侧链部分的单糖L-阿拉伯糖、D-半乳糖、D-岩藻糖、 甘露糖分别降低14.3%、26.3%、41.7%、60%,而D-木糖、D-葡萄糖、葡萄糖醛酸未检出。
动态超高压微射流;可溶性大豆多糖;组分;相对分子质量;形貌
可溶性大豆多糖(SSPS)是从大豆子叶中提取得到的 商业食品添加剂[1],具有高溶解性,pH值稳定性,低黏度以及优良的乳化特性[2]。SSPS不仅作为膳食纤维来源之一用于强化食品、医药和工业行业中,还作为一种功能性添加剂应用于食品中,比如在酸奶中用于稳定剂[3-4]。
可溶性大豆多糖的提取方法主要有高温水提法、酸碱法和酶法等。如Kawamura等[5]采用碱法从大豆中提取SSPS;Morita等[6]采用高温热提取法;Furuta等[7]采取了酸法提取;Huisman等[8]采用了半纤维素酶、鼠李糖酶及果胶酶提取SSPS。SSPS是一种酸性多糖,结构类似于果胶,含有同型多糖和异型多糖,分子量范围在5×103~1×106D之间[9]。Nakamura等[10]分析了可溶性大豆多糖的分子组成,SSPS主要由D-半乳糖、L-阿拉伯糖、D-半乳糖醛酸及L-鼠李糖组成。
通过对天然多糖进行结构修饰可改善其生理功能与理化特性,其中不乏通过物理方法降解多糖以达到改性目的的报道[11]。Tabata等[12]采用超声波法降解多糖,证实超声波降解只引起糖苷键的断裂而不会改变葡聚糖的化学结构。Zhang等[13]采用超声波降解水溶性大豆多糖,多糖的相对分子质量降低。Yang等[14]报道了龙眼多糖经超声波处理后可提高其自由基清除能力;Yang等[15]报道采用超高压技术对龙眼多糖处理后不会对其结构产生影响。
动态高压微射流技术(dynamic high pressure microfluidization,DHPM)是一种新兴的物理处理手段,其工作原理是通过高速碰撞、高频振荡、瞬时压降、强烈剪切、气穴作用等作用实现对物料的改性,可产生高达200MPa的压力,且处理时间短(<5s)、并能实现连续性操作,甚至改变大分子的结构[16-18]。本课题组在前期工作中研究表明大豆膳食纤维经其处理后,其可溶性膳食纤维含量得到了显著提高[19-21],Furuta等[7]研究表明可溶性酸性大豆多糖是大豆可溶性膳食纤维的主要成分,但目前对可溶性大豆多糖处理前后的组分、结构变化不清楚,限制了DHPM对大豆多糖改性机理的研究。
本实验以SSPS为研究对象,讨论处理后SSPS的组分、外观形态、分子量及单糖组分的变化,以期为DHPM对SSPS的作用机理提供有用信息。
1 材料与方法
1.1 材料与试剂
75-1型大豆 江西省南昌市种子公司。透析袋(截留分子量3500D) 上海日初生物科技有限公司;超纯水(Milli-Q50超纯水仪制得)。
L-鼠李糖(L-Rha)、D-岩藻糖(D-Fuc)、L-阿拉伯糖(L-Ara)、D-木糖(D-Xyl)、甘露糖(Man)、D-葡萄糖(D-Glc)、D-半乳糖(D-Gal)、葡萄糖醛酸(GlcA)、D-半乳糖醛酸(D-GalA) 德国Merck公司及Sigma公司;氢氧化钠(5 0%)、甲醇、己烷、肌醇、羟胺盐酸、醋酸酐、吡啶、三氟乙酸(TFA) 上海化学试剂公司;葡聚糖标准品(T-2000、T-500、T-150、T-100、T-70、T-40、T-10) Sigma公司;DEAE纤维素阴离子交换树脂Sephadex G-75 Pharmacia公司;其余试剂均为国产分析纯。
1.2 仪器与设备
M-700型微射流均质机 美国Microfluidics公司;UV-2450紫外分光光度计 日本岛津公司;SBS-100数控计滴自动部分收集器 上海沪西分析仪器厂;高效液相色谱仪 美国Waters公司;GC6890型气相色谱仪 美国安捷伦公司;S-570电子扫描电镜 日本日立公司。
1.3 方法
1.3.1 SSPS的提取与分离
根据Morita[6]的SSPS热提法,稍作修改,具体流程如图1所示。利用DEAE-Cellulose离子交换柱分离粗多糖,测定各管A620nm(蒽酮-硫酸法),合并单一峰,得到SSPS-1和SSPS-2两个多糖组分,透析冻干。其中蒽酮硫酸法根据Morris[22]多糖测定法进行。

图1 可溶性大豆多糖提取、纯化工艺流程Fig.1 Extraction and purification of soybean soluble polysaccharides
1.3.2 DHPM对SSPS的处理
将SSPS配成10mg/mL的溶液,采用微射流均质机在150MPa下分别对其处理4次,透析冻干。
1.3.3 SSPS相对分子质量测定
采用高效凝胶渗透色谱法(HPGPC)对SSPS-1及SSPS-2进行纯度及相对分子质量的测定。Waters高效液相色谱(配有UK6进样阀,515泵头,410示差折光检测器,TU-1901UV-VIS型紫外分光检测器)条件为:采用Ultrahydrogel-onliner凝胶柱(7.8mm×300mm);流动相为超纯水;标准品及样品质量浓度均为2mg/mL;进样量20μL,流速为0.6mL/min;柱箱、检测器温度均为30℃。测定葡聚糖标准品,绘制lgMw-tR标准曲线,根据线性回归方程计算样品的相对分子质量。
1.3.4 SSPS电镜分析
参照周林等[23]的方法,将充分干燥精制多糖用蒸发镀膜法制备电镜样品,置于扫描电镜的样品室中扫描分析,用随机工作站进行拍摄,放大倍率600~1500倍,观察多糖表面的形态。
1.3.5 SSPS单糖组成分析
1.3.5.1 SSPS样品完全水解
根据张惟杰[24]酸水解方法,取2mg多糖样品置于安培管中,加入1mol/L的硫酸2mL,真空封管100℃下反应4h,冷却后将BaCO3粉末加入反应液中和至pH7,3000r/min离心5min,取上清液真空干燥至干。
1.3.5.2 乙酰化衍生物制备
根据Chen等[25]制备方法,取2mg样品,加入2mL 2mol/L TFA,密闭,100℃水解6h,减压抽干。在水解产物中加入20mg盐酸羟胺和1mL吡啶,封管于90℃反应30min。冷至室温,再加入1mL乙酸酐,封管于90℃反应30min,冷却后转出上层清液,减压浓缩至干。滴入0.5mL氯仿溶解后进行气相色谱分析。
采用内标法检测,精密称取内标物(L-鼠李糖、D-岩藻糖、L-阿拉伯糖、D-木糖、甘露糖、D-葡萄糖、D-半乳糖、葡萄糖醛酸、D-半乳糖醛酸及肌醇)各20mg,并按上述方法进行乙酰化,氯仿溶解后进行气相分析。
1.3.5.3 色谱条件
GC6890气相色谱仪配有FID检测器,HP-5型毛细管柱(30m×0.32mm,0.25μm),载气为高纯氮气(1.0 mL/min),进样量0.5μL,分流比为19:1;进样口温度:250℃;程序升温过程:180~200℃,6℃/min;200~220℃,3℃/min;220~240℃,3℃/min。
2 结果与分析
2.1 SSPS的分离纯化
大豆经脱脂脱蛋白得到大豆粗多糖,由Sevag法除结合蛋白得到SSPS后进一步纯化。采用DEAE-Cellouse纤维素柱对SSPS进行分级得到洗脱曲线如图2所示。SSPS经Tris-HCl(0.01mol/L)-NaCl(0.1mol/L)洗脱后,得到两个主要多糖组分SSPS-1(20~36管)、SSPS-2(92~100 管)。
通过大豆葡聚糖标准品(T-2000、T-500、T-150、T-100、T-70、T-40、T-10)进行液相分析得到相对分子质量的线性回归方程为:lgMw= -0.2458tR+1.5746,R2=0.9954,以此计算样品多糖相对分子质量。将得到的SSPS-1,SSPS-2分别进行高效液相凝胶色谱分析,得到相对分子质量图谱如图3、4所示。其中,SSPS-1含有5个单峰,经计算可知其相对分子质量分别为7.33×105、2.95×105、2.5×104、6223及1589,蛋白含量9.2%,为含少量蛋白的杂多糖;SSPS-2的相对分子质量为9.15×105,蛋白含量86.7%,为高结合蛋白含量的单一多糖。这一实验所得多糖组分的相对分子质量要大于Furtura等[7]采用高温热水提取法制备的3种SSPS,其主要组分的相对分子质量是5.50×105、2.5×104、5×103。
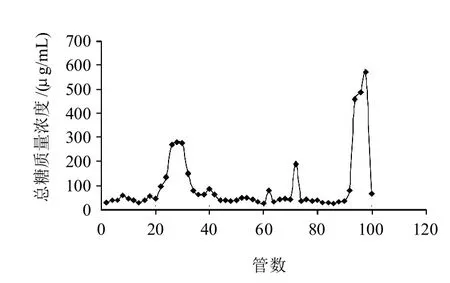
图2 SSPS经纤维柱纯化后得到两个峰SSPS-1、SSPS-2Fig.2 Purified SSPS-1 and SSPS-2 from SSPS through DEAE-cellulose ion exchange column
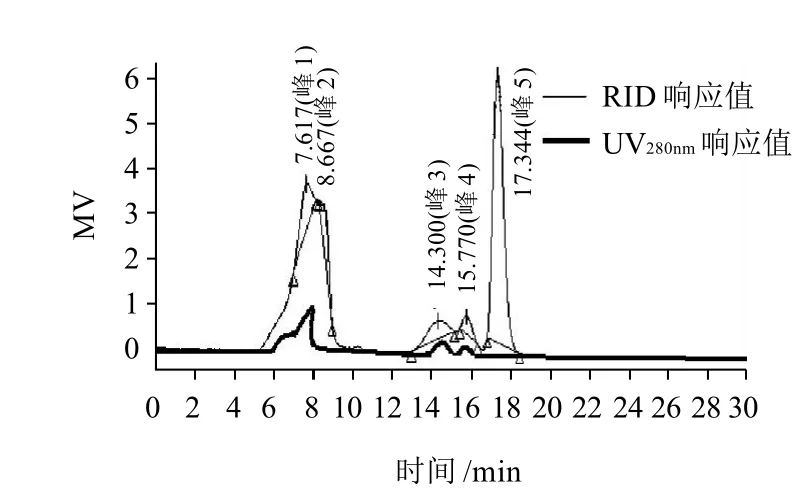
图 3 SSPS-1相对分子质量图谱Fig.3 Molecular weight of SSPS-1
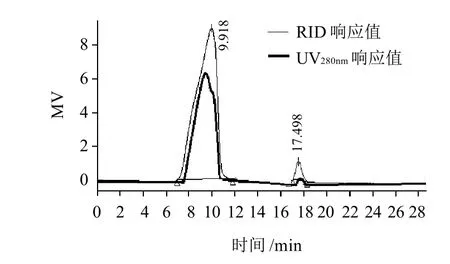
图 4 SSPS-2 相对分子质量图谱Fig.4 Molecular weight of SSPS-2
为考察DHPM对多糖的影响,选取蛋白含量少的组分SSPS-1为下一步实验对象。
2.2 DHPM对SSPS-1的组成及相对分子质量变化的影响
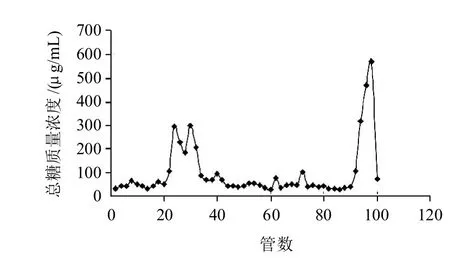
图 5 经DHPM处理的SSPS-1、SSPS-2组分Fig.5 SSPS-1 and SSPS-2 treated by DHPM
SSPS经DHPM处理后得到的洗脱曲线见图5,SSPS-1经处理后收集得到20~36管,相对未处理的SSPS-1总糖含量降低了1.9%;SSPS-2经处理后得到90~100管,相对未处理的SSPS-2总糖含量降低升高了1.6%。图5中多糖吸收峰管数与图2中一致,另外,多糖含量波动在2%,变化不明显,表明DHPM处理没有使得SSPS增加新的组分,亦基本没有改变多糖含量。

图 6 DHPM处理SSPS-1得到的相对分子质量图谱Fig.6 Molecular weight of SSPS-1 treated by DHPM
图6为 SSPS-1经DHPM处理后得到的多糖组分相对分子质量图谱,其峰1(图6左起)相对分子质量由7.33×105减少至5.11×105;峰2相对分子质量由2.95×105减少至2.13×105;峰3、峰4分子量分别由2.5×104、6223降低至2.2×104、5892;峰5(1589)处理后消失。同时,蛋白含量没有出现很大的变化。出现这种现象的原因可能是SSPS-1经DHPM处理后,受到高速撞击和剪切等作用力使得其部分糖链连接薄弱,甚至断裂。峰5的消失可能是DHPM处理使部分小分子受作用力变成更加小分子量的糖,甚至单糖;或者小分子糖脱离了糖链以致在之后的透析过程中流失掉了。
2.3 DHPM对SSPS-1单糖组成变化的影响
按谭永辉[11]、Nakamura[26]等报道 SSPS含有相近数量的L-鼠李糖和D-半乳糖醛酸残基,其主干半乳糖醛酸主链是由聚鼠李糖半乳糖醛酸长链和聚半乳糖醛酸短链构成;阿拉伯糖残基占侧链的21%,半乳糖残基占侧链的50%,在靠近聚鼠李糖半乳糖醛酸长链主干位点上的半乳糖短链被阿拉伯糖、戊糖、岩藻糖和葡萄糖修饰。
在本实验中,测得SSPS-1的单糖组成及物质的量比为Rha:Fuc:Ara:Gal:Xyl:Glc:GlcA:GalA:Man=3.2:1.2:1.4:1.9:0.6:1.3:0.3:3.5:0.5(图7);SSPS-1经DHPM处理后,其单糖组成及物质的量比为Rha:Fuc:Ara:Gal:GalA:Man=2.9:0.7:1.2:1.4:2.9:0.2(图8)。实验结果表明经DHPM处理的SSPS-1主链的单糖Rha和GalA含量分别降低9.4%、17.1%,侧链部分的单糖Ara、Gal、Fuc、 Man分别降低14.3%、26.3%、41.7%、60%,Xyl、Glc、GlcA则未检出。
多糖降解程度的不同可能是DHPM处理后,L-鼠李糖和D-半乳糖醛酸构成的SSPS-1主链部分断裂,阿拉伯糖及半乳糖为主要成分的侧链上,其氢键作用力弱于DHPM的强作用力,使大部分侧链脱离糖链,其他修饰多糖如岩藻糖、木糖、甘露糖、葡萄糖等亦有不同程度的脱离糖链现象,而多数小分子在之后的透析过程中流失。
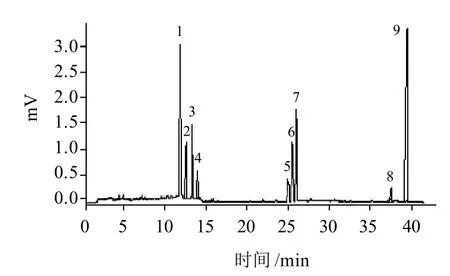
图 7 SSPS-1单糖组成气相色谱分析图Fig.7 Monosaccharide composition analysis of SSPS-1
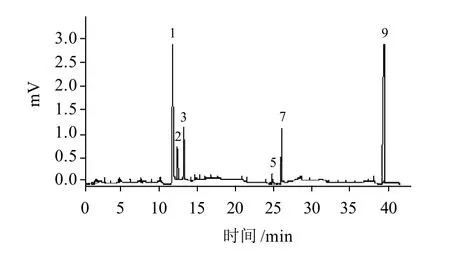
图 8 DHPM处理SSPS-1得到的单糖组成气相色谱分析图Fig.8 Monosaccharide composition analysis of DHPM-treated SSPS-1
2.4 DHPM对SSPS-1外观形态变化的影响
SSPS-1经DHPM处理前后的扫描电镜图像如图9所示,结果表明,SSPS-1呈针状堆积排列,典型规格为50μm×3.57μm;SSPS-1经DHPM处理后,其外观形态呈现出末端膨大呈球形的“火柴棒”状有序排列结构,紧密簇拥,典型规格为20μm×3.6μm×4.3μm。
可溶性大豆多糖属于天然高分子凝胶,糖链间通过氢键交联;在剧烈环境下,多个可溶性大豆多糖分子以一定的形态相结合,多糖分子链间氢键的作用可使多糖分子发生自缔合[27]。在本实验中,SSPS-1在DHPM的强烈作用力下,可能导致其糖链间氢键断裂,使得多糖的针状结构末端暴露更多基团,从而出现分子断裂变短现象;同时由于多糖暴露出更多基团,糖链间形成新的氢键交联,形成新的紧密的“火柴棒”状有序排列结构。

图9 SSPS-1和SSPS-1经DHPM处理的扫描电镜Fig.9 SEM of SSPS-1 and DHPM-treated SSPS-1
3 结 论
SSPS经过DHPM处理后,其相对分子质量,分子外观形态及单糖组成均有变化。DHPM并不会增加多糖组分,其中进一步分级得到的组分SSPS-1的相对分子质量由(7.33×105)减少至(5.11×105);分子外观形态则由针状排列变化成末端膨大呈球形的“火柴棒”状有序排列;主链的单糖Rha和GalA含量分别降低9.4%、17.1%,侧链部分的单糖Ara、Gal、Fuc、Man分别降低14.3%、26.3%、41.7%、60%, Xyl、Glc、GlcA未检出。由此可知,DHPM的作用不会增加SSPS的新组分,而是使其分子氢键断裂重组,侧链断裂,表现为分子量降低,单糖含量降低,其中主链降低程度小于侧链。DHPM对SSPS的糖苷键的影响还需进一步探讨,以得到DHPM对SSPS的具体作用机理。
[1] MAEDA H, PHILLIPS G O, WILLIAMS P A. Handbook of hydrocolloids: soluble soybean polysaccharide[M]. New York: CRC Press, 2000: 309-320.
[2] FURUTA H, MAEDA H. Rheological properties of water-soluble soybean polysaccharides extracted under weak acidic condition[J]. Food Hydrocolloids, 1999, 13(3): 267-274.
[3] ASAI I, WATARI Y, IIDA H, et al. Food hydrocolloids: Structure,properties and functions[M]. New York: Plenum Press, 1994: 151-156.
[4] NAKAMURA A, FURUTA H, KATO M, et al. Effect of soluble soybean polysaccharides on the stability of milk protein under acidic conditions[J]. Food Hydrocolloids, 2003, 17(5): 333-343.
[5] KAWAMURA S, NARASAKI T. Study on carbohydrate of soybean:component sugars of fractioned polysaccharides, especially identification of fucose in some hemicelluloses[J]. Agriculture Biololgy Chemistry,1961, 25: 527-531.
[6] MORITA M. Polysaccharides of soybean seeds: polysaccharide constituents of "hot-water-extract" fraction of soybean seed and anarabinogalactan as its major component[J]. Agriculture Biololgy Chemistry,1965, 29: 564-573.
[7] FURUTA H, TAKAHASHI T, TOBE J, et al. Extraction of watersoluble soybean polysaccharides under acidic conditions[J]. Bioscience,Biotechnology and Biochemistry, 1998, 62(12): 2300-2305.
[8] HUISMAN M H, SCHOLS H A, VORAGEN A G. Enzymatic degradation of cell wall polysaccharides from soybean meal[J]. Carbohydrate Polymers, 1999, 38(4): 299-307.
[9] NAKAMURA A, FURUT H, MAEDA H, et al. The structure of soluble soybean polysaccharide[J]. Hydrocolloids, 2000: 235-241.
[10] NAKAMURA A, FURUTA H, MAEDA H, et al. Analysis of the molecular construction of xylogalacturonan isolated from soluble soybean polysaccharides[J]. Bioscience, Biotechnology and Biochemistry, 2002,66(5): 1155-1158.
[11] 谭永辉. 水溶性大豆多糖的高效提取及改性研究[D]. 北京: 中国农业科学院, 2008.
[12] TABATA K, ITO W, KOJIMA T. Ultrasonic degradation of schizophyllan, an antitumor polysaccharide produced by schizophyllum commune fries[J]. Carbohydrate Research, 1981, 89(1): 121-135.
[13] ZHANG M, ZHANG L, PETER C K C, et al. Molecular weight and anti-tumor activity of the water-soluble polysaccharides isolated by hot water and ultrasonic treatment from the sclerotia and mycelia of Pleurotus tuberregium[J]. Carbohydrate Polymers, 2004, 56: 123-128.
[14] YANG B, ZHAO M M, SHI J, et al. Effect of ultrasonic treatment on the recovery and DPPH radical scavenging activity of polysaccharides from longan fruit pericarp[J]. Food Chemistry, 2008, 106(2): 685-690.
[15] YANG B, ZHAO M M, WANG R, et al. Ultra-high pressure treatment effects on polysaccharides and lignins of longan fruit pericarp[J]. Food Chemistry, 2009, 112(2): 428-431.
[16] PAQUIN P. Technological properties of high pressure homogenizers: the effect of fat globules, milk proteins, and polysaccharides[J]. International Dairy Journal, 1999, 9(3): 329-335.
[17] LIU W, LIU J H, LIU C M, et al. Activation and conformational changes of mushroom polyphenoloxidase by high pressure microfluidization treatment[J]. Innovative Food Science and Emerging Technologies, 2009,10(2): 142-147.
[18] LIU W, LIU J H, XIE M Y, et al. Characterization and high-pressure microfluidization-induced activation of polyphenoloxidase from Chinese pear[J]. Journal of Agricultural and Food Chemistry, 2009, 57(12):5376-5380.
[19] 刘成梅, 熊慧薇, 刘伟, 等. IHP处理对豆渣膳食纤维的改性研究[J].食品科学, 2005, 26(9): 112-114.
[20] 刘成梅, 刘伟, 万婕, 等. 瞬时高压作用对膳食纤维可溶性的影响[J].食品科学, 2005, 26(8): 110-112.
[21] 刘成梅, 刘伟, 林向阳, 等. Microfluidizer对膳食纤维微粒粒度分布的影响[J]. 食品科学, 2004, 25(1): 52-55.
[23] 周林, 郭祀远, 郑必胜. 高分子质量裂褶菌多糖的纯化及表征[J]. 食品与发酵工业, 2008, 34(12): 47-50.
[24] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999:111-115.
[25] CHEN Y, XIE M Y, NIE S P , et al. Purification, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry, 2008, 107(1): 231-241.
[26] NAKAMURA A, FUNRUTA H, MAEDA H, et al. Structural studies by stepwise enzymatic degradation of the main backbone of soybean soluble polysaccharides consisting of galacturonan and rhamnogalacturonan[J].Bioscience,Biotechnology, and Biochemistry, 2002, 66(6): 1301-1313.
[27] 顾雪蓉, 朱育平. 凝胶化学[M]. 北京: 化学工业出版社, 2005: 105-116.
Effect of Dynamic High-pressure Microfluidization on Morphology of Soluble Soybean Polysaccharides
ZHANG Wen-qin1,2,LIU Cheng-mei1,2,*,LIU Wei1,2,WAN Jie1,2
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China)
The effect of dynamic high-pressure microfluidization (DHPM) treatment on compositions, morphology, component change of sugar and molecular weight of soluble soybean polysaccharides (SSPS) were investigated. Results showed that soybean soluble polysaccharides were treated by DHPM, and then purified by DEAE-cellulose ion exchange column to obtain two components, which were SSPS-1 and SSPS-2. High performance gel permeation chromatography (HPGPC) analysis exhibited that SSPS-1 was a heteropolysaccharide containing a small amount of protein and SSPS-2 was a homogeneous polysaccharide associated to protein with high molecular weight. The molecular weight of SSPS-1 was reduced from 733 to 511 kD by microfluidization treatment. Scanning electron microscopy observation of SSPS-1 showed that feature of DHPM-treated SSPS-1 sample was changed from the disordered flake-like to ordered "match stick"-like structure, which swelled into sphere at the end of structure. The major components, Rha and GalA, in the main chain of SSPS-1 exhibited a decrease by 9.4% and 17.1%, respectively. While the components such as Ara, Gal, Fuc and Man in side chain of SSPS-1 exhibited a significant reduction, which were decreased by 14.3%, 26.3%, 41.7% and 60%, respectively. There were no detectable Xyl, Glc and GlcA due to the break of chains and hydrolysis.
dynamic high-pressure microfluidization;soluble soybean polysaccharide;component;molecular weight;morphology
TQ929.2
A
1002-6630(2010)09-0030-05
2009-12-01
国家“863”计划重点项目 (2007AA100403);国家重点实验室目标导向项目(SKLF-MB-200808)
章文琴(1985—),女,硕士研究生,研究方向为食物(含生物质)资源开发与利用。E-mail:zhangwenqin1985@hotmail.com
刘成梅(1963—),男,教授,博士,研究方向为食品工程高新技术。E-mail:chengmeiliu@yahoo.com.cn

