JAK2-V617F突变初步研究①
刘凌 庞缨 周旭红 冯莹 叶絮
(广州医学院第二附属医院血液科 广东 广州 510000)
自2005年James[1]首先报道在真性红细胞增多症(PV)患者中发现JAK2-V617F点突变以来,该基因目前已成为国际上研究的热点。为了进一步明确JAK2-V617F点突变在各种血液病中的表达情况,建立简单、准确、高效的实验室检测方法,为临床诊断和治疗提供帮助,笔者对我院血液科2007年6月至2008年6月门诊及住院,确诊为骨髓增殖性肿瘤(MPN)、骨髓增生异常综合征(MDS)、骨髓增生异常综合征/骨髓增殖性肿瘤(MDS/MPN)、急性髓系白血病(AML)、急性淋巴细胞白血病(ALL)、慢性粒细胞白血病(CML)的部分患者及正常对照共124例进行JAK2-V617F检测,并报道如下。
1 对象及方法
1.1 研究对象
我院血液科2007年6月至2009年6月门诊及住院确诊的相关患者,PV组男性11例,女性21例,年龄32~83岁,中位年龄66.5岁。ET组男性8例,女性12例,年龄35~88岁,中位年龄69.5岁。IMF组男性1例,女性2例。MDS组男性14例,女性8例,年龄35~76岁,中位年龄48.0岁。MDS/MPN组男性5例,女性3例,年龄55~78岁,中位年龄62.0岁。AML组男性9例,女性5例,年龄25~75岁,中位年龄44.5岁。ALL组男性5例,女性5例,年龄23~45岁,中位年龄32.5岁。Bcr-abl阳性CML组男性3例,女性2例,年龄46~69岁,中位年龄53.5岁。10例健康志愿者对照。MPN、MDS、MDS/MPN、AML、ALL、CML诊断参照WHO相关标准[2]。
1.2 方法
1.2.1 基因组DNA制备 抽取患者和正常对照外周血5mL,按酚-氯仿法提取白细胞基因组DNA。用紫外分光光度仪检测DNA的浓度和纯度,取吸光度A260/A280介于1.6~1.8的标本,DNA终浓度50~100mg/L,置于-80℃冰箱冻存备用。
1.2.2 PCR扩增 采用AS-PCR法,设计2条正义引物F1、F2和一条反义引物R,引物由上海生工生物工程技术有限公司合成。F1在野生型和突变型DNA中均可出现,作为内参照以保证反应的精确度;F2为突变特异性引物,跨越G-T突变位点。F1序列为:5′-A T C T A T A G T C A T G C T G A A A G T A G G A G A A A G-3′;F2序列为:5′-AGCATTTGGTTTTAAATTATGGAGTATATT-3′;R序列为:5′-CTGAATAGTCCTACAGTGTTTTCAGTTTCA-3′。反应体系为:模板DNA2μL,反义引物R1.0μmol/L,正义引物F10.5μmol/L,F20.5 μmoL/L,10×PCRBuffer5μL,Mgcl21.2mmol/L,dNTP 各2 mmol/L,TaqDNA聚合酶2.5U(广州莱德尔生物科技有限公司),去离子水25.5μL。反应条件:94℃预变性11min,94℃变性30s,55℃30s,72℃30s,循环36次,72℃延伸6min。
1.2.3 琼脂糖凝胶电泳 取5μLPCR产物经20g/L琼脂糖凝胶电泳后紫外光透视仪分析图像、摄像并保存结果。出现364bp产物为野生型,出现364bp和243bp2条产物为突变型。
1.2.4 基因测序 对所有阳性标本和阴性标本均再次分别在与上述相同反应体系和条件下,进行PCR反应,PCR产物经纯化后,由上海生工生物工程技术有限公司进行测序,将所得到的测序结果与野生型基因序列进行对比,出现G-T突变为阳性。比较直接测序结果与AS-PCR检测结果的一致性。
1.2.5 统计学处理 采用SPSS 13.0软件对所获得的数据进行统计分析,计量资料以()表示,2组间均数比较用t检验;计数资料以率表示,率的比较用χ2检验,P<0.05为差异有显著性。
2 结果
2.1 AK2-V617F突变PCR产物琼脂糖凝胶电泳结果
出现364bp和243bp2条条带为阳性,出现364bp一条条带为阴性,见图1。
2.2 JAK2-V617F突变在各种疾病中的表达情况
(1)PV组阳性率为93.8%(30/32),ET组阳性率为60.0%(12/20),IMF组阳性率为0%(0/3),MDS组阳性率为4.5%(1/22),MDS/MPN组阳性率为12.5%(1/8),AML、ALL、CML患者及正常对照均为阴性。JAK2-V617F突变在PV、ET、MDS、MDS/MPN患者中的阳性率差异有显著性(χ2=47.799,P<0.05)。(2)JAK2-V617F突变阳性ET患者的血红蛋白均数为(198.6±27.1)g/L,与阴性患者血红蛋白值均数201.5g/L相比,差异无显著性(t=0.062,P>0.05)。(3)JAK2-V617F突变阳性ET患者的血小板均数(834.1±283.5)×109/L,与阴性患者血小板均数(826.3±228.8)×109/L相比,差异无显著性(t=0.083,P>0.05)。(4)JAK2-V617F突变阳性PV和ET患者白细胞均数为(20.6±4.7)×109/L,与阴性患者白细胞均数(16.7±4.2)×109/L相比,差异有显著性(t=2.44,P<0.05)。(5)骨髓活检:根据Comori网硬蛋白染色结果,按网状纤维积分标准(Manoharan改良法)[3],将PV及ET患者按照骨髓纤维组织增生程度分为(±)、(+)、(++)、(+++)及(++++)5组,JAK2-V617F突变阳性患者骨髓纤维组织增生较明显,差异有显著性(P<0.05),见表1。
2.3 基因测序结果
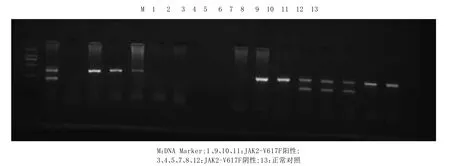
图1 AS-PCR扩增后琼脂糖凝胶电泳结果
阳性标本显示为T峰,阴性标本显示为G峰,证实突变型DNA存在JAK2-V617F点突变,即JAK2基因12号外显子第1849位核苷酸G被T所取代。AS-PCR法检测出44例阳性,80例阴性。直接测序法检出29例阳性,并同时为AS-PCR法检出;另外95例阴性,其中15例用AS-PCR法检测为阳性。2种方法检测阳性率有显著差异,AS-PCR法高于直接测序法(χ2=4.368,P<0.05)。2种方法所得结果之间存在正关联,关联系数r=0.74,说明直接测序法阳性者AS-PCR法也趋向阳性,见表2。
3 讨论
MPN是一组以骨髓髓系中一系或多系增殖为特征的克隆性造血干细胞疾病。迄今为止,人们对MPN的确切发病机制仍不十分明确,过去的诊断[4]主要依靠临床表现、血常规、血清EPO水平、NAP积分、骨髓细胞形态和骨髓活检等,并且必须排除继发性因素。但有时仍难以与有相似症状和血象表现的其他疾病相鉴别,如继发性红细胞增多症,反应性血小板增多,类白血病反应,MDS等,给诊断造成一定困难,且治疗上也无特异性药物。James[1]首先报道了在PV患者中发现JAK2-V617F点突变,其后在MPN的其他亚型中也陆续发现了该突变的存在,但阳性率不一。本实验研究发现JAK2-V617F点突变在PV患者中阳性率最高,其次为ET患者,在AML、ALL、CML中为阴性,与国际上报道相符[5];在IMF患者中未发现阳性,可能与标本数太少有关。
MDS是一组以髓系细胞分化和成熟异常、骨髓衰竭为特征的髓系肿瘤,伴有外周血细胞减少和红系、粒系、巨核细胞系一系或多系形态学异常,由于遗传不稳定因而高风险向急性髓系白血病(AML)转化[6]。近期研究发现,有部分MDS某些亚型的患者中有JAK2突变,Coffer[7]等在通过对MDS患者发病机制的研究中发现JAK/STAT信号传导在MDS细胞凋亡机制中发挥重要的作用,是影响髓系祖细胞成熟障碍、调控MDS细胞凋亡的重要通路。本研究在MDS和MDS/MPN中各发现1例JAK2-V617F突变。Szpurka[8]研究57例MDS/MPN患者发现11例携带JAK2-V617F。这个发现意味着共同发生并不是偶然的,什么机制影响MDS患者获得JAK2-V617F,或者JAK2-V617F阳性MPN发展为MDS?是否这种单一突变在人类中就足以导致MPN的发生?这些问题仍有待进一步探讨。
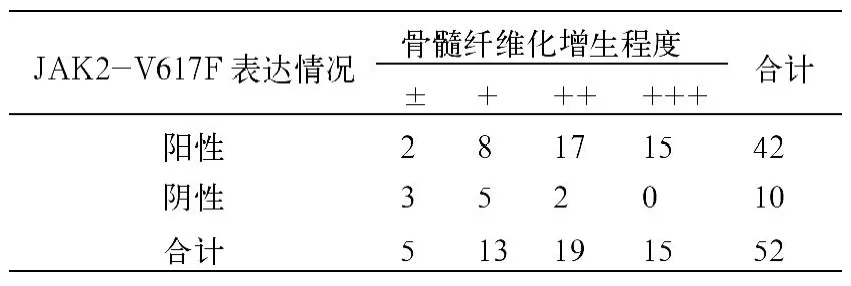
表1 PV和ET患者JAK2-V617F突变与骨髓纤维增生程度的关系

表2 直接测序法与AS-PCR法比较
本研究还发现ET患者中JAK2-V617F突变与血红蛋白量、血小板数量无关。但国外有报道[9]ET患者中JAK2-V617F突变阳性者血红蛋白量较高、血小板计数较低,故我们的研究还有待增加病例数以作进一步分析。PV患者阴性例数太少,未做比较。PV和ET阳性患者白细胞计数显著高于阴性患者,且骨髓纤维化程度亦较阴性者严重。国外学者[10]亦发现阳性患者中白细胞计数高,且可以作为独立的危险因素与血栓形成及骨髓纤维化成正相关。
JAK2-V617F的检测目前有直接测序、BsaⅪ限制性酶切分析、AS-PCR和荧光实时定量PCR(RT-PCR)等方法。直接测序法准确率高但敏感度低,多应用于科研;限制性酶切方法较复杂且阳性率不高;AS-PCR特异性强、敏感度高;RT-PCR敏感度高,且对于突变基因的含量及纯合子、杂合子的比例能定量分析,但费用较高。Baxter等[11]应用AS-PCR检测发现ET中阳性率高达57%,明显高于直接测序法仅12%的阳性率。由于MPN患者中只有一部分外周血粒细胞可能起源于恶性祖细胞,同时普通方法仅可在超过40%的细胞(等位基因>20%)有杂合子突变时才可检测到,因此普通测序可能会低估携带JAK2-V617F突变的比例,应用ASPCR方法可以在3%的细胞有杂合子突变就可检测到。在我院临床检测中,测序阳性者与应用AS-PCR方法检测完全一致,但ASPCR灵敏度更高,且方法简便、成本较低,是值得广泛开展的临床检测方法。
[1]James C, U go V , Couedic JPL , et al. A unique clonal JAK2 mutation leading to constitutive signaling causes polycythaemia vera[J].N ature,2005,434(7037):1144~1148.
[2]Vardiman JW, Harris NL, Brunning RD. The World Health Organization(WHO) classification of the myeloid neoplasms[J].Blood,2002,100:2292~2302.
[3]浦权,杨梅如.血液病骨髓组织病理学彩色图谱[M].上海:上海科学技术出版社,2000:4~21.
[4]Jaffe ES, Harris NL, Stein H,et al.World Health Organization Classification of Tumors Pathology and Genetics of Tumors of Heamatopoietic and Lymphoid Tissues IARC Press International Agency for Research on Cancer[J].Lyon: IARC Press,32~41.
[5]Kannim S, Thongnoppakhun W, Auewarakul CU.Two-round allele specific-polymerase chain reaction: a simple and highly sensitive method for JAK2-V617F mutation detection[J]. Clin Chim Acta,2009,401(1~2):148~151.
[6]肖志坚.骨髓增生异常综合征:现况与问题[J].白血病淋巴瘤,2005,14:193~196.
[7]Lee J W, Kim Y G, Soung Y H, et al. The JAK2-V617F mutation in denovoacute myeloqenous leukemias[J]. Oncogene, 2006, 25(9):1434~1436.
[8]Szpurka H,Tiu R,Murugesan G,et al.Refractory anemia with ringed sideroblasts associated with marked thrombocytosis (RARS-T),another myeloproliferative condition characterized by JAK2 V617F mutation[J].Blood,2006,108(7):2173~2173.
[9]Heller PG, Lev PR, Salini JP, et al.JAK2 V617F mutation in platelets from essential thrombocy themia :corretation with clinical features and analysis of STAT3 phosphorylation status[J].Eur JHaematol,2006,77(3):210~216.
[10]Barosi G, Rosti V.Novel strategies for patients with chronic myeloproliferative disorders[J].Curr Opin Hematol,2009 Mar,16(2):129~134.
[11]Baxter EJ, Scolt LM, Campbell PJ, et al. Acqurired mutation of the tyrosine Kinase JAK2 in human myeloproliferative disorder[J].Lancet,2005,365(9464):1054~1061.

