PAMAM-D对异种移植用外源基因转染猪精子细胞介导作用的研究*
杨惠祥 乔宝民 王广有 李胜芝 张 玥 李长平 徐 勇 马腾骧
猪是异种移植器官供体的首选动物,将人补体调节蛋白基因包括人衰变加速因子(human decay accelerating factor,hDAF)基因转移到猪体内是克服超急排斥反应的有效方法[1]。目前常用受精卵显微注射法培育转基因动物,但存在设备昂贵、技术复杂、效率低等缺陷。应用精子载体法(SMGT)进行基因转移制备转基因动物方法简便,成本低,便于规模生产[2]。由于SMGT转基因的随机性较强,其转染效率的稳定性还有待提高。近年来,在基因治疗领域,利用新型纳米材料聚酰胺-胺型树枝状聚合物PAMAM-D进行基因转移获得了成功[3]。本文尝试将PAMAM-D/hDAF复合物与猪精子共孵育,以提高外源基因hDAF对猪精子细胞的转染效率和稳定性。
1 材料与方法
1.1 材料 (1)hDAF基因重组质粒(以hDAF cDNA表示)由天津市泌尿外科研究所构建完成[4],抽提纯化后加入内切酶SacⅠ使其线性化,末端为黏性末端,工作液浓度为100 mg/L。(2)猪精液采自天津天泰公司猪场1~1.5岁的长白杂交种猪,利用手握法采集含精子丰富的精液部分,距离实验时间不超过3 h,精液按照1∶10的比例稀释于37℃预热的猪授精培养基/牛血清白蛋白(SFM/BSA)液中,保存于17℃。(3)主要试剂:PAMAM-D(G5)由南开大学生物活性材料教育部重点实验室孔德领教授惠赠,SFM和SFM/BSA液的制备见参考文献[2](试剂均为Sigma公司产品),DNA探针/原位杂交检测试剂盒(生物素标记探针,北京鼎国公司),DNaseⅠ和限制性内切酶 SacⅠ、XbaⅠ、ClaⅠ(大连宝生物公司)。3′尾段标记生物素的寡核苷酸DNA探针,序列为5′-GATTTTCCTCTGCATTCAGGTGGTG GGC-3′,由大连宝生物公司合成。
1.2 方法
1.2.1 PAMAM-D/DNA复合物的制备 100 μL SFM液中分别加入线状 hDAF cDNA 0.2、0.4、0.6、0.8、1.0 μg,每组 cDNA再按氮磷比 10∶1、20∶1、40∶1 分别加入相应剂量 PAMAM-D及不加PAMAM-D,轻轻混合后室温下孵育30 min,形成的各组复合物以G5/hDAF表示。
1.2.2 G5/hDAF中DNA对限制性内切酶的抗性分析 取G5/hDAF(氮磷比 10∶1)和 hDAF cDNA 各 1 μg,分别以 XbaⅠ/ClaⅠ双酶切,2 h后煮沸停止反应,加入十二烷基硫酸钠(SDS,终浓度为0.4 mol/L)。另取1 μg G5/hDAF复合物(氮磷比10∶1),先加 SDS溶解(终浓度为0.4 mol/L),然后用限制性内切酶XbaⅠ/ClaⅠ消化。将消化物在0.8%的琼脂糖凝胶中电泳。
1.2.3 猪精子细胞对外源性DNA的摄取 检测猪精液密度与活力后,室温下离心(3 500 r/min,10 min,下同),弃上清。加入SFM/BSA液洗涤精液2次后,SFM液洗涤1次,调整精子细胞密度为107/mL。取100 μL精子细胞悬液置于离心管中,分别加入上述各组G5/hDAF,17℃孵育2 h,对照组只加入相应剂量的hDAFcDNA。每管设3个重复。PBS清洗3次后,保留约100 μL液体,吹打混匀。加入DNaseⅠ至终浓度为100 mg/L,37℃下作用30 min。PBS洗涤3次。保留约100 μL液体。
1.2.4 原位杂交检测hDAFcDNA对猪精子细胞的转染效率 按照DNA探针/原位杂交检测试剂盒说明书操作。高倍镜下读片,每片随机抽取5个视野,计数400个精子细胞,记录染色阳性细胞数,计算转染率(转染率=染色阳性精子细胞数/400×100%)。在原位杂交流程中设定阴性对照,阳性对照为人精子细胞。
2 结果
2.1 G5/hDAF的抗酶切反应 酶切后的G5/hDAF在电泳孔中不迁移,而经SDS处理后可以迁移。复合物中的DNA分子不被限制性内切酶降解,见图1。

图1 PAMAM-D/DNA复合物的酶切电泳
2.2 hDAF cDNA对猪精子细胞的转染效率 在猪精子细胞头部,特别是顶体后区可见黑色颗粒状物,见图2。两因素析因设计定量资料的方差分析结果表明,不同剂量DNA、不同氮磷比之间转染率差别有统计学意义(均P<0.01),且两者之间的交互作用差异有统计学意义(P<0.01),0.4 μg DNA含量、氮磷比20∶1时,细胞转染率最高,见表1。

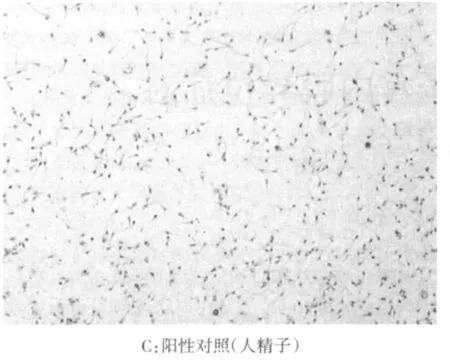
图2 猪精子细胞原位杂交检测hDAF(BCIP/NBT染色×100)
表1 不同DNA量、不同氮磷比情况下精子细胞转染效率 (n=3,%,±s)
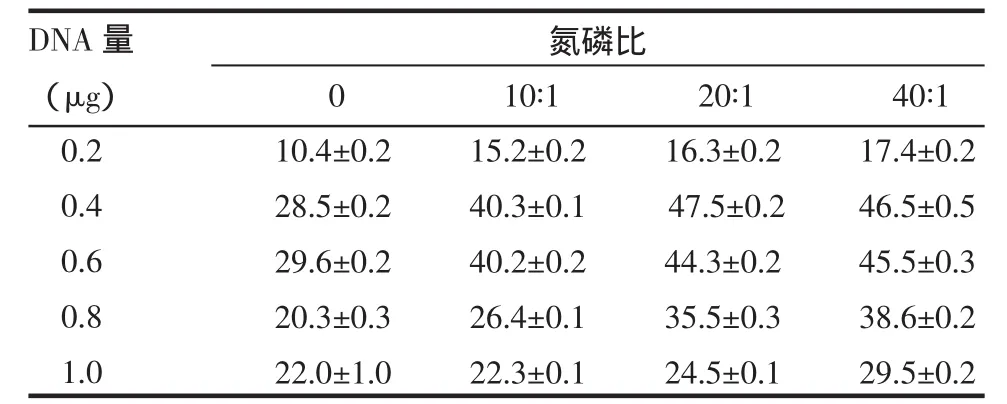
表1 不同DNA量、不同氮磷比情况下精子细胞转染效率 (n=3,%,±s)
F 组间=16 987.70,F 组内=6 367.42,F 交互=404.10,均 P<0.01
DNA量(μg)0.2 0.4 0.6 0.8 1.0氮磷比0 10.4±0.2 28.5±0.2 29.6±0.2 20.3±0.3 22.0±1.0 10∶1 15.2±0.2 40.3±0.1 40.2±0.2 26.4±0.1 22.3±0.1 20∶1 16.3±0.2 47.5±0.2 44.3±0.2 35.5±0.3 24.5±0.1 40∶1 17.4±0.2 46.5±0.5 45.5±0.3 38.6±0.2 29.5±0.2
3 讨论
精子载体法制备转基因动物的关键步骤是精子细胞高效稳定地摄取外源基因,进而通过受精过程使外源基因成为胚胎细胞染色体的组成部分,从而培育出转基因动物。成熟的动物精子在结构与功能上具有结合外源DNA并使其核内化的能力,但外源基因与精子的结合是随机发生的,稳定性较差。为此,出现了多种试图促进外源DNA与精子结合的技术,包括电穿孔法、病毒介导和脂质体法等[5]。这些改进方法因存在种种缺点,如对精子产生毒害作用、受精率下降及应用的局限性等,而使精子载体法存在的问题仍然难以得到根本改观。
PAMAM-D是一种人工合成的新型纳米材料,具有成辐射状对称的刚性球体结构。与普通高分子聚合物不同,它具有低黏度、高溶解性、可混合性以及高反应性等特点,已成为基因转移的一个新载体,较传统载体有明显优势。PAMAM-D在基因治疗方面的研究很多,且取得了较好的效果[6]。但采用以PAMAM-D介导的精子载体法只见于培育鱼类转基因动物的研究[7]。笔者将之应用于哺乳动物的转基因操作上是一种新的尝试。
本研究表明,PAMAM-D分子能阻止PAMAMD/DNA复合物中DNA的电泳迁移,而阴离子去污剂SDS可以通过解离PAMAM-D/DNA复合物使得DNA分子释放出来,证明PAMAM-D与DNA之间是通过静电相互作用发生复合的。同时,存在于复合物中的DNA分子不受限制性内切酶的降解,因此推测,这些复合物在活体内或细胞内可能对各种酶类降解有一定的抵抗作用,能够维持外源性DNA的长期存在,有助于外源基因与精子细胞稳定结合,从而保持转基因效率的稳定性。本研究发现导入外源质粒的数量直接影响转染的效率。在0.2 μg组,由于DNA剂量较少使得转染入精子中的外源基因比例低,在0.8 μg和1.0 μg组精子中的hDAF比0.4 μg和0.6 μg组均低,可能是较高剂量的外源DNA会抑制精子运动,并引发核酸内切酶活性使之降解。本实验确定hDAF基因对猪精子转染的最佳用量是 4~6 μg/107,氮磷比20∶1。
PAMAM-D没有免疫原性,不引起机体免疫反应,无遗传毒性与细胞毒性,不会导致细胞的转化与死亡。联合应用PAMAM-D可望增强SMGT的实用性,为下一步生产异种移植用转基因猪提供一种新的转基因方法。
[1]Ghanekar A,Lajoie G,Luo Y,et al.Improvement in rejection of human decay accelerating factor transgenic pig-to-primate renal xenografts with administration of rabbit antithymocyte serum[J].Transplantation,2002,74(1):28-35.
[2]Lavitrano M,Bacci ML,Forni M,et al.Efficient production by sperm--mediated gene transfer of human decay accelerating factor(hDAF)transgenic pigs for xenotransplantation[J].PNAS,2002,99(22):14230-14235.
[3]Teixeira LA,Fricke CH,Bonorino CB,et al.An efficient genetransfer system for hematopoietic cell line using transient and stable vectors[J].J Biotechnology,2001,88(2):159-165.
[4]刘秉乾,马志方,李胜芝,等.异种移植转基因用含杂合增强子UI的人衰变加速因子重组基因的构建[J].天津医科大学学报,2005,11(4):528-530.
[5]杨惠祥,徐勇,王广有,等.精子介导转基因技术的进展与争论[J].医学与哲学(临床决策论坛版),2006,27(10):62-64.
[6]Teixeira LA,Fricke CH,Bonorino CB,et al.An efficient genetransfer system for hematopoietic cell line using transient and stable vectors[J].J Biotechnol,2001,88(2):159-165.
[7]杨凯,程汉华,郭一清,等.采用高分子介导精子作载体制备转基因泥鳅[J].遗传学报,2001,28(12):1137-1141.

