辛伐他汀对冠心病患者血浆氧化还原态的影响*
黄彦生 吴 彧 孙 琳 赵士超 段红艳 吴金涛 王树人
氧化应激与冠状动脉粥样硬化性心脏病(冠心病)密切相关[1],冠心病患者血浆氧化还原态向氧化方向发生偏移[2]。辛伐他汀除具有调脂功能以外,还具有抗动脉粥样硬化的功能,但有关其对冠心病患者血浆氧化还原态的影响尚少见报道。本研究对比观察了辛伐他汀和降胆固醇药物考来烯胺对冠心病患者调脂作用及对血管内皮功能、氧化还原态的影响,报告如下。
1 对象与方法
1.1 研究对象 依据2001年中华医学会心血管病学分会等制定的冠心病诊断标准,选择2006年3月—2007年9月河南省人民医院心内科住院的冠心病患者。排除风湿性心脏病、肺心病、原发性心肌病、心肌炎、大动脉炎、严重的肝、肾功能不全、肾病综合征、难以控制的糖尿病、恶性肿瘤、精神病及随访资料不完整者。将符合纳入标准的112例冠心病患者按就诊顺序,用随机数字表方法分为辛伐他汀组(56例)和考来烯胺组(56例),2组一般情况具有可比性,见表1。
表1 2组患者一般情况比较 (±s)
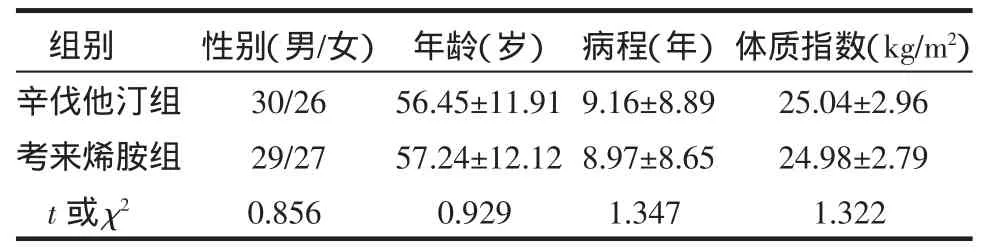
表1 2组患者一般情况比较 (±s)
均 P>0.05
组别辛伐他汀组考来烯胺组t或 χ2性别(男/女)30/26 29/27 0.856年龄(岁)56.45±11.91 57.24±12.12 0.929病程(年)9.16±8.89 8.97±8.65 1.347体质指数(kg/m2)25.04±2.96 24.98±2.79 1.322
1.2 治疗方法 2组均给予β受体阻滞剂、钙离子拮抗剂、阿司匹林、血管紧张素转化酶抑制剂或血管紧张素Ⅱ受体拮抗剂等常规药物治疗,辛伐他汀组、考来烯胺组分别有39、41例每早口服5-单硝酸异山梨醇酯缓释胶囊50 mg。辛伐他汀组在常规治疗基础上加用辛伐他汀(商品名舒降之,杭州默沙东制药公司生产)20 mg每晚口服;考来烯胺组给予考来烯胺(商品考来烯胺散,厚生药业有限公司生产),第1周每天4 g口服,第2周每天8 g口服,第3周及以后每天12 g口服,均连服8周。
1.3 指标测定 治疗前及治疗8周后晨起空腹抽取肘正中静脉血,分离出血清或血浆备用。
1.3.1 血脂 胆固醇(TC)、三酰甘油(TG)采用酶法以Beckman试剂测定,低密度脂蛋白胆固醇(LDL-C)采用过氧化氢酶(catalase,CAT)清除法测定。
1.3.2 血管内皮功能指标 采用特异性放射免疫均相竞争法直接测定血浆中内皮素-1(ET-1),ET-1试剂盒购自解放军总医院东亚免疫技术研究所。一氧化氮(NO)试剂盒购自法国Coulter公司,采用硝酸还原酶法测定血清中NO。所有检测严格按说明书操作。
1.3.3 氧化还原态指标 还原型谷胱甘肽(reduced glutathione,GSH)和氧化型谷胱甘肽(oxidized glutathione,GSSG)按荧光分光光度法测定。GSH/GSSG氧化还原电位值根据公式 Eh(GSH/GSSG)=E0+(RT/2F)ln(GSSG/GSH2)计算。其中 E0为GSH/GSSH的标准电位值,血液pH=7.4时,标准E0为-264mV,R为气体常数,T为绝对温度,F为Faraday常数[3]。
1.4 统计学处理 全部数据采用SPSS 10.0软件包进行统计分析,计量资料以均数±标准差(±s)表示,均数间的比较采用成组t检验或配对t检验,计数资料比较采用χ2检验,检验水准为α=0.05。
2 结果
治疗8周后,辛伐他汀组1例因转氨酶升高3倍退出试验,考来烯胺组3例因恶心腹胀、Q-T间期延长退出试验。
2.1 2组降脂疗效的比较 治疗8周后,辛伐他汀组TC、LDL-C和TG明显减低;考来烯胺组TC和LDL-C明显减低,TG无明显变化。2组相比TC和LDL-C治疗前后差异无统计学意义,治疗前后TG差异有统计学意义,见表2。
表2 2组降脂疗效的比较 (mmol/L,±s)
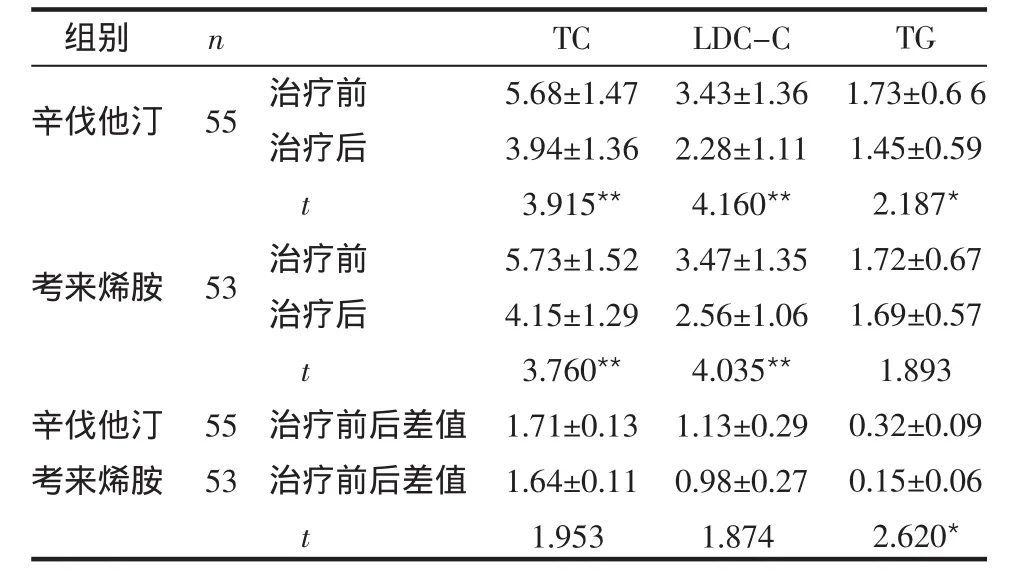
表2 2组降脂疗效的比较 (mmol/L,±s)
*P<0.05,**P<0.01,表3、4 同
组别 n辛伐他汀55考来烯胺53辛伐他汀考来烯胺55 53治疗前治疗后t治疗前治疗后t治疗前后差值治疗前后差值t TC 5.68±1.47 3.94±1.36 3.915**5.73±1.52 4.15±1.29 3.760**1.71±0.13 1.64±0.11 1.953 LDC-C 3.43±1.36 2.28±1.11 4.160**3.47±1.35 2.56±1.06 4.035**1.13±0.29 0.98±0.27 1.874 TG 1.73±0.6 6 1.45±0.59 2.187*1.72±0.67 1.69±0.57 1.893 0.32±0.09 0.15±0.06 2.620*
2.2 2组内皮功能变化 治疗8周后,辛伐他汀组NO升高,ET-1减低,NO/ET-1升高;考来烯胺组NO、ET-1和NO/ET-1变化差异均无统计学意义。2组治疗前后NO、ET-1和NO/ET-1改变差异均有统计学意义,见表3。
表3 2组血管内皮功能变化比较 (±s)
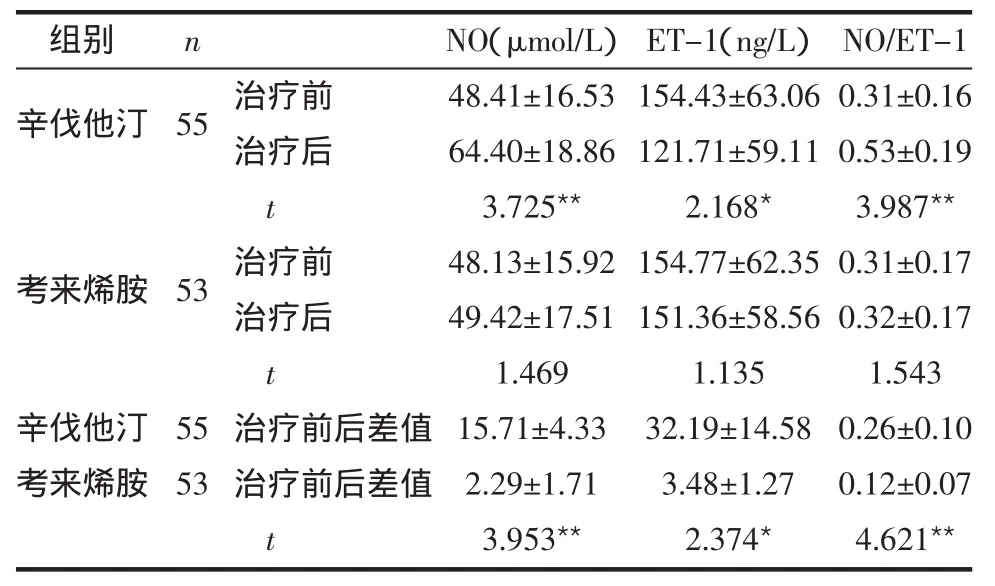
表3 2组血管内皮功能变化比较 (±s)
组别 n辛伐他汀55考来烯胺53辛伐他汀考来烯胺55 53治疗前治疗后t治疗前治疗后t治疗前后差值治疗前后差值t NO(μmol/L)48.41±16.53 64.40±18.86 3.725**48.13±15.92 49.42±17.51 1.469 15.71±4.33 2.29±1.71 3.953**ET-1(ng/L)154.43±63.06 121.71±59.11 2.168*154.77±62.35 151.36±58.56 1.135 32.19±14.58 3.48±1.27 2.374*NO/ET-1 0.31±0.16 0.53±0.19 3.987**0.31±0.17 0.32±0.17 1.543 0.26±0.10 0.12±0.07 4.621**
2.3 2组氧化还原态变化比较 治疗8周后,辛伐他汀组GSH和GSH/GSSG增高,GSSG和Eh(GSH/GSSG)减低;考来烯胺组以上指标变化均无统计学意义。2组治疗前后上述指标改变差异均有统计学意义,见表4。
表4 2组氧化还原态变化比较 (±s)
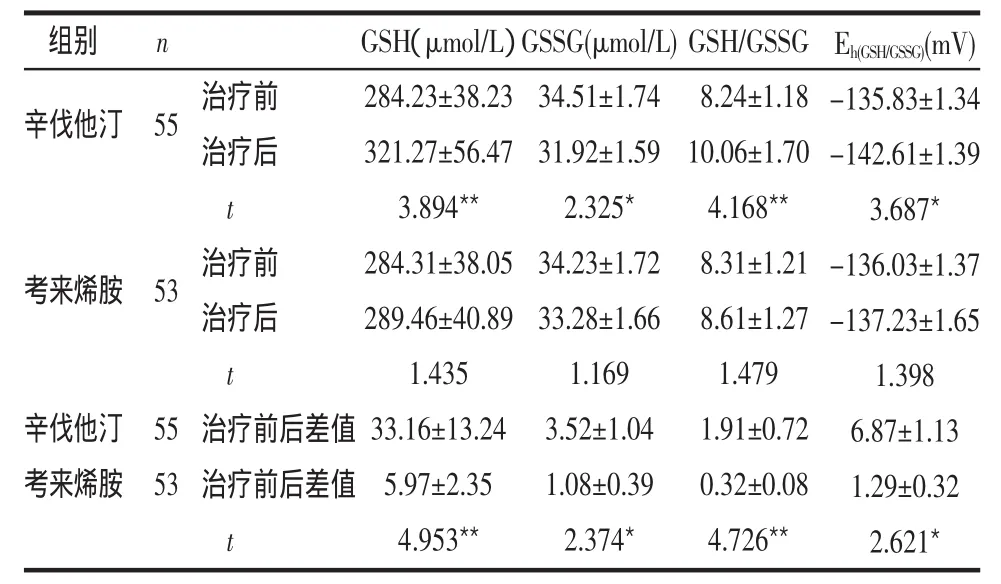
表4 2组氧化还原态变化比较 (±s)
组别 n辛伐他汀55考来烯胺53辛伐他汀考来烯胺55 53治疗前治疗后t治疗前治疗后t治疗前后差值治疗前后差值t GSH(μmol/L)284.23±38.23 321.27±56.47 3.894**284.31±38.05 289.46±40.89 1.435 33.16±13.24 5.97±2.35 4.953**GSSG(μmol/L)34.51±1.74 31.92±1.59 2.325*34.23±1.72 33.28±1.66 1.169 3.52±1.04 1.08±0.39 2.374*GSH/GSSG 8.24±1.18 10.06±1.70 4.168**8.31±1.21 8.61±1.27 1.479 1.91±0.72 0.32±0.08 4.726**Eh(GSH/GSSG)(mV)-135.83±1.34-142.61±1.39 3.687*-136.03±1.37-137.23±1.65 1.398 6.87±1.13 1.29±0.32 2.621*
3 讨论
目前发现,胆固醇异常升高、高血压、糖尿病、吸烟、高同型半胱氨酸血症等动脉粥样硬化发病的诸多危险因素中及在分子水平的损伤机制中都有氧化应激的参与,氧化应激通过引起脂质过氧化及内皮细胞、巨噬细胞、平滑肌细胞的氧化损伤继而促进动脉粥样硬化的发生发展,氧化应激与动脉粥样硬化的发病关系密切[1]。但机体对于氧化应激又有着非常强大的防御和拮抗机制,两者的平衡构成了机体内环境的一个重要稳态机制,被称为氧化-还原态[4]。
GSH/GSSG被认为是细胞中主要的氧化还原缓冲对(redox buffer),GSH可清除活性氧(ROS),维持生物大分子的巯基(-SH)活性中心,使维生素(Vc)和α-生育酚维持还原状态,反应中GSH被氧化为GSSG后,在GSSG还原酶催化下,以还原型辅酶Ⅱ(NADPH)传递氢,GSSG可被重新还原为GSH,遂可重复利用[5]。另一方面,蛋白质分子中大量的二硫键(-S-S-)结构亦与蛋白质的功能密不可分,这需要一定的氧化态维系。因此,机体内必有一个相当恒定的GSH/GSSG氧化-还原态[6]。资料显示,不同类型的细胞中GSH/GSSG氧化还原电位一致,并与细胞的增殖、分化及凋亡等有关[7]。目前认为,血浆中GSH/GSSG可一定程度上反应机体氧化还原内稳态的改变,GSH/GSSG向氧化方向偏移时可产生类似过氧化氢增多时产生的氧化损伤效应[8]。因此,本研究选择测量GSH/GSSG作为反映机体氧化还原态的一个主要指标,以探讨GSH/GSSG氧化还原态的改变在动脉粥样硬化中的作用。本研究前期工作发现动脉粥样硬化患者GSH/GSSG氧化还原对向氧化方向偏移[5]。本研究提示,辛伐他汀和考来烯胺对冠心病患者均可有效降脂,但仅辛伐他汀对冠心病患者血管内皮功能有一定的保护作用,且可纠正冠心病患者GSH/GSSG氧化还原对向氧化方向偏移。
因此,了解冠心病患者的氧化还原态,特别是GSH/GSSG的氧化还原态,纠正其偏移,可能是针对动脉粥样硬化发生、发展的氧化应激损伤机制的一条合理思路,有必要从矫正GSH/GSSG氧化还原态偏移的角度观察其对动脉粥样硬化发生、发展的影响。
[1]Veskoukis AS,Nikolaidis MG,Kyparos A,et al.Effects of xanthine oxidase inhibition on oxidative stress and swimming performance in rats[J].Appl Physiol Nutr Metab,2008,33(6):1140-1154.
[2]Wang QL,Wang SR,Ding Y,et al.Age-related changes of the redox state of glutathione in plasma[J].Chin Med J(Engl),2005,118(18):1560-1563.
[3]Sokalski T,Kucza W,Danielewski M,et al.Time-dependent phenomena in the potential response of ion-selective electrodes treated by the Nernst-Planck-Poisson model.Part 2:Transmembrane processes and detection limit[J].Anal Chem,2009,81(12):5016-5022.
[4]Koike Y,Hisada T,Utsugi M,et al.Glutathione redox regulates airway hyperresponsiveness and airway inflammation in mice[J].Am J Respir Cell Mol Biol,2007,37(3):322-329.
[5]Huang YS,Zhi YF,Kong SY,et al.Plasma glutathione of patients with coronary heart disease measured by fluorospectrophotometer[J].Guang Pu Xue Yu Guang Pu Fen Xi,2006,26(5):936-940.
[6]Findrik Z,Vrsalović Presecki A,Vasić-Racki D.Mathematical modelling of NADH oxidation catalyzed by new NADH oxidase from Lactobacillus brevis in continuously operated enzyme membrane reactor[J].J Biosci Bioeng,2007,104(4):275-280.
[7]Marty L,Siala W,Schwarzl覿nder M,et al.The NADPH-dependent thioredoxin system constitutes a functional backup for cytosolic glutathione reductase in Arabidopsis[J].Proc Natl Acad Sci USA,2009,106(22):9109-9014.
[8]Yang Z,Sharma AK,Marshall M,et al.NADPH oxidase in bone marrow-derived cells mediates pulmonary ischemia-reperfusion injury[J].Am J Respir Cell Mol Biol,2009,40(3):375-381.

