3种防御酶在水稻抗稻曲病中的活性变化
李小娟, 刘二明*, 谭小平, 肖启明, 刘年喜, 王金辉
(1.湖南农业大学生物安全科学技术学院,长沙 410128;2.湖南省植保植检站,长沙 410005)
水稻稻曲病(false smut of rice)又叫假黑穗病、绿黑穗病、黑球病、青粉病和丰收病,是水稻穗部的真菌性病害,其病原菌的无性阶段为有丝分裂孢子真菌稻绿核菌[Ustilaginoidea virens(Cke)Tak],有性世代为子囊菌中的稻麦角菌(Claviceps oryzaesativae Hashiok)。该病害在世界产稻区都有发生[1],目前呈加重趋势,它不仅降低水稻产量,严重影响稻米品质[2],而且产生的稻曲病菌毒素,对人、畜有毒,影响人、畜健康[3-4]。
目前对稻曲球的组织生化研究很少,与抗稻曲病相关的生化机制也未见系统的研究。代光辉等[5]报道,抗感病品种中都存在过氧化物酶和木栓质,而且差异不大,可能与抗病性无关;木质素和多酚类物质在抗、感2个品种中也都存在,且抗病品种中的含量明显多于感病品种。木质素和多酚类物质可能在抗病中起着某种作用,有可能作为筛选抗病品种的一个指标。代光辉等观察显示,在稻曲球中存在能发出荧光的“蝴蝶”型结构,稻曲球内不含过氧化物酶、木栓质、木质素和单宁类物质。苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)等防御酶在其他作物病害中对抗病性的影响有较多的报道[6-9]。
本试验用稻曲病菌分生孢子接种不同抗、感病的水稻品种,测定水稻3种酶活性的变化情况,期望从有关酶的生化测定找到与抗病性相关的指标,为抗性鉴定提供参考。
1 材料与方法
1.1 供试品种
在温室内栽培12个抗感程度不同的水稻品种,用直径20 cm、高35 cm的灰塑料桶栽培,每桶栽3株,3次重复。这些供试品种在田间抗性表现从感病到抗病依次为:红莲优6号、两优培九、Ⅱ优58、Ⅱ优 416、新香优 207、汕优 46、威优 207、特优111、金优 191、汕优 63、K 优 817、威优 46。
1.2 接种体的培养
将分离得到的稻曲病菌厚垣孢子挑取到装100 mL马铃薯蔗糖(PS)培养液的三角瓶中,在水平摇床上26℃黑暗条件下130 r/min振荡培养7 d,产生的分生孢子用于接种,浓度为100×视野下200个孢子。
1.3 接种时期与方法
在水稻孕穗末期即破口前3~7 d,用注射器将接种体注射到水稻穗部。接种后温室内用加湿器加湿,温度控制为28℃。
1.4 取样
分别在水稻孕穗末期接种前、接种后 1、3、5、7 d,剪取接种部位进行酶的活性测定。
1.5 与抗性相关的生化指标的测定方法
1.5.1 PAL活性的测定
参照Meyer等[10]的方法。称取待测定材料各1 g,加入 10 mL预冷的酶提取缓冲液(含1 mmol/L EDTA、20 mmol/Lβ-巯 基乙醇和 1%PVP 的0.1 mol/L pH 8.7的PBS)匀浆,4 ℃、10 000 r/min离心20 min。上清液即为酶粗提液。取2.5 mL酶提取液,加50μL 0.6 mmol/L L-苯丙氨酸、100μL 0.1 mol/L p H 8.7的PBS,40℃保温60 min,加入0.2 mL 2 mol/L的 HCl终止反应,测290 nm吸光值,以不加酶液的反应体系标定为 0,以ΔA290/(min·g)FW为一个酶活力单位。分别测定接种前 、接种后1、3、5、7 d 的抗病品种、感病品种和对照的A值,根据 A值,比较不同品种的苯丙氨酸解氨酶的活性情况。
1.5.2 POD活性的测定
参照Chance和Maehly[11]的方法进行测定,称取1 g取样材料,加入预冷的酶提取液10 mL(含1%PVP的 0.05 mol/L、p H 7.0的 PBS)匀浆,10 000r/min、4℃离心 20 min,上清为酶粗提液。在3 mL石英比色皿中加入2.8 mL过氧化物反应液(含0.015 mol/L H 2O2的 0.05 mol/L、p H 7.0的PBS)、0.2 mL过氧化物酶提取液,记其在240 nm的吸光值,测酶活,以不加酶液的反应体系标定为0,以ΔA240/(min·g)为一个酶活力单位。分别测定接种前、接种后 1、3、5、7 d各品种和对照的 A值,根据A值,比较抗病品种、感病品种及对照的过氧化物酶的活性变化情况。
1.5.3 PPO活性的测定
参照文献[12]的测定方法,称取1 g取样材料洗净、擦干并剪碎,加入8 mL冰冷的p H 5.6的柠檬酸-磷酸缓冲液,研磨成匀浆,4℃10 000 r/min离心15 min,上清液为酶提取液,取3.8 mL缓冲液,0.2 mL酶液,1 mL 0.1 mol/L的邻苯二酚,37℃反应30 min,立即用20%的三氯乙酸终止反应,以不加酶液的反应体系标定为0,离心后于420 nm测定其A值,以A值变化0.01为一个酶活性单位。分别测出接种前、接种后 1、3、5、7 d各品种和对照的A值,根据A值,比较抗病品种、感病品种及对照的多酚氧化酶的活性变化情况。
2 结果与分析
2.1 PAL的活性变化
试验结果如图1,接种前各品种相差不大,接种后第1天抗病品种威优46的PAL活性增加了10.5/(min·g),K优817增加了8.9/(min·g);感病品种红莲优6号接种1 d后酶活性稍有下降,感病品种两优培九酶活性也变化不大,以后几天的酶活性都呈下降趋势,且比接种前的还要低,但特优111、K优817、威优46要比接种前的稍高。在接种后1~3 d是酶的变化活跃期。

图1 12个水稻品种接种稻曲病菌后的PAL活性变化
结果表明接种后抗病品种比感病品种的PAL活性增加快,酶活高峰期要高。
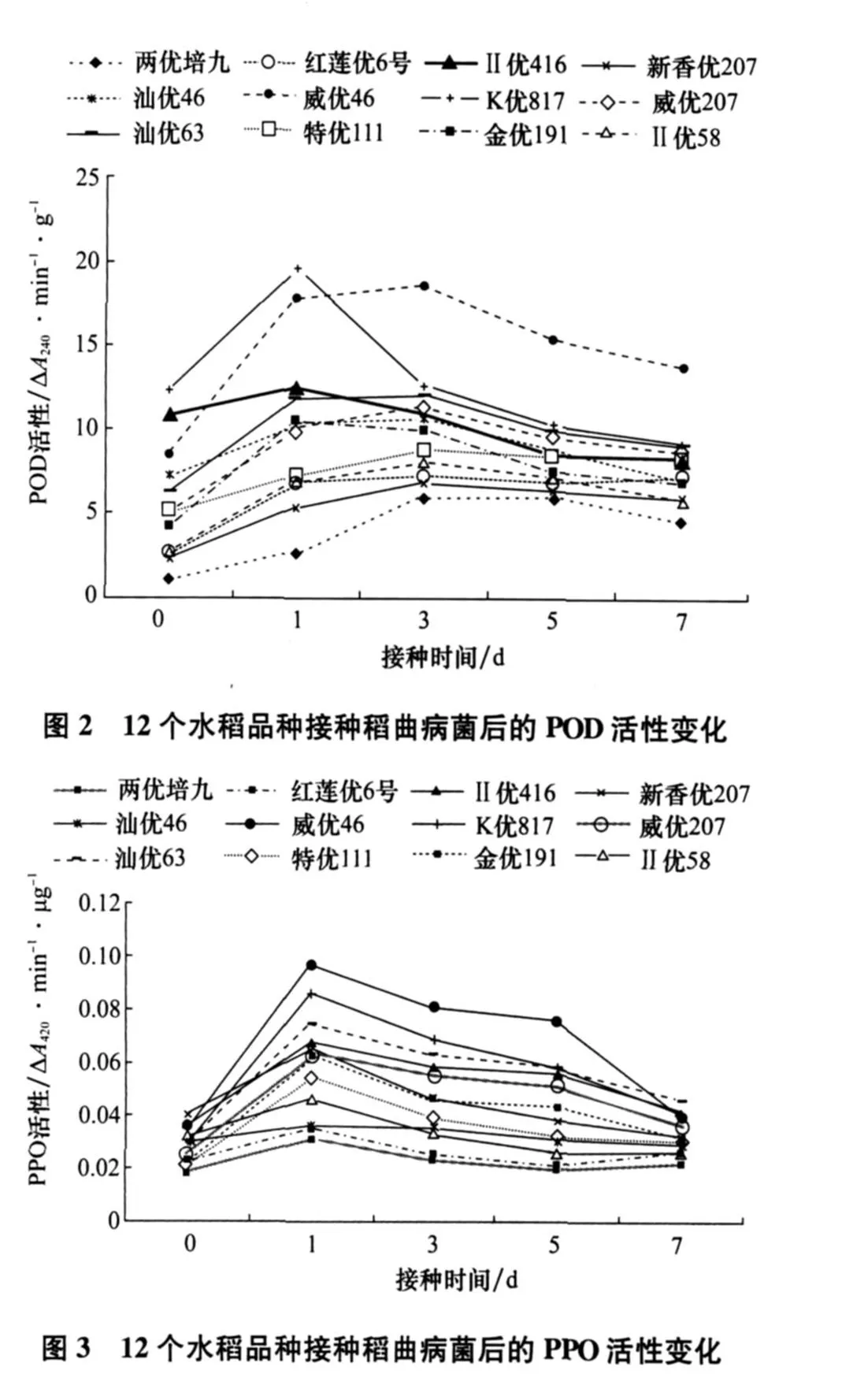
2.2 POD的活性变化
接种后各品种的酶活性都呈上升趋势(图2),尤其是威优46、K优817,接种后第1天酶活性增幅较大,ΔA240分别增加了 9.6、7.3/(min·g);过了高峰期后酶活性又缓慢下降;感病品种两优培九、红莲优6号、特优111接种后酶活性变化不太明显,只是缓慢上升。结果表明,接种后抗病品种比感病品种POD的变化要快,酶活高峰期要高。
2.3 PPO的活性变化
如图3,接种前各品种的PPO活性相差不大,接种后第1天PPO活性达到最高峰,抗病品种威优46、K 优 817、汕优63增幅很大,ΔA420分别增加了0.062、0.056、0.055/(min ·μg),感病品种两优培九、红莲优6号PPO活性增加缓慢。
结果表明,接种后抗病品种比感病品种PPO增加的幅度大,酶活高峰期要高。
3 讨论
各水稻品种接种稻曲病分生孢子后,一些抗病品种如威优46、K优817的PAL、POD、PPO活性在接种后第1天达到最高峰,且变化幅度最大。一些感病品种如两优培九、红莲优 6号接种后PAL、POD、PPO活性变化不很明显,先有少许缓慢上升,然后慢慢下降。根据对12个抗感水平不同的品种接种后的PAL、POD、PPO活性的测定,可以看出抗病品种的这些酶活性在接种后迅速升高,变化幅度较大;而感病品种则比抗性品种的酶活性要低,接种后酶活性缓慢增加,有些甚至下降,变化幅度不明显。有些品种的酶活性变化不稳定,如金优191田间表现为抗病,但接种后PAL、POD活性变化缓慢,PPO活性变化幅度大,原因需进一步研究。本试验得出过氧化物酶与抗病性相关,与代光辉等[5]报道的可能无关不符;他报道的多酚类物质在抗、感2个品种中也都存在,且抗病品种中的含量明显多于感病品种,在本文中得到进一步的证实。
与抗性相关的一些其他生化指标如代光辉等[5]提到的木栓质、木质素和单宁类物质等有待以后进一步研究,以获得更好、更密切的与抗性相关的生化指标。
[1] Ou S H.Ricediseases[M].Kew,Surrey,UK:CAB/CMI,1985:307-311.
[2] Nakamura K,Izumiyama N.Lupinosis in rice caused by ustiloxin and a crudeextract of fungal culture of Ustilaginoidea virens[J].Proc Jpn Assoc Mycot,1992,35:41-43.
[3] Iwasaki S.Chemistry and biological activity of the mycotoxins interfering with tubulin function[J].Proc Jpn Assoc Mycot,1992,35:1-6.
[4] Nakamura K I,Izumiyama N,Ohtsubo K I,et al.“Lupinosis”-like lesionsin mice caused by ustiloxin,p roduced by Ustilaginoidea vir ens:A morphological study[J].Nat Toxins,1994,2(1):22-28.
[5] 代光辉,赵杰,何润梅,等.稻曲病不同抗性水稻品种的组织化学及分生孢子侵染途径的初步观察[J].植物病理学报,2005,35(1):37-42.
[6] 高增贵,陈捷,刘军华,等.拮抗内生细菌B20-006菌株对玉米主要防御酶系的影响[J].植物病理学报,2007,37(1):102-104.
[7] 李海莲,侯喜林,易金鑫,等.黄萎病菌粗毒素接种对感病和抗病茄子品种的一些酶类活性和光合特性的影响[J].植物生理学通讯,2005,41(4):453-456.
[8] 房宝海,张广民,迟长凤,等.烟草低头黑病菌毒素对烟草丙二醛含量和某些防御酶的动态影响[J].植物病理学报,2004,34(1):27-31.
[9] 刘守伟,吴凤芝,马艳玲.枯萎病菌对不同抗性黄瓜品种几种酶活性的影响[J].植物保护,2009,35(1):82-85.
[10]Meyer G,Capieau K,Buchala A,et al.Nanogram amount of salicy lic acid produced by the rhizobacterium Pseudomonas aeruginosa 7NSK2 activates the systemicacqured resistance pathway in bean[J].Mol Plant-Microbe Interact,1999,12:405-410.
[11]Chance B,Meahly A C.Assays of catalase and peroxidase[M]∥Colowick S P,Kaplan N O.Methods of enzymology.Vol II.New York:Academic Press,1995:764-775.
[12]于凤鸣,田文琳.葡萄叶片中多酚氧化酶的研究[J].黑龙江八一农垦大学学报,1999(1):99-101.

