植物富亮氨酸重复类受体蛋白激酶的研究进展*
查笑君, 马伯军, 潘建伟, 杨金水
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.复旦大学 生命科学学院,上海200433)
植物富亮氨酸重复类受体蛋白激酶的研究进展*
查笑君1, 马伯军1, 潘建伟1, 杨金水2
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.复旦大学 生命科学学院,上海200433)
介绍了植物富亮氨酸重复类受体蛋白激酶 (LRR-RLK)的结构与分类;分别以CLAVATA1,BRI1,FLS2为例,阐述了LRR-RLK基因在植物生长发育、激素信号转导和植物抗病防御等方面的生理功能及作用机制;总结了LRR-RLK作用模型、信号通路间的交互作用及展望.
富亮氨酸重复类受体蛋白激酶;植物;功能;作用机制
富亮氨酸重复类受体蛋白激酶 (leucine rich-repeat receptor-like kinases,LRR-RLK,LRK)是植物基因组中已知的最大的一类跨膜类受体激酶 (receptor-like kinases,RLK)亚家族,在拟南芥中已鉴别出这类基因亚家族的 216个成员[1],水稻中已鉴别出 300多个成员[2].LRR-RLK的胞外富亮氨酸结构域与胞外的信号分子如离子、化学小分子或多肽等的特异性结合后,激活胞内激酶结构域的互磷酸化和自磷酸化的活性.这类分子具有类似动物受体蛋白激酶 (receptor protein kinase,RPK)的活性,但是大部分还没分离出与其特异结合的胞外信号分子,故被称为类受体蛋白激酶[1].
1 LRR-RLK的结构与分类
此类基因的结构由胞外 LRR结构域 (LRR domain)、单次跨膜区 (trans-membrane domain,T M)以及胞内激酶结构域 (kinase domain)3部分组成[3](见图 1).其中的 LRR基序具有LxxLxxLxxLxLxxNxLVGxIP[4]的保守序列.保守区内的可变氨基酸决定了其与互作蛋白质(配基)之间结合的特异性.
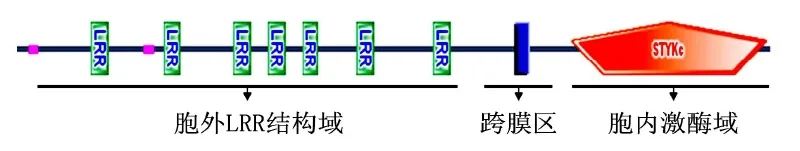
图1 植物 LRR-RLK结构示意图
胞外富亮氨酸重复序列结构域的受体据其胞质内的结构差异分为 3大类.第 1类是富亮氨酸重复序列类受体蛋白激酶LRR-RLK,此类激酶占绝大多数,包括胞外 LRR结构域、跨膜域和胞内苏氨酸/丝氨酸激酶域 3部分.第 2类是富亮氨酸重复序列受体蛋白 LRR-RP(LRR-receptor Proteins),这类蛋白包括胞外LRR结构域,跨膜域,不同的是胞内部分缺失激酶域.功能研究表明 LRRRP与 LRR-RLK类似,在植物的生长发育和抗原识别中具有重要作用,它与 LRR-RLK结合成异源二聚体共同发挥作用.第 3类是富亮氨酸重复序列伸展蛋白 LRX(LRR-extensins),这类蛋白由氮端 LRR结构域及碳端伸展蛋白构成[1].拟南芥和水稻中分别含有 11和 8个 LRX,初步研究表明拟南芥中的 LRX与根毛的形态建成及延伸有关,推测其位于细胞壁中[6].
2 LRR-RLK的生物学功能
LRR-RLK在细胞内的广泛分布及结构特点决定了其功能的重要性.自从第一个LRR-RLK基因从玉米中分离以来,越来越多LRR-RLK基因的功能通过突变体和互补试验得到证实[7].本节将着重介绍LRR-RLK在植物生长发育、激素信号转导和抗病等方面的功能.
2.1 参与植物生长发育
多细胞的组织通过精细而错综复杂的信号网络系统整合信息,调控自身的生长发育.目前,在 LRRRLK参与的植物发育调控途径中,对拟南芥 CLAVATA(CLV)信号通路研究得较为深入.
植物胚胎发育主要由细胞分裂和分化 2个过程组成,正常的发育需要分裂与分化之间保持平衡.通过反向遗传学研究发现,细胞分裂调控与 CLV信号转导有关.CLV信号转导途径主要包括 3个基因CLV1,CLV2和CLV3.CLV1是典型的LRR-RLK基因,由胞外 21个亮氨酸结构域、跨膜区和胞内激酶域 3部分构成.CLV2属于类受体蛋白 (LRR-RP)基因,由胞外 21个亮氨酸结构域和跨膜区组成,但不含胞内激酶域.CLV1功能缺失突变体(clv1)促进细胞增殖,CLV2功能缺失突变体(clv2)显示 CLV1无法在细胞膜上聚集,表明:CLV1基因抑制细胞增殖,CLV2蛋白起到稳定 CLV1的作用,CLV1与 CLV2结合形成稳定的异源二聚体,共同接受外界的信号.CLV3由 96个氨基酸的多肽组成,是 CLV1和 CLV2异源二聚体的配体.CLV3从茎尖中心分裂区分泌,扩散到周围细胞,CLV1感应 CLV3的同时也限制了 CLV3的随意扩散[8-9].CLV1与CLV2共同受体结合 CLV3后抑制促进因子WUS(wuschel)基因的表达.WUS的表达又促进CLV3的分泌 (如图 2所示).
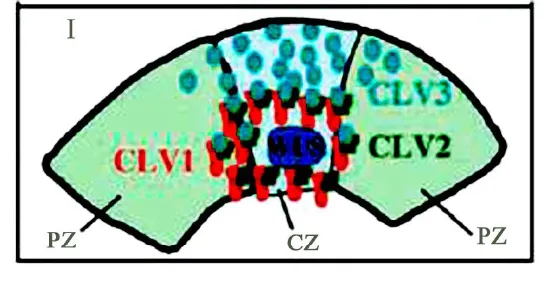
图2 在茎尖分裂组织中心,CLV1与 CLV2结合形成共同受体感受 CLV3的信号示意图[9]
近年来,通过遗传和生化实验分离了 CLV1信号通路的下游组分.许多动物的受体激酶与 Ras亚家族的小 GTPases有关,然后传递给更下游的有丝分裂蛋白激酶MAPKs(mitogen-activated protein kinases)通路.植物中有个与 Ras同源的家族 Rho(Ras homologue),与其相关的 GTPases,简称 Rop(Rho-related GTPase)[10-11].体外免疫共沉淀实验揭示 CLV1与 Rop蛋白可以结合形成复合物[12].另外,参与此信号通路的还有蛋白磷酸酶激酶 (Kinase-associated protein phosphatase,KAPP)和蛋白磷酸酶 POL(POLTERGEIST).实验表明 KAPP在 LRR-RLK蛋白介导的途径中扮演相似的角色,包括 CLV1,FLS2[13]和 HAESA转导的通路[14].
Kim等[15]从水稻中分离了CLV的同源基因OsLRK1,序列分析表明其与CLV基因具有 55%的同源性,组织特异性表达谱显示此基因主要在幼嫩的芽中表达,抑制OsLRK1表达增加了的花器官的数目,其性状与CLV基因在拟南芥中的表现类似.另外,Suzaki等[16]从水稻中分离了CLV1的另一个同源基因FON1,发现它与花序分裂组织发育有关.这些实验结果暗示CLV基因的信号通路在单子叶和双子叶植物中的作用是保守的.
除此之外,在拟南芥中已克隆与发育相关的植物LRR-RLK基因主要有ERECTA[17],HAESA/RLK5[14],EXS/EMS1[18],PRK[19],GASSHO1和GASSHO2[20]等,它们分别在器官大小和形态控制、器官脱落、配子体发育、花粉和柱头的识别以及体细胞胚胎发生等生物过程中起重要作用.从水稻中已分离克隆了LRK1,并证实其与水稻产量和分枝发育有关[5].玉米中此类基因有PAN1和SHB1,分别在细胞不对称分化和胚乳细胞膨大和增殖中起重要作用[21-22].
2.2 参与植物激素信号转导
植物激素对植物的生长发育具有广泛的调节作用,除一些小分子化合物,如细胞分裂素、赤霉素、生长素、油菜素甾醇 (brassinosteroid,BR)等外,20世纪初还发现了一些小分子多肽类激素,如植物硫肽激素 (Phytosulfokine,PSK)、硫化酪氨酸的糖肽 (PSY1)和系统素 (Systemin)等,这些小分子多肽基于配体-受体识别的模式参与细胞与细胞间的交流.目前,对LRR-RLK在 BR信号转导中的研究相对比较深入.
自从 1970年Mitchell等[23]从花粉中分离、鉴定得到 BR这种活性成分以来,利用生化、生理和遗传的手段对 BR进行了研究,已证实 BR影响植物的多种生理功能,包括茎的伸长、花粉管的生长、叶片卷曲和偏上性生长、木质部的分化等[24].文献[25]从拟南芥突变体中分离了BR I1(brassinolide-insensitive 1)基因,并证实其是BR的受体,BR I1基因编码 1 196个氨基酸的富亮氨酸重复序列的膜受体蛋白激酶,属于典型的LRR-RLK家族的基因.2002年,Nam等[26]通过酵母双杂及遗传筛选突变体的方法克隆了BAK1基因,BAK1也是一个富含亮氨酸重复序列的类受体蛋白激酶,Nam等认为BAK1与BR I1在膜上形成异源二聚体感受 BR的信号,类同于 CLV1和 CLV2的作用模式.文献[27]从拟南芥中克隆了B IN2(Brassinosteroid-insensitive)基因,其属于 GSK家族,并证实 B IN2是催化下游信号转导蛋白磷酸化并抑制BR信号转导的酶,在植物感受 BR后 B IN2即失活.遗传和生化研究表明:B IN2通过磷酸化几个序列相似的核蛋白如 BES1(BR I1-EMS-suppressor 1)和 BZR1(Brassinazole-resistant 1)调控 BR的信号转导.
综上,BR的信号转导途径如下:当外界存在 BR时,BR I1与 BAK1形成异源二聚体感受外界信号,将信号传至胞内,抑制 B IN2的表达,导致 BES1和 BZR1去磷酸化后在核内大量积累,从而调控 BR相关基因的表达;当外界不存在 BR信号时,BR I1与 BAK1处于失活状态,B IN2催化 BES1和 BZR1磷酸化,使之被蛋白酶识别降解,从而抑制了 BR的信号转导[28].在这个途径中,接受 BR的 2个膜受体基因BR I1与BAK1皆属于LRR-RLK基因家族成员 (如图 3所示).
目前,对小分子多肽类激素的生物学功能的研究也受到广泛关注,如含 5个氨基酸的小肽——植物硫肽激素 (PSK),PSK在细胞增殖和去分化过程中起着重要作用.Matsubayashi等[29]通过亲和膜色谱技术,从胡萝卜 (Daucus carota)中分离纯化了与 PSK特异结合的 120 kD的膜蛋白 DcPSKR1,DcPSKR1编码一个1 021氨基酸的受体蛋白,包括膜外的富亮氨酸重复序列、单跨膜区和胞内激酶域.通过对 PSK进行[3H]标记的响应实验,发现胡萝卜细胞过量表达该受体激酶能显著地提高 PSK结合位点数[29],并确定配基 PSK结合域为DcPSKR1的 Glu503-Lys517[30].近来,研究人员又在拟南芥细胞悬浮培养的培养基中分离得到了一个长为 18氨基酸的硫化酪氨酸的糖肽,命名为 PSY1,能促进细胞的增殖,并在拟南芥不同组织广泛地表达.AtPSY1的识别同样也依赖于一个富含亮氨酸重复序列的类受体激酶(At1g72300)[31].

图3 植物中BR信号转导模型[28]
2.3 参与植物抗病
植物抗病一般是指识别外界病原物,然后快速启动抗性反应的过程.近来发现许多由外界诱导的抗性反应及 R-基因介导的免疫反应都与LRR-RLK基因有关.最典型的例子是水稻抗白叶枯病的Xa21基因、拟南芥中感受鞭毛蛋白的FLS2基因等.另外,LRR-RLK基因家族还在抗盐等方面起作用[32].这些都显示LRR-RLK家族成员广泛参与植物的防御和对病原微生物的识别.
LRR-RLK基因家族中最早发现具有抗病功能的是FLS2(flagellin sensitive 2)基因,该基因广泛分布于植物的组织器官中,包括花、叶、茎和根等;采用荧光蛋白示踪法将它定位于细胞外围,比如气孔等病原微生物的入口.FLS2通过胞外的LRR结构域识别病原菌的鞭毛蛋白,介导植物的免疫反应[33].最近确定了识别鞭毛蛋白的位置为胞外第 9~15个 LRR[34].植物在植食性损伤口分泌信号分子系统素 (一种 18肽信号分子),从而启动防御基因的系统表达.系统素的感受依赖于膜受体基因SR160(16 kD的LRR-RLK基因),其与拟南芥中的 BR I1同源性高达 90%[35].2006年,在拟南芥中发现了一个新的内源多肽 AtPep1(23肽),具有识别病原微生物、引起植物免疫应答的能力[36].同年,Yamaguchi等[37]分离了AtPep1的膜受体 PEPR1蛋白,同样具有LRR-RLK的结构.所以,LRR-RLK基因家族广泛参与外源、内源病原微生物的识别.植物的另一种防御机制是由一些具有抗性功能的基因 (简称 R基因)介导的,R基因在转基因植株中过表达可使寄主在没有病原物的存在下诱发获得性免疫抗性 (systemic acquired resistence,SAR).如Xa21,Xa3/Xa26等水稻白叶枯病 (Xoo)抗性基因,前者在水稻的生长过程中抗性从无到有逐渐增强,而后者在植物生长过程中具有持续性抗性[38-39].目前,我们对植物被侵染后体内的信号转导通路尚知之甚少.对FLS2,Xa21基因的研究发现,它们的作用机制与泛素化有关[40].
另外,有意思的是,一些在植物生长发育过程中起重要调控作用的基因同时也参与抗病防御.例如:ERECTA不仅调控花序发育和气孔分布[41],而且还具有抵御细菌性 (Ralstonia solanacearum)委焉病的功能[42-43];BAK1/SERK3不仅与 BR I1互作参与油菜素内酯的信号转导,而且与 FLS2形成复合物参与植物的抗病反应[26,44],还参与光反应、细胞凋亡等途径[45].这些例子揭示LRR-RLK基因家族对激素信号的转导、抗病反应的调控在某种程度上存在交互作用(cross-talk).
3 小 结
目前,对富亮氨酸类蛋白激酶受体作用机制的研究表明:其通过胞外 LRR结构域感受外界信号,然后通过胞内的激酶域传递信号.对 CLV和 BR通路的研究,揭示 LRR-RLK通常与其他蛋白形成异源二聚体在细胞膜上共同感受信号、履行功能.LRR-RLK在接受外界或内源的信号后,经转导输入或输出相应信号,从而指导植物细胞对胞内外的信号作出相应的反应.就像动物一样,植物通过受体开启错综复杂的信号通路,信号通路间可以互相作用或者形成反馈环使多个复杂的单元联合在一起指导目标基因的转录.在植物中,LRR-RLK家族存在基因冗余的现象,很难完全阐释 LRR-RLK蛋白的功能.在拟南芥和水稻中都存在上百个LRR-RLK基因,目前只有少数几个基因的生物学功能被鉴定.相信在不久的将来,越来越多的LRR-RLK基因将被鉴定.
[1]Torii KU.Leucine-rich repeat receptor kinases in plants:structure,function,and signal transduction pathways[J].Int Rev Cytol,2004,234(243):1-46.
[2]Shiu S H,KarlowskiW M,Pan Runsun,et al.Comparative analysis of the receptor-like kinase family inArabidopsisand rice[J].Plant Cell,2004,16(5):1220-1234.
[3]Shiu S H,BleeckerA B.Receptor-like kinases fromArabidopsisform a monophyletic gene family related to animal receptor kinases[J].Proceedings of the NationalAcademy of Sciences of the United States ofAmerica,2001,98(19):10763-10768.
[4]Kobe B,Deisenhofer J.A structural basis of the interactions between leucine-rich repeats and protein ligands[J].Nature,1995,374(6518):183-186.
[5]Zha Xiaojun,Luo Xiaojin,Qian Xiaoyin,et al.Over-expression of the rice LRK1 gene improves quantitative yield components[J].Plant Biotechnology Journal,2009,7(7):611-620.
[6]BaumbergerN,Doesseger B,Guyot R,et al.Whole-genome comparison of leucine-rich repeat extensins inArabidopsisand rice.A conserved family of cellwall proteins form a vegetative and a reproductive clade[J].Plant Physiol,2003,131(3):1313-1326.
[7]Walker J C,ZhangRen.Relationship of a putative receptorprotein-kinase from maize to the S-locus glycoproteinsofB rassica[J].Nature,1990,345(6277):743-746.
[8]LenhardM,Laux T.Stem cell homeostasis in theArabidopsisshootmeristem is regulated by intercellularmovement of CLAVATA3 and its sequestration by CLAVATA1[J].Development,2003,130(14):3163-3173.
[9]DievartA,Clark S E.LRR-containing receptors regulating plant development and defense[J].Development,2004,131(2):251-261.
[10]Li Hai,Wu Guang,Ware D,et al.ArabidopsisRho-related GTPases:differential gene expression in pollen and polar localization in fission yeast[J].Plant Physiology,1998,118(2):407-417.
[11]W inge P,Brembu T,BonesAM.Cloning and characterization of rac-like cDNAs fromArabidopsis thaliana[J].PlantMolecularBiology,1997,35(4):483-495.
[12]Trotochaud A E,Hao Tong,Wu Guang,et al.The CLAVATA1 receptor-like kinase requiresCLAVATA3 for its assembly into a signaling complex that includes KAPP and a Rho-related protein[J].Plant Cell,1999,11(3):393-406.
[13]G∏mez-G∏mezL,Bauer Z,Boller T.Both the extracellular leucine-rich repeat domain and the kinase activity of FLS2 are required for flagellin binding and signaling inArabidopsis[J].Plant Cell,2001,13(5):1155-1163.
[14]Jinn TL,Stone J M,Walker J C.HAESA,anArabidopsisleucine-rich repeat receptor kinase,controls floral organ abscission[J].Genes&Development,2000,14(1):108-117.
[15]Kim C H,JeongD H,An G H.Molecular cloning and characterization ofOsLRK1 encoding a putative receptor-like protein kinase from Oryza sativa[J].Plant Science,2000,152(1):17-26.
[16]Suzaki T,SatoM,AshikariM,et al.The gene FLORAL ORGAN NUMBER1 regulates floralmeristern size in rice and encodes a leucine-rich repeat receptor kinase orthologous toArabidopsisCLAVATA1[J].Development,2004,131(22):5649-5657.
[17]Torii KU,Mitsukawa N,Oosumi T,et al.TheArabidopsisERECTA gene encodes a putative receptor protein kinase with extracellular leucinerich repeats[J].Plant Cell,1996,8(4):735-746.
[18]Canales C,BhattA M,Scott R,et al.EXS,a putative LRR receptor kinase,regulatesmale ger mline cell number and tapetal identity and promotes seed development inArabidopsis[J].CurrentBiology,2002,12(20):1718-1727.
[19]Muschietti J,Eyal Y,Mccormick S.Pollen tube localization implies a role in pollen-pistil interactions for the tomato receptor-like protein kina-sesLePRK1 and LePRK2[J].Plant Cell,1998,10(3):319-330.
[20]Tsuwamoto R,Fukuoka H,Takahata Y.GASSHO1 and GASSHO2 encoding a putative leucine-rich repeat trans membrane-type receptor kinase are essential for the normal development of the epidermal surface inArabidopsisembryos[J].Plant Journal,2008,54(1):30-42.
[21]Cartwright H N,Humphries J A,Smith L G.PAN1:a receptor-like protein that promotes polarization of an asymmetric cell division in maize[J].Science,2009,323(5914):649-651.
[22]Zhou Yun,Zhang Xiaojuan,Kang Xiaojun,et al.SHORT HYPOCOTYL UNDER BLUE1 associates with MIN ISEED3 and HA IKU2 promoters in vivo to regulateArabidopsisseed development[J].Plant Cell,2009,21(1):106-117.
[23]Mitchell J W,Mandava N,Worley J F,et al.Brassins:a New Family of Plant Hormones from Rape Pollen[J].Nature,1970,225(5237):1065-1068.
[24] Iwasaki T,Shibaoka H.BrassinosteroidsAct as Regulators of Tracheary-Element Differentiation in Isolated Zinnia Mesophyll-Cells[J].Plant and Cell Physiology,1991,32(7):1007-1014.
[25]Li Jianming,Chory J.A putative leucine-rich repeat receptor kinase involved in brassinosteroid signal transduction[J].Cell,1997,90(5):929-938.
[26]Nam K H,Li Jianming.BR I1/BAK1,a receptor kinase pairmediating brassinosteroid signaling[J].Cell,2002,110(2):203-212.
[27]Li Jianming,Nam K H,VafeadosD,et al.B IN2,a new brassinosteroid-insensitive locus inArabidopsis[J].Plant Physiology,2001,127(1):14-22.
[28]Li Jianming,Jin Hua.Regulation of brassinosteroid signaling[J].Trends in Plant Science,2007,12(1):37-41.
[29]Matsubayashi Y,OgawaM,MoritaA,et al.An LRR receptor kinase involved in perception of a peptide plant hormone,phytosulfokine[J].Science,2002,296(5572):1470-1472.
[30]Shinohara H,OgawaM,Sakagami Y,et al.Identification of ligand binding site of phytosulfokine receptor by on-column photoaffinity labeling[J].The Journal ofBiological Chemistry,2007,282(1):124-131.
[31]Amano Y,Tsubouchi H,Shinohara H,et al.Tyrosine-sulfated glycopeptide involved in cellular proliferation and expansion inArabidopsis[J].Proceedings of the NationalAcademy of Sciences of the United States ofAmerica,2007,104(46):18333-18338.
[32]Liu Jiping,Zhu Jiankang.A calcium sensor homolog required for plant salt tolerance[J].Science,1998,280(5371):1943-1945.
[33]G∏mez-G∏mezL,Boller T.Flagellin perception:a paradigm for innate immunity[J].Trends in Plant Science,2002,7(6):251-256.
[34]Dunning FM,SunW,Jansen K L,et al.Identification and mutational analysis ofArabidopsisFLS2 leucine-rich repeat domain residues that contribute to flagellin perception[J].Plant Cell,2007,19(10):3297-3313.
[35]Scheer JM,Ryan C A Jr.The systemin receptor SR160 from Lycopersicon peruvianum is amemberof theLRR receptor kinase family[J].Proceedings of the NationalAcademy of Sciences of the United States ofAmerica,2002,99(14):9585-9590.
[36]HuffakerA,Pearce G,Ryan C A.An endogenous peptide signal inArabidopsisactivates components of the innate immune response[J].Proceedings of the NationalAcademy of Sciences of the United States ofAmerica,2006,103(26):10098-10103.
[37]Yamaguchi Y,Pearce G,Ryan C A.The cell surface leucine-rich repeat receptor forAtPep1,an endoaenous peptide elicitor inArabidopsis,is functional in transgenic tobacco cells[J].Proceedings of the NationalAcademy of Sciences of the United States ofAmerica,2006,103(26):10104-10109.
[38]SongWenyuan,Wang Guoliang,Chen Lili,et al.A Receptor Kinase-Like Protein Encoded by the Rice Disease Resistance Gene,Xa21[J].Science,1995,270(5243):1804-1806.
[39]Cao Yinglong,Duan Liu,Li Hongjing,et al.Functional analysis of Xa3/Xa26 family members in rice resistance to Xanthomonas oryzae pv.oryzae[J].Theoretical and Applied Genetics,2007,115(7):887-895.
[40]Goff K E,Ramonell KM.The role and regulation of receptor-like kinases in plant defense[J].Gene Regulation and Systems Biology,2007,1(1):167-175.
[41]Shpak E D,Mcabee JM,PillitteriL J,et al.Stomatalpatterning and differentiation by synergistic interactionsof receptor kinases[J].Science,2005,309(5732):290-293.
[42]Godiard L,Sauviac L,Torii KU,et al.ERECTA,an LRR receptor-like kinase protein controlling development pleiotropically affects resistance to bacterialwilt[J].Plant Journal,2003,36(3):353-365.
[43]Van ZantenM,Snoek L B,Proveniers MC,et al.The many functions of ERECTA[J].Trends in Plant Science,2009,14(4):214-218.
[44]Chinchilla D,Zipfel C,Robatzek S,et al.A flagellin-induced complex of the receptor FLS2 and BAK1 initiates plant defence[J].Nature,2007,448(7152):497-500.
[45]Chinchilla D,Shan Libo,He Ping,et al.One for all:the receptor-associated kinase BAK1[J].Trends in Plant Science,2009,14(10):535-541.
Research advances in leucine-rich repeat receptor-like protein kinases in plants
ZHA Xiaojun1, MA Bojun1, PAN Jianwei1, YANG Jinshui2
(1.College of Chem istry and Life Science,Zhejiang No rmalUniversity,Jinhua Zhejiang 321004,China;2.School of Life Sciences,Fudan University,Shanghai 200433,China)
Itwas focused on the structure and kinds of leucine-rich repeat receptor-like kinases(LRR-LRKs)in higherplants and their biological functions in regulation ofplant development,hormone signaling and defensive responses.Functionalmechanis ms,crosstalk among different signaling pathways and the prospects for the LRR-RLKswere also discussed.
leucine-rich repeat receptor-like kinases;plants;functions;mechanis ms
Q946.5
A
1001-5051(2010)01-0007-06
2009-12-28
查笑君 (1979-),女,浙江浦江人,讲师,博士.研究方向:植物分子遗传学.
(责任编辑 薛 荣)

