三氧化二砷对肿瘤血管内皮细胞增殖、迁移、血管形成及其凋亡的影响
傅文达,王雪雯,张建华
(石河子大学医学院/新疆地方与民族高发病教育部重点实验室,石河子832002)
三氧化二砷对肿瘤血管内皮细胞增殖、迁移、血管形成及其凋亡的影响
傅文达,王雪雯,张建华
(石河子大学医学院/新疆地方与民族高发病教育部重点实验室,石河子832002)
为了探讨三氧化二砷(As2O3)对肿瘤血管内皮细胞增殖、迁移、血管形成及其凋亡的机制,采用肝癌Hep G2细胞上清诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)成为肿瘤血管内皮细胞(tumor-derived endothelial cells,Td-EC),通过细胞迁移、流式细胞术、血管形成实验检测As2O3对HUVEC与Td-EC增殖、迁移、血管形成及其凋亡的影响。结果显示,在同样条件下与HUVEC相比,As2O3在体外抑制Td-EC增殖、迁移和血管的形成及其促进凋亡的作用显著。结论:As2O3在体外可特异地抑制Td-EC增殖、迁移、血管形成及其凋亡。
As2O3;肿瘤血管内皮细胞;凋亡;迁移;血管形成
实质肿瘤的增长依赖于血管新生,新生血管为肿瘤提供营养和氧气,并能带走代谢产物,因而抗肿瘤的血管治疗成为目前治疗肿瘤的研究方向之一[1]。三氧化二砷(As2O3)是我国传统中药,能够抑制血管内皮细胞增殖,促进凋亡。
本研究中,我们将探讨As2O3体外抗血管形成的效应,以期揭示其对肿瘤血管内皮细胞生长及相关功能的影响。
1 材料与方法
1.1 细胞培养
参照文献[2]中的方法进行。脐带取自石河子大学第一附属医院妇产科的健康、足月剖宫产胎儿,以胰酶灌注法分离脐静脉血管内皮细胞,用ECM培养传代,免疫荧光法检测Ⅷ因子相关抗原以鉴定HUVEC。人肝癌Hep G2细胞用含10%新生牛血清的DMEM液培养至70%汇合时,换成无血清的DMEM液再培养48 h。收集培养上清液,经0.22μm滤膜过滤后,于-80℃保存备用。取第3代HUVEC,用含体积分数50%Hep G2细胞培养上清的ECM培养,汇合至80%时收集细胞,即为肿瘤血管内皮细胞(Td-EC),并可培养传代。
1.2 RT-PCR检测TEM1和TEM8
以正常HUVEC为对照组,按Trizol法提取总RNA。根据TEM1及TEM8的c DNA设计引物,并由上海生物工程技术有限公司合成。扩增TEM1基因片段为287 bp,上游引物:5′-TCGAGTGTTATTGTAGCGAGGGACATG -3′,下游引物:5′-AGGTGGGCTCCGGGTAGGGTAT-3′;扩增 TEM8 基因片段为462 bp,上 游 引 物:5′-CGGATTGCGGACAGTAAGG-3′,下 游 引 物:5′-GCCAGAACCACCAGAGGAG-3′;按Fer mentas RT-PCR试剂盒的说明书进行扩增。凝胶电泳成像系统摄像。
1.3 内皮细胞迁移
参照文献[3]中的方法,将小室放入24孔培养板中,在上室加入300μL预温的无血清培养基,室温下静置15~30 min,吸去剩余培养液,24孔板下室加入600μL含ECM培养基,放入小室,取细胞悬液1.0×105/mL 200μL加入Transwell小室,常规培养48 h后,95%酒精常温固定30 min,0.1%结晶紫常温染色10 min,清水漂净,取5个视野计数细胞个数,并取其均数,将上室液更换为2μmol/L As2O3的培养液,重复以上实验步骤,研究As2O3对内皮细胞迁移特性的影响。
1.4 流式细胞检测细胞凋亡
将HUVEC、Td-EC内皮细胞各分为2组,共4组,每组3孔接种到6孔板内。24 h后,HUVEC及Td-EC实验组换为2μmol/L As2O3无血清培养液,其余2组为对照组,培养48 h后,以0.25% 胰酶消化,收集细胞,800 r/min离心5 min,0.01 mol/L PBS漂洗3次,吹打成单细胞悬液,计数调整细胞浓度为2.0×105/mL,Annexin V-FITC/PI双染,以激发光488 n m,检测光610 nm流式细胞仪检测细胞凋亡率。
1.5 血管形成实验
在24孔板中加入40μL matrigel胶(按1∶2比例与预冷无血清DMEM混合),置于室温下30 min,待其凝固。将 HUVEC、Td-EC按1.5×105/mL接种于此,每4 h观察1次管腔形成情况,12 h终止。培养基中加入2μmol/L As2O3继续培养48 h后观察。每孔取10个视野计数,取其平均数。
1.6 绘制细胞生长曲线
取96孔板,每孔加,3×105/mL单细胞悬液,加入干预因素2μmol/L As2O3,对照组为10%胎牛血清的DMEM培养基培养,每组设3个复孔,每天每组3个孔,每组先吸出培养基,PBS冲洗3次,加入0.25%胰酶消化并吹打,血球计数板计数,共7 d,取其均数,并绘制生长曲线。
1.7 数据处理
2 结果与分析
2.1 HUVEC的分离培养及鉴定
细胞接种24 h后,普通光镜下可见细胞贴壁,初长出的细胞为梭形,第3-5天,细胞长成片,中心排列紧密部分可见呈典型铺路石样排列的单层细胞(图1a)。培养的细胞经荧光免疫染色后,共聚焦显微镜下可见细胞质内有绿色荧光,细胞内有内皮细胞特有的人Ⅷ因子相关抗原存在(图1b)。

图1 诱导前后HUVEC的观测结果Fig.1 Observations of HUVEC induced before and after
2.2 肿瘤血管内皮细胞的诱导生成及鉴定
经诱导后的成为Td-EC细胞核变大,细胞质丰富,增殖更快(图1c),并可以继续传代培养。RTPCR扩增产物的电泳结果见图2。

图2 TEM1和TEM8在HUVEC、Td-EC中的表达Fig.2 Expression of TEM1 and TEM8 in HUVEC and Td-Ec
由图2可知,从Td-EC中能扩增出约287 bp及460 bp的条带(图2),说明HUVEC经Hep G2细胞培养上清诱导后,细胞表达TEM1和TEM8,这是肿瘤血管内皮细胞特有的表达抗原,故诱导细胞具备了肿瘤血管内皮细胞的特性。
2.3 内皮细胞迁移试验
由图3和表1可见,HUVEC、Td-EC分别加入As2O3培养前后二者差异显著(P<0.01),而两细胞加入As2O3培养二者间差有统计学差异 (P<0.05),且正常HUVEC细胞与Td-EC细胞比较差异显著(P<0.05)。这表明Td-EC细胞较正常内皮细胞具有更强的迁移能力,利于肿瘤的血管新生,As2O3能显著抑制Td-EC的迁移能力。
表1 各分组HUVEC、Td-EC迁移细胞数,n=5Tab.1 The migration of HUVEC and Td-Ec in different groups

表1 各分组HUVEC、Td-EC迁移细胞数,n=5Tab.1 The migration of HUVEC and Td-Ec in different groups
注:a为加药组与空白组,P<0.01;b为两细胞用药组P<0.05,c:空白组之间P<0.05。
?
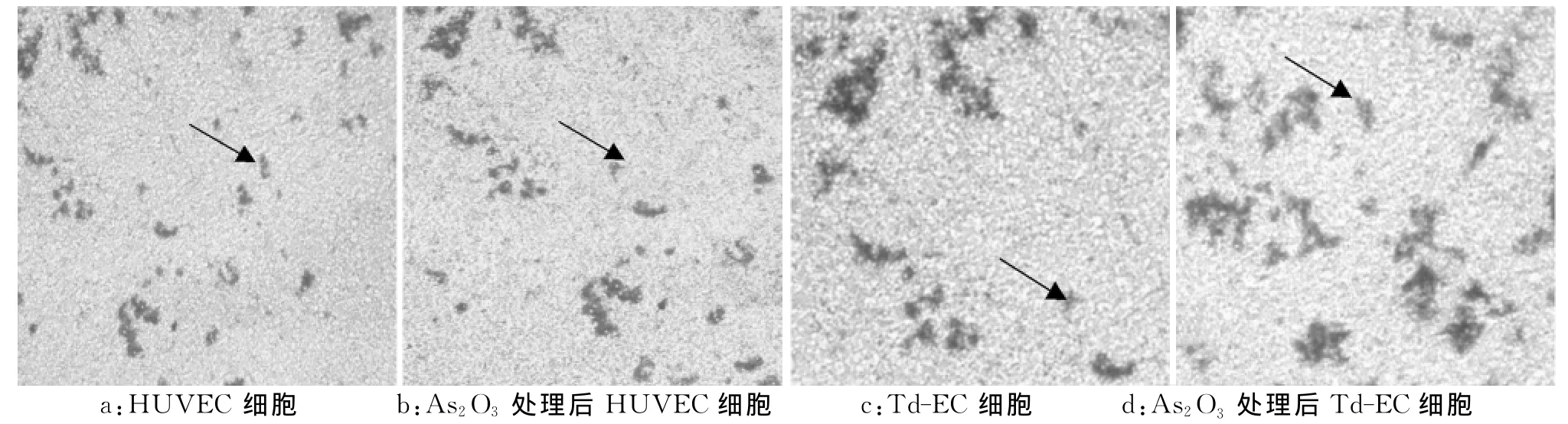
图3 As 2 O3 对HUVEC、Td-EC细胞迁移的影响(10×40)Fig.3 Effects of As2 O3 in migration of HUVEC and Td-EC cells
2.4 流式细胞检测细胞凋亡
由图4和表2可见,As2O3加入前后的HUVEC与Td-EC间早期凋亡率比较差异显著(P<0.05),而空白组 Td-EC较 HUVEC低(P<0.05)。
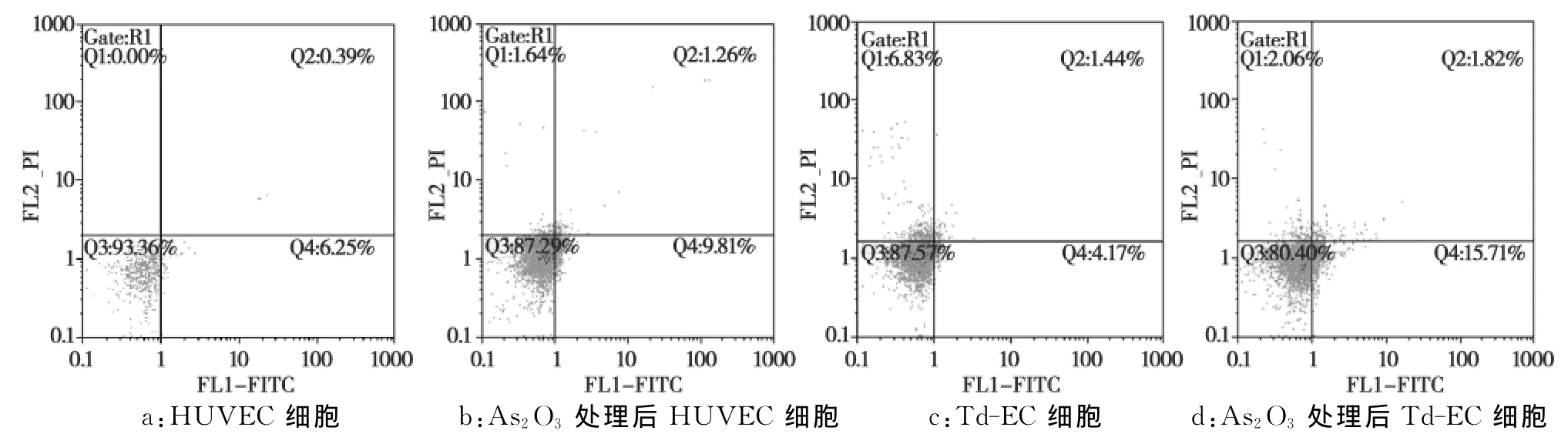
图4 As2 O3对HUVEC、Td-EC凋亡的影响Fig.4 Effect of As2 O3 on apoptosis in HUVEC and Td-EC
表2 各分组HUVEC、Td-EC凋亡率,n=3Tab.2 Apoptosis of HUVEC and Td-EC in diffcrent groups

表2 各分组HUVEC、Td-EC凋亡率,n=3Tab.2 Apoptosis of HUVEC and Td-EC in diffcrent groups
注:a为加药组与空白组,P<0.05;b为两细胞用药组,P<0.05;c为空白组之间,P<0.05。
?
2.5 血管形成实验
加入As2O3前后培养的HUVEC和Td-EC管腔形成的数目有统计学差异(P<0.01),且空白组的 HUVEC与Td-EC细胞有统计学差异(P<0.05)(图5)。这表明Td-EC细胞较正常内皮细胞具有更强的血管形成能力,利于肿瘤的生长和转移,As2O3能显著抑制Td-EC的血管形成能力,且比对正常内皮细胞的影响更显著。
表3 各分组的HUVEC、Td-EC管腔形成数,n=10Tab.3 The cavity number of HUVEC and Td-EC in different groups

表3 各分组的HUVEC、Td-EC管腔形成数,n=10Tab.3 The cavity number of HUVEC and Td-EC in different groups
注:a为加药组与空白组,P<0.01;b为两细胞用药组,P<0.05;c为空白组之间,P<0.05。
?

图5 As 2 O3 对HUVEC、Td-EC血管形成的影响(10×40)Fig.5 Effect of As 2 O3 on neovascularization in HUVEC and Td-EC(10×40)
2.6 细胞生长曲线
通过对HUVEC和Td-Ecd增殖对比研究显示,加入As2O3前后,HUVEC和Td-EC的增殖均明显受到抑制,且Td-EC受到的抑制更明显(P<0.05),而空白组的Td-EC增殖比 HUVEC更明显(P<0.05)(图6)。

图6 As 2 O3对HUVEC、Td-EC生长的影响Fig.6 Effect of As2 O3 on the growth of HUVEC and Td-EC
3 讨论
人脐静脉内皮细胞被公认为研究抗血管形成机制的细胞水平的标准模型[3],但肿瘤血管内皮细胞和人脐静脉内皮细胞仍存在不同,如:形态、表型、功能及基因的表达上存在差异,且由于肿瘤血管内皮细胞属微血管内皮细胞,含量极少,分离复杂,体外培养困难,且费用昂贵,限制了研究的开展。所以,找到合适的实验模型对于抗肿瘤研究至关重要。本研究参照向邦德等[2]报道的方法,采用肝癌Hep G2细胞培养上清刺激HUVEC生长的方法来得到肿瘤血管内皮细胞,在与肿瘤细胞上清混合培养环境中,HUVEC细胞生长环境类似在体肿瘤内血管。本研究中,HUVEC与肝癌Hep G2细胞上清共培养3~5 d后,检测到细胞表达TEM1和TEM8肿瘤血管内皮细胞特异性抗原,通过实验证实Td-EC有较强的增殖和迁移能力,与HUVEC比较差异显著,说明刺激后生成的内皮细胞具有肿瘤血管内皮细胞的特性。有研究发现,通过人肺腺癌A549细胞培养上清液培养HUVEC亦能具有肿瘤血管内皮细胞的特性[5],而通过对A549细胞培养上清液的研究表明,在上清液中包含多种生长因子,如VEGF、b FGF等,继而改变HUVEC增殖调控,是细胞增殖更活跃[6],这可能也是肝癌Hep G2细胞培养上清刺激HUVEC具有肿瘤血管内皮细胞特性的机制。所以,Td-EC作为研究As2O3在体外抗血管生成作用机制的研究模型,比HUVEC更具有代表性。
本研究证实As2O3在体外对于肿瘤血管内皮细胞,在细胞迁移、增殖、凋亡及血管形成等多方面有显著抑制作用,相对正常内皮细胞影响明显,这对于探讨As2O3抑制肿瘤血管的生长有重要意义。很多实验都证实[7-8],As2O3能显著抑制 HUVEC的增殖并可促进凋亡,动物实验证实可以抑制实体移植肿瘤生长,以及抑制血管新生等方面都有显著的作用。但是,目前对于血管内单个的肿瘤血管内皮细胞的作用效应的相关研究少有报道。在临床用药中As2O3血药浓度为1.0~4.0μmol/L,而前期研究[9]也发现As2O3浓度≤1.0μmol/L时,可以促进Hep G2细胞的增殖,浓度≥2.0μmol/L则抑制Hep G2细胞增殖,故本实验 As2O3浓度取2.0 μmol/L,该浓度既能抑制内皮细胞的增殖,同时对肿瘤细胞的增殖亦有抑制作用。经肝癌Hep G2细胞培养上清刺激HUVEC生长的方法来得到肿瘤血管内皮细胞,能高表达VEGFR2[2],而 As2O3可以通过VEGF信号传导途径影响肿瘤内皮细胞的功能[10],这可能是 As2O3对 Td-EC作用更明显的原因。该研究可为As2O3临床抗肝癌治疗提供理论基础和实践意义。
[1]Folk man J.Tumor angiogenesis:therapeutic i mplieations[J].N Engl J Med,1971,285(21):1182-1186.
[2]向邦德,吕明德,黄吉夫,等,诱导正常内皮细胞具备肿瘤血管特性的研究[J].中山大学学报:医学科学版,2005,26(3):354-357.
[3]蒋力,何勇,蒋耀光.Endostar对肿瘤血管内皮细胞生长及功能的抑制作用[J].第三军医大学学报,2009,13(21):2069-2072.
[4]Capillo M,Mancuso P,Gobbi A,et al.Continuous infusion of endostatin inhibits differentiation,mobilization,and clonogenic potential of endothelial cell progen-itors[J].Clin Cancer Res,2003,9(1):377-382.
[5]蒋力,何勇,蒋耀光,肿瘤源性血管内皮细胞的培养及其细胞生物学特性鉴定[J].重庆医学,2009,38(24):3102-3105.
[6]Wang J M,Ku mar S,Pye D,et al.A monoclonal antibody detects heterogeneity in vascular end othelium of tumors and normal tissues[J].Int J Cancer,1993,54(3):363-366.
[7]孟建波,王金铠,张金巧,等,三氧化二砷对人脐静脉内皮细胞作用的研究[J].河北医药,2008,30(3):288-290.
[8]陈玺,肖延风,刘陕西,等.三氧化二砷对血管内皮细胞增殖和周期的影响[J].陕西医学杂志,2008,37(6):651-653.
[9]高明,王雪雯.不同浓度的As2O3对肝癌细胞生长及VEGF表达的影响[J].农垦医学,2008,30(1):7-9.
[10]崔永安,秦叔逵,陈惠英,等,三氧化二砷对肝癌诱导血管内皮细胞相关基因蛋白表达的影响[J].世界华人消化杂志,2005,13(9):1142-1144.
Arsenic Trioxide Impacted on Tumor Vascular Endothelial Cell Proliferation,Migration,Angiogenesis and Apoptosis
FU Wenda,WANG Xuewen,ZHANG Jianhua
(Medical College,Shihezi University/Key Laboratory of Xinjiang Endemic and Echnic Diseases,Shihezi 832002,China)
To study the mechanism of arsenic trioxide(As2O3)on tumor vascular endothelial cell proliferation,migration,angiogenesis and apoptosis,the cells differentiated into tumor-derived endothelial cells(Td-ECs)by co-culturing with supernatants of Hep G2 cells,the anti-effect of As2O3on Td-ECs and HUVEC was detected with cell migration,flow cytometry,blood vessel formation assay.The results showed t hat As2O3effected on Td-EC in vitro promote apoptosis,and inhibited their migration and blood vessel formation,was more significant than under the same conditions over HUVEC.Conclusion is that As2O3in vitro specifically inhibit Td-EC proliferation,migration,angiogenesis and pro mote apoptosis.
As2O3;tumor-derived endothelial cells;apoptosis;migration;angiogenesis
R735.7
A
1007-7383(2011)05-0598-05
2011-05-06
国家自然科学基金项目(81060174)
傅文达(1978-),男,硕士生,专业方向为抗肝癌血管新生;e-mail:f uwenda_1117@sina.com。
王雪雯(1962-),女,教授,从事肿瘤血管病理生理学研究;e-mail:263@shzu.edu.cn。

