红葡萄酒花色苷结构和颜色的关系研究进展
韩富亮, 李杨, 李记明, 徐 岩*
(1.江南大学生物工程学院,江苏无锡 214122;2.食品科学与技术国家重点实验室,江苏无锡,214122;3.烟台张裕葡萄酿酒股份有限公司,山东烟台 264000)
红葡萄酒花色苷结构和颜色的关系研究进展
韩富亮1,2, 李杨1,2, 李记明3, 徐 岩*1,2
(1.江南大学生物工程学院,江苏无锡 214122;2.食品科学与技术国家重点实验室,江苏无锡,214122;3.烟台张裕葡萄酿酒股份有限公司,山东烟台 264000)
花色苷是红葡萄酒颜色的主要物质基础。本文根据花色苷结构,对其进行了分类,即基本花色苷(非酰化花色苷)、酰化花色苷、吡喃花色苷和聚合花色苷;并对其结构和颜色的关系进行了综述讨论,为葡萄酒颜色机理的研究提供参考。
红葡萄酒;花色苷;结构;颜色
葡萄酒的颜色是其重要的感官品质之一,也是判断葡萄酒酒龄的依据之一。葡萄酒中的花色苷是赋予其颜色的主要化合物,一部分非花色苷酚本身无色或具有一定的颜色,它们可以或多或少和花色苷相互作用,产生辅色效应,使葡萄酒的颜色发生变化。
葡萄酒中的花色苷种类很多,来源于葡萄中的花色苷在葡萄酒发酵过程中就开始和其它物质发生反应,生成新的花色苷,并在后续的陈酿和处理过程中继续反应,生成更多也更为复杂的花色苷色素衍生物。Hakansson等在2003年报道了5种新的花色苷,包括2种吡喃花色苷和3种聚合花色苷(见图 1)[1]。A lcalde-Eon等(2006)在 Temp ranillo一种葡萄酒中就检测到了129种花色苷,其中吡喃花色苷和聚合花色苷的比例较少,还包括几种花色苷双糖苷[2]。Han Fu Liang等(2009)在陈酿的蛇龙珠葡萄酒中检测到37种花色苷,其中包括20余种吡喃花色苷和10余种聚合花色苷[3]。根据花色苷的结构,可以将花色苷分为基本花色苷(非酰化花色苷)、酰化花色苷、吡喃花色苷和聚合花色苷[2,4-8]。
红葡萄酒虽然是一个非常复杂的呈色体系,其颜色受葡萄酒的p H值、辅色效应、二氧化硫、乙醇、金属离子等多种因素的影响。但是,花色苷是其颜色的物质基础,对红葡萄酒的颜色起决定作用[9-16]。Vivar-Quintana等(2002)和 Han等(2009)的报道表明花色苷的颜色不仅与花色苷的含量有关,和花色苷的种类也有关系[3,17-18]。Cabrita等(2000)和Han等(2008,2009)的分析表明,花色苷的结构不同,它们显示的颜色(吸光率或CIELab色值)也不相同[3,18-19]。Han Fu Liang等(2008)采用主成份回归分析了赤霞珠葡萄酒中花色苷和颜色关系,数据表明参与分析的花色苷可以解释新葡萄酒红色的64.56%~81.57%(CIELab,a*值),这和Boulton(2001)的报道的结果接近,即在新葡萄酒中,花色苷的颜色占了颜色值的50%~70%[11,18]。
研究葡萄酒花色苷结构和颜色关系的机制机理,可以深入理解葡萄酒颜色的变化和稳定性,为葡萄酒的酿造技术提供参考。同时,也可为其它有花色苷类色素的食品提供参考,例如蓝莓(汁)、杨梅(汁)、黑米色素等[20-22]。本文根据葡萄酒花色苷的结构,对其进行了分类,并就花色苷结构和颜色的关系进行了阐述,为葡萄酒颜色机理的研究提供参考。
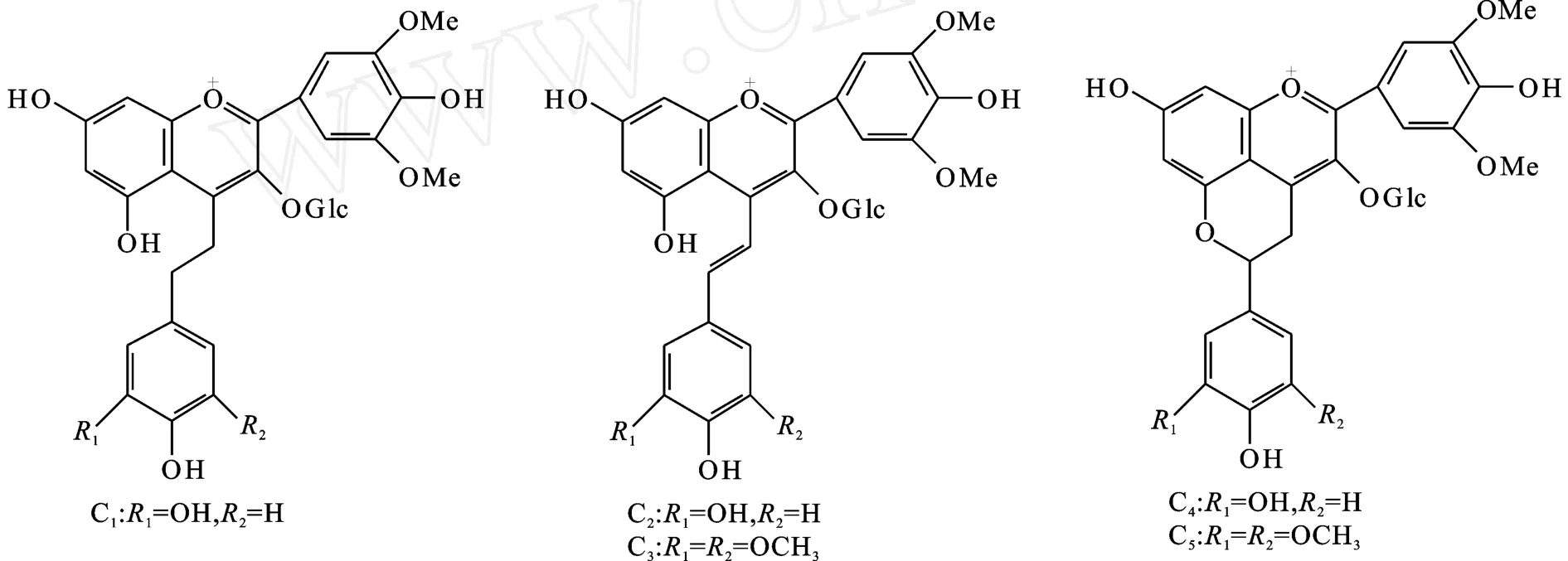
图1 5种新的花色苷Fig.1 Five new anthocyanins
1 基本花色苷(非酰化花色苷)和颜色
欧亚种葡萄酒中的花色苷种类繁多,基本的花色苷有5种(见图2):Delphinidin 3-glucoside(Dp3-glu)、Cyanidin 3-glucoside(Cy3-glu)、Petunidin 3-glucoside(Pt3-glu)、Peonidin 3-glucoside(Pn3-glu)、M alvidin 3-glucoside(M v3-glu)[4-8,23-24],它们是欧亚种葡萄和葡萄酒中都有的花色苷,同时,也是其它花色苷的前体。因为它们的配糖体都没有酰化,因此,也称为非酰化花色苷。
1.1 花色苷的p H值平衡和颜色
花色苷的显色机理是花色苷配基具有一个π-电子共轭体系,这个共轭体系可以吸收特定波长的光而被激发,从而表现出颜色,也即发色团。花色苷配基上连接的羟基和甲氧基等,本身没有颜色,但是可以和发色团的π-电子共轭体系相互作用,从而影响颜色,称为助色团。

图2 5种基本(非酰化)花色苷的结构Fig.2 Structure of five common anthocyan ins(non-acylated an thocyan ins)
在葡萄酒中,花色苷以几种混合结构存在,并达成化学平衡(见图3、4):烊盐阳离子(flavylium cation,red;AH+)、醌型酐碱 (quinonoidal anhydrobase,blue;A,A-,A2-)、甲醇假碱或半缩醛结构(carbinol pseudobase,colour-less;hemiketals,AOH,AO)和查尔酮(chalcone,colourless o r light yellow;C,C-,C2-)。p H值在2以下,花色苷主要以红色的阳离子(cationic form)存在,随着p H值增加,花色苷去质子化形成蓝色的醌型结构(quinonoidal form)。在水溶液中,烊盐阳离子在水合作用下形成的醌型结构和查尔酮结构形成平衡。室温和微酸下,无色的甲醇假碱和无色的或微黄色的查尔酮结构需要几个小时达到平衡。随着温度上升,平衡向查尔酮结构移动。这些结构之间的相对比例受p H值和花色苷结构影响。在p H值为3以上,花色苷主要呈半缩醛结构[25]。因此,使葡萄酒中花色苷尽可能保持红色烊盐离子和蓝色醌式结构,有利于提高葡萄酒颜色的色度或改变其色调。
在p H 3.2以下,花色苷以2种可以相互转变的结构存在,红色烊盐离子和蓝色醌式结构。在p H值为1.5,大约96%的花色苷呈烊盐离子结构,而在p H值为2.5,只有67%呈烊盐离子结构[26]。

图3 花色苷在不同pH值的结构转化Fig.3 Various structures of anthocyanins at different pHs
1.2 花色苷的光谱特性和颜色
在p H值为1.5,5种花色苷的摩尔消光系数不同 (Dp3-glu:23 700、Cy3-glu:18 800、Pt3-glu:18 900、Pn3-glu:14 100、M v3-glu:20 200)。但是在p H值为1.5,每一种花色苷的平衡态结构之间的分布比例也不同。因此,尽管M v3-glu的烊盐离子有高摩尔吸收,但是与 Pt3-glu和Cy3-glu比较,M v3-glu的吸收较低。同时,在p H值为1.5和p H值为3.5,M v3-glu的无色结构都以较高的百分比存在[25]。
在p H值为3.5,水合反应导致无色结构形成,促进了质子转移平衡。与p H值为1.5相比,花色苷溶液在p H值为3.5的最大吸收波长红移2~4 nm,表明p H值为3.5溶液中存在一定量的有色醌型碱。在p H值3.5,Cy3-glu(2个羟基,无甲氧基)吸收最高 ,然后是 Dp3-glu、Pt3-glu、Pn3-glu、M v3-glu(2个甲氧基,无羟基),这与B环上甲氧基的影响有关。根据 Iacobucci和Sw eeny(1983)的报道,有色的醌型碱分子上的甲氧基增加,导致了有色花色苷假碱(pseudobases)的比例上升,从而解释了Dp3-glu(B环上的羟基数目最多)在p H值为3.5的最大吸收波长红移(4 nm)要比其它花色苷红移的多(2 nm)[25]。
在CIELab颜色空间,Pn3-glu和Cy3-glu(B环2个取代基,见图 2)主要在橘黄色色调区域,而Dp3-glu、Pt3-glu、M v3-glu(B 环 3个取代基,图 2)主要在红-紫区域。H*ab(色调)也受甲氧基影响,随甲氧基数目增多(Cy3-glu 花色苷最大吸收波长与其B环上的取代基有关,即羟基数目或甲氧基数目(见图2)。有2个取代基的花色苷最大吸收波长小于有3个取代基的花色苷 (Cy3-glu、Pn3-glu、512 nm、Dp3-glu、Pt3-glu、M v3-glu:518-520nm)。花色苷最大吸收波长随着B环上羟基取代数目的增加而增加:Dp3-glu有3个羟基,最大吸收波长最大;然后是 Pt3-glu、Cy3glu(2个羟基),M v3-glu、Pn3-glu(1个羟基)。另一方面,当羟基被甲氧基取代,花色苷吸收下降,即B环上2个取代基的花色苷顺序是Cy3-glu>Pn3-glu;3个取代基的顺序Dp3-glu>Pt3-glu>M v3-glu[25]。因此,改变葡萄酒中基本花色苷的比例 ,提高 Cy3-glu、Pn3-glu、Dp3-glu 和 Pt3-glu 花色苷的含量,有利于葡萄酒颜色的增强。 B环上羟基数目比例不同,分子的可见光谱不同[19]。羟基的甲基化和糖苷化则对吸收光谱影响相当小。花色苷配体的吸收波长和π-电子结构紧密相关。决定花色苷配基离子(阳离子,中性离子,阴离子)稳定性的重要因子是π-电子离域程度和共振结构。B环上的羟基,除了 C3′位,都可以通过C2-C1′键增加共振。此外,B环上的羟基化也可以引起吸收光谱红移。这些分子在酸性介质下因为B环上羟基化比例而红移,但是在A环上6位的羟基取代则发生蓝移。这种现象表明羟基位置不同,对电子离域效应的影响不同。另一方面,溶剂介质的不同,其最大吸收波长不同[27]。 (图中结构式编号顺序依次为a,b,c,d,e;对应于图3中的结构:1,2,3,4,5) Sakata等(2006)研究表明:4种花色苷配基(Pelargonidin,Cyanidin,Delphinidin,Aurantinidin)的平面结构都比非平面结构稳定。非平面结构存在的可能性微小,也即B环相应于3位羟基扭曲,这种非平面结构虽然没有平面结构稳定,但是非平面结构在其3-糖苷结构中就变得重要。π-键在平面结构之间可以离域,而不可以在非平面结构离域。C1′-C2键的键级随着B环上羟基数目的增加而下降。Cyanidin的 C1′-C2键长长于pelargonidin,delphinidin又短于 Cyanidin。在 Pelargonidin分子中,B环上的对位羟基可以增强C1′-C2键,而在B环上的间位羟基可以减弱这个键。A环6位上的羟基可以增加最小的激发能,而B环上羟基数目的增加可以降低它们所需要的激发能[27]。 葡萄酒中的酰化花色苷来源于葡萄,这些色素是上述5种基本花色苷的乙酰化、对香豆酰化(顺反式)、咖啡酰化(顺反式)、阿巍酰化等酰化的花色苷(见图5)。阿魏酸也有顺反式结构,但是在葡萄酒中,还未见顺反式-阿巍酰花色苷的报道。 图5 酰化花色苷结构Fig.5 Structures of acylated anthocyanins 酰化的花色苷,尤其是具有平面结构的芳香取代基,在微酸性的水溶液中对维持花色苷的颜色稳定有相当强的能力,而单葡萄糖花色苷或双葡萄糖花色苷在同样的条件下,由于水合作用引起的平衡变动(花色苷多种结构之间的变化)使颜色稳定性较差。一些研究者提出假设,认为酰化分子对颜色的稳定作用是由于分子内辅色效应引起的,因为芳香酰基可以和平面吡喃核的π-键堆叠或共轭,从而保护花色苷的有色结构避免被水亲核攻击C2位和发色团的C4位[28-29]。 Han Fu Liang等(2008)采用多元统计分析报道了酰化的花色苷对颜色的贡献大于非酰化花色苷,香豆酰化的花色苷对颜色的贡献又大于乙酰化花色苷,并且顺式香豆酰化花色苷的贡献大于其反式的贡献[18],这些颜色贡献分析也还需要进一步验证。Geo rge等(2001)研究了从红紫色的花卉(Pe-tunia integrifolia)和蓝紫色的花卉(Triteleia bridgeseii)分离出来的2对香豆酰化花色苷的颜色特性,结果表明顺式花色苷比反式花色苷显示更强的颜色[30]。但是,它们的结构不同于葡萄酒中香豆酰化花色苷的结构。因此,它们的颜色特性还需要进一步研究确证。在应用上,进一步提高葡萄酒中酰化花色苷的含量,有利于葡萄酒颜色的增强和稳定,如添加浸渍酶酿造或选用花色苷含量高的葡萄品种。 5种基本花色苷和它们相应的酰化花色苷与乙醛(Vitisin B,见图 6)、丙酮、丙酮酸 (Vitisin A,见图 6)、咖啡酸(Pinotin A)、4-乙烯基苯酚、4-乙烯基儿茶酚(Pinotin A)、4-乙烯基愈疮木酚、4-乙烯基丁香酚、a-酮戊二酸、乙醛酸、乙烯吡喃酚、羟基肉桂酸等化合物反应形成一个新的吡喃环化合物,称之为吡喃花色苷[4-5,8,23-24,31-8]。 吡喃型花色苷的光谱特征表明,它们可能对葡萄酒橙红色的贡献更大。但是,这些花色苷的鉴定分析和形成机理都是在模式溶液中研究的。花色苷与丙酮酸反应形成丙酮酸吡喃花色苷(见图6,Vitisin A),而丙酮酸花色苷是葡萄酒陈酿1~2年后主要的花色苷,同时,非酰化和酰化花色苷的含量急剧下降[39]。 图6 吡喃花色苷(Vitisin A和 Vitisin B)结构Fig.6 Structures of pyranoan thocyan ins(Vitisin A and Vitisin B) Vitisin(A,B,见图6)是较早研究的吡喃花色苷,它们的颜色性质影响红葡萄酒的颜色。Romero和Bakker报道(2000),在葡萄酒p H下,vitisin要比M v3-glu显示更深的颜色。事实上,在模式溶液中vitisin A的颜色要比一般花色苷高11倍(p H3)或14倍(p H2)[40]。 因为vitisin比M v3-glu有更强的颜色显示和稳定性,这些花色苷在葡萄酒颜色品质上就有着重要的作用。对陈酿2~6年的32种port葡萄酒的研究表明,vitisin A色素是它们主要的色素。有时,仅检测到它们存在[40]。 吡喃型花色苷的最大吸收波长比非酰化和酰化花色苷要短,因此贡献了桔黄色色调。但是,根据吡喃型花色苷的性质,它们的最大吸收波长差异很大。Vitisin A、M v3-glu-乙烯基儿茶酚和 M v3-glu-乙烯基愈疮木酚的最大吸收波长都是在510~515 nm,对葡萄酒贡献红-桔黄色色调。乙烯基苯酚加合物对葡萄酒贡献桔黄色,因为它们的最大吸收波长接近500~503 nm。Vitisin B(见图6)最大吸收波长在490 nm附近,而一些丙酮酸衍生物色素在480nm附近,因此这两类化合物也都是显桔黄色,但是还带有褐色色调[2]。因此,采用适当的酿造技术,如橡木桶陈酿或者选育合适的酵母,促进葡萄酒中吡喃花色苷生成,利于葡萄酒的黄色色调增强。 聚合花色苷是花色苷(包括非酰化、酰化、吡喃花色苷)和其它一些物质如儿茶素、表儿茶素(见图7)等黄烷醇类物质直接缩合或由一些小分子物质(如 ethyl、vinyl、vanillyl、p ropyl、methyl、methane等)连接的和黄烷醇类物质的缩合产物,以及和黄烷醇的二聚体或多聚体缩合,也包括花色苷-花色苷之间的直接或间接聚合的多聚体[5,8,23-24,34,38,41-48]。此外,还有另一类新的聚合花色苷,称为 Portisin(见图8,因为在 Port葡萄酒中首先发现所以命名为Portisin),即anthocyanidin 3-glu-pa通过乙烯桥又和儿茶素或4-乙烯基苯酚等化合物反应形成的化合物[21,49-50]。目前,在葡萄酒中只检测到malvidin 3-glu-pa形成的Po rtisin。 根据本文中对吡喃花色苷的定义,即形成一个新的吡喃环,就称为吡喃花色苷。但是,吡喃花色苷和其他分子形成的新的花色苷,我们把它归为聚合花色苷。事实上,吡喃花色苷也可以称为聚合花色苷,即非酰化花色苷和酰化花色苷与其它分子反应或缩合形成的新花色苷。因此,吡喃花色苷和聚合花色苷并没有非常严格的界定。 Anthocyanins-Vinyl(pyrano)-flavanol聚合色素,例如,M alvidin 3-glu-vinyl-(+)-catechin-(+)-catechin、M alvidin 3-glu-vinyl-(+)-catechin、Malvidin 3-glu-vinyl-(-)-epicatechin,它们的最大吸收波长为500~515 nm左右。因此,这些花色苷显示的色调和吡喃花色苷相似,对葡萄酒贡献的颜色是带有更多的橙黄色[31,41]。 由小分子介导的黄烷醇-花色苷缩合物的最大吸收波长比没有缩合的花色苷(M v3-glu)稍微高一点,例如,乙醛介导的黄烷醇-花色苷缩合物(图7)的最大吸收波长要比没有缩合或直接缩合花色苷的波长要长(540~550 nm),即红移。因此,它们可能对葡萄酒贡献了葡萄酒更多的紫红色/红紫色[2,23,41,43]。 但是,Salas等(2004)报道:与 M v3-glu比较,M v3-glu和儿茶素的直接缩合并不改变它的颜色特性(例如水合常数、辅色效应等)[46]。Santos-Buelga等(1999)和Due~nas等(2006)检测到了由儿茶素(catechin)二甲花翠素(M v3-glu)直接缩合形成的无色二聚体[51-52]。 图7 二甲花翠素3-O-葡萄糖苷和(表)儿茶素在乙醛介导下形成的聚合色素Fig.7 Polymeric anthocyanins of Malvidin 3-O-glucosie and(epi)catechin linked by aldehyde 图8 Portisin A B C的结构Fig.8 Structures of Portisin A,B,C Portisin花色苷又可分为两类:vinylpyrano–phenols和vinylpyrano–flavanol花色苷。第一类p rotisin主要是 vinylpyranomalvidin-3-glucosidecatechol、 vinylpyranomalvidin-3-glucoside-syringol、、vinylpyranomalvidin-3-glucoside-guaiacol、vinylpyranomalvidin-3-glucoside-phenol、vinylpyranomalvidin-3-glucoside-phlo roglucinol等,它们的最大吸收波长在540 nm左右,对葡萄酒贡献更多的紫红色/红紫色;另一类则是和黄烷醇反应形成的,它们的最大吸收波长在570~580 nm。因此,这些花色苷显示更多的紫蓝色或蓝色色调[49,53-54]。例如,Oliveira等(2006)报道 Portisin A、B和 C都显示非常特别的紫蓝色[24]。 Francia-A richa等(1998)报道在模式溶液中,除了只有儿茶素的溶液外,不管M v3-glu存在与否褐变都会发生。褐变溶液在可见光区440~460 nm有最大吸收,这些新色素中的形成并不需要花色苷的存在,但是却受黄烷醇的直接驱动。因为在含有黄烷醇和花色苷的溶液中,一些特殊的色素也显示了相似的光谱。因此,这些产物可能是黄烷醇和花色苷之间缩合产生的[55]。Santos-Buelga等(1999)报道:在 32℃、p H值为 3.2条件下,M v3-glu和(+)-catechin的溶液可以形成新的微黄色素(Xanthylium,见图9),其最大吸收波长在439~458 nm左右。试验结果表明:它们很可能都来源于儿茶素,并且与乙醇及酒石酸的氧化产物有关[52]。Due~nas等(2006)等的研究也表明M v3-glu和(epi)-catechin可以形成Xanthylium色素,但是没有表明(epi)-catechin之间是否也可以形成Xanthylium色素[51]。 Oliveira等(2010)鉴定出两类新的聚合花色苷,由两分子的吡喃花色苷反应生成的聚合色素。一类带有电荷,由次甲基连接,其最大吸收波长为676 nm(见图10);另一类不带电荷,其最大吸收波长在730 nm左右。在p H值2.0,最大吸收波长为676 nm的聚合花色苷显示了极其特别的土耳其蓝色[56]。Carvalho等(2010)则运用量子化学方法从理论上解释了 Vitisin、Cyanidin、Portisin最大吸收波长的顺序,即 Vitisin 在葡萄酒中,聚合色素的含量可能很少,但是,这些具有桔黄色或蓝色色调的花色苷,如果可以了解其生成机理,也许可以生产具有新颜色的葡萄酒——蓝色葡萄酒;桔黄色葡萄酒。另一方面,具有蓝色色调的聚合色素一般都是在陈酿葡萄酒或葡萄酒脚中检测到,它们可能与新葡萄酒显示的蓝色色调无关,新葡萄酒显示的微弱的蓝色色调很可能就是由花色苷的醌型结构引起的,但是新葡萄酒蓝色色调的机理还需要进一步研究确证。在酿造技术上,陈酿可以促进聚合色素的生成,有利于葡萄酒颜色的稳定,但葡萄酒的黄色色调增加。 图9 Xanthylium的结构Fig.9 Structure of Xanthylium 图10 土耳其蓝色的聚合花色苷结构(Mv3-glu)Fig.10 General structure of the turquoise blue polymeric anthocyanins(Mv3-glu) 自然界检测到的花色苷类色素已达到600多种。粗略估计,在葡萄酒中检测到的花色苷也可达到300种以上。但是,根据花色苷的结构,对其进行组合计算,其理论的种类数量就可以达到19 800种(本文按5种基本花色苷、6种乙酰化、11种吡喃化的小分子、6种连接聚合色素的小分子、10余种黄烷醇计算)。如果再加上它们的多聚体(并考虑它们的连接位置,如 C8-C6位,C6-C8位等),包括花色苷-花色苷聚合体,其种类数量将更为庞大。 葡萄酒的颜色机理受其复杂基质和外界因素的影响,其颜色机理的研究依然是一个巨大的挑战,需要不断深入地研究。未来葡萄酒颜色机理的研究可能更多地集中在以下3个方面:1)是新色素的发现鉴定及其颜色特性的研究,特别是具有特殊颜色特性的色素;2)是采用量子化学对其进行颜色机理的认知;3)是色素物质和颜色的量化关系。通过深入研究葡萄酒颜色机制机理,最终为葡萄酒的生产,特别是生产颜色稳定的葡萄酒,甚至具有新颜色的天然葡萄酒(蓝色葡萄酒)提供科学理论指导。 (References): [1]H akansson AE,Pardon K,Yoji H,et al.Structures and colour properties of new red wine pigments[J].Tetrahedron Letters,2003,44:4887-4891. [2]A lcalde-Eon C,Escribano-Bail n M T,Santos-Buelga C,et al.Changes in the detailed pigment composition of red wine during maturity and ageing A comprehensive study[J].Analytica Chim ica Acta,2006,563:238-254. [3]Han Fu Liang,Jiang Shou Mei,He Jian Jun,et al.The anthocyanins in Cabernet Gernischet(Vitis vinifera L.cv.)aged red wine and their color in aqueous solution analyzed by partial least square regression[J].Food Science and Biotechnology,2009,3:724-731. [4]Fulcr and H,Benabdeljalil C,Rigaud J,et al.A new class of wine pigments generated by reaction between pyruvic acid and grape anthocyanins[J].Phytochemistry,1998,47:1401-1407. [5]Alcalde-Eon C,Escribano-Bail n M T,Santos-Buelga C,et al.Separation of pyranoanthocyanins from red wine by column chromatography[J].Analytica Chim ica Acta,2004,513:305-318. [6]Heier A,Blaas W,D roβA,et al.Anthocyanin Analysis by HPLC/ESI-MS[J].American Journal of Enology and Viticulture,2002,1:78-86. [7]Monagas M,Mart n-lvarez PJ,Bartolomé B,et al.Statistical interpretation of the color parameters of red wines in function of their phenolic composition during aging in bottle[J].European Food Research and Technology,2005,222:702-709. [8]Rentzsch M,Schwarz M,Winterhalter P.Pyranoanthocyanins-an overview on structures,occurrence,and pathways of formation[J].Trends in Food Science and Technology,2007,18:526-534. [9]Dalla,C,Laureano,O.Effect of pH,sulphur dioxide,alcohol content,temperature and storage time on color composition of a young portuguese red table wine[J].Journal of the Science of Food and Agriculture,1994,65:477-485. [10]Fossen T,Cabrita L,Andersen M.Color and stability of pure anthocyanins influenced by pH including the alkaline region[J].Food Chemistry,1998,63:435-440. [11]Boulton R.The copigmentation of anthocyanins and its role in the color of red wine:A critical review[J].American Journal of Enology and Viticulture,2001,52:67-87. [12]Darias-Martin J,Carrillo M,Diaz E,Boulton RB.Enhancement of red wine color by pre-fermentation addition of copigments[J].Food Chemistry,2001,73:217-220. [13]Berké B,de Freitas VAP.Influence of procyanidin structures on their ability to complex with oenin[J].Food Chemistry,2005,90:453-460. [14]Gutirrez IH,Lo renzo ESP,Espinosa AV.Phenolic composition and magnitude of copigmentation in young and shortly aged red wines made from the cultivars,cabernet sauvignon,cencibel,and syrah[J].Food Chemistry,2005,92:269-283. [15]Esparza I,Santamar a C,Fern ndez JM.Chromatic characterisation of three consecutive vintages of Vitis vinifera red wine:Effect of dilution and iron addition[J].Analytica Chim ica Acta,2006,563:331-337. [16]Morata A,Gómez-Cordovés MC,Calderóna F,et al.Effects of pH,temperature and SO2on the formation of pyranoanthocyanins during red wine fermentation with two species of Saccharomyces[J].International Journal of Food M icrobiology,2006,106:123-129. [17]Vivar-Quintana AM,Santos-Buelga C,Rivas-Gonzalo JC.Anthocyanin——derived pigments and colour of red wines[J].Analytica Chimica Acta,2002,458:147-155. [18]Han Fu Liang,Zhang Wen Na,Pan Qiu Hong,et al.Principal component regression analysis of the relation between CIELAB color and monomeric anthocyanins in young cabernet sauvignon wines[J].Molecules,2008,13:2859-2870. [19]Cabrita L,Fossen T,Andersenø M.Colour and stability of the six common anthocyanidin 3-glucosides in aqueous solutions[J].Food Chemistry,2000,68:101-107. [20]李颖畅,郑凤娥,孟宪军.大孔树脂纯化蓝莓果中花色苷的研究[J].食品与生物技术学报,2009,4:496-500. Li Ying Chang,Zheng Feng E,Meng Xian Jun.Studies on purification of anthocyanins from blueberry Fruits by macroporous Resins[J].Journal of Food Science and Biotechnology,2009,4:496-500.(in Chinese) [21]方忠祥,张憨,蔡本利等.辅色素对杨梅汁色泽短期稳定性的影响[J].食品与生物技术学报,2005,3:61-65. Fang Zhong Xiang,Zhang M in,Cai ben Li et al.Effects of co-pigments on the color stability of bayberry(myrica rubra)juice during short-time storage[J].Journal of Food Science and Biotechnology,2005,3:61-65.(in Chinese) [22]孔令瑶,汪云,曹孤华等.黑米色素的组成与结构分析[J].食品与生物技术学报,2008,2:25-29. Kong Ling Yao,Wang Yun,Cao Yu Hua et al.Analysis of components and structures of black rice pigment[J].Journal of Food Science and Biotechnology,2008,2:25-29.(in Chinese) [23]Sousa C,Mateus N,Silva AM S,et al.Structural and chromatic characterization of a new Malvidin 3-glucoside vanillyl catechin pigment[J].Food Chemistry,2007,102:1344-1351. [24]Oliveira J,Santos-Buelga C,Silva AM S,et al.Chromatic and structural features of blue anthocyanin-derived pigments present in Port wine[J].Analytica Chimica Acta,2006,563:2-9. [25]Heredia FJ,Francia-Aricha EM,Rivas-Gonzalo JC,et al.Chromatic characterization of anthocyanins from red grapes-I.p H effect[J].Food Chemistry,1998,63:491-498. [26]Kosir IJ,Lapornik B,Andrensek S,et al.Identification of anthocyanins in wines by liquid chromatography,liquid chromatography-mass spectrometry and nuclear magnetic resonance[J].Analytica Chimica Acta,2004,513:277-282. [27]Sakata K,Saito N,Honda T.Abinitio study of molecular structures and excited states in anthocyanidins[J].Tetrahedron,2006,62:3721-3731. [28]Figueiredo P,Geo rge F,Tatsuzawa F,et al.New features of intramolecular copigmentation by acylated anthocyanins[J].Phytochemistry,1999,51:125-132. [29]Schwarz M,Winterhalter P.A novel synthetic route to substituted pyranoanthocyaninsw ith unique colour properties[J].Tetrahedron Letts,2003,44:7583-7587. [30]Geo rge F,Figueiredo P,Kenjiro T,et al.Influence of trans-cis isomerisation of coumaric acid substituentson colour variance and stabilisation in anthocyanins[J].Phytochem istry,2001,57:791-795. [31]Mateus N,Pascual-Teresa S,Rivas-Gonzalo JC,et al.Structural diversity of anthocyanin-derived pigments in po rt wines[J].Food Chemistry,2002,76:335-342. [32]He Jing Ren,Santos-Buelga C,Mateus N,et al.Isolation and quantification of oligomeric pyranoanthocyanin-flavanol pigments from red wines by combination of column chromatographic techniques[J].Journal of Chromatography A,2006,1134:215-225. [33]A tanasova V,Fulcrand H,Guernev CL,et al.Structure of a new dimeric acetaldehydemalvidin 3-glucoside condensation product[J].Tetrahedron Letts,2002,43:6151-6153. [34]Lee DF,Sw inny EE,Jones GP.NMR identification of ethyl-linked anthocyanin flavanol pigments formed in model wine ferments[J].Tetrahedron Letts,2004,45:1671-1674. [35]de Villiers A,Vanhoenacker G,Majek P,et al.Determination of anthocyanins in wine by direct injection liquid chromatography diode array detection mass spectrometry and classification of wines using discriminant analysis[J].Journal of Chromatography A,2004,1054:195-204. [36]He Jing Ren,Santos-Buelga C,Silva AMS,et al.Isolation and Structural Characterization of New Anthocyanin-Derived Yellow Pigments in Aged Red Wines[J].Journal of Agricultural and Food Chemistry,2006,54:9598-9603. [37]Wang Hai Bo,Race EJ,Shrikhande AJ.Anthocyanin transfo rmation in Cabernet Sauvignon wine during aging[J].Journal of Agricultural and Food Chemistry,2003,51:7989-7994. [38]Mo rata A,Gonz lez C,Su rez-Lepe JA.Fo rmation of vinylphenolic pyranoanthocyanins by selected yeasts fermenting red grape musts supp lemented with hydroxycinnamic acids[J].International Journal of Food M icrobiology,2007,116:144-152. [39]ateus N,Oliveira J,Pissarra J,et al.A new vinylpyranoanthocyanin pigment occurring in aged red wine[J].Food Chemistry,2006,97:689-695. [40]Romero C,Bakker J.Effect of Storage Temperature and Pyruvate on Kinetics of Anthocyanin Degradation,Vitisin A Derivative Formation,and Colo r Characteristics of Model Solutions[J].Journal of Agricultural and Food Chemistry,2000,48:2135-2141. [41]Francia-Aricha EM,Guerra M T,Rivas-Gonzalo JC,et al.New anthocyanin pigments formed after condensation with flavanols[J].Journal of Agricultural and Food Chemistry,1997,45:2262-2266 [42]Pissarra J,Lourenáo S,González-Paramás AM,et al.Structural Characterization of New Malvidin 3-Glucoside-Catechin A ryl/A lkyl-Linked Pigments[J].Journal of Agricultural and Food Chemistry,2004,52:5519-5526. [43]Pissarra J,Louren o S,Gonz lez-Param s AM,et al.Formation of new anthocyanin-alkyl/aryl-flavanol pigments in model solutions[J].Analytica Chim ica Acta,2004,513:215-221. [44]Pissarra J,Louren o S,Gonzlez-Param s AM,et al.Isolation and structural characterization of new anthocyanin-alkylcatechin pigments[J].Food Chemistry,2005,90:81-87. [45]Salas E,A tanasova V,Poncet-Legrand C,et al.Demonstration of the occurrence of flavanol anthocyanin adducts in wine and in model solutions[J].Analytica Chimica Acta,2004,513:325-332. [46]Salas E,Le Guernev C,Fulcrand H,et al.Structure determination and colour propertiesof a new directly linked flavanol anthocyanin dimmer[J].Tetrahedron Letts,2004,45:8725-8729. [47]Mateus N,Silva AMS,Santos-Buelga C,et al.Identification of Anthocyanin-Flavanol Pigments in Red Wines by NMR and Mass Spectrometry[J].Journal of Agricultural and Food Chemistry,2002b,50:2110-2116. [48]Nave F,Teixeira N,M ateus N,et al.The fate of flavanol–anthocyanin adducts in wines:Study of their putative reaction patterns in the presence of acetaldehyde[J].Food Chemistry,2010,121:1129-1138. [49]Oliveira J,de Freitas V,Silva AMS,et al.Reaction between Hydroxycinnamic Acids and Anthocyanin-Pyruvic Acid A dducts Yielding New Po rtisins[J].Journal of Agricultural and Food Chemistry,2007,55:6349-6356. [50]Carvalho ARF,Oliveira J,De Freitas V,et al.Unusual Color Change of Vinylpyranoanthocyanin-Phenolic Pigments[J].Journal of Agricultural and Food Chemistry,2010,58:4292-4297. [51]Duenas M,Fulcrand H,Cheynier V.Formation of anthocyanin flavanol adducts inmodel solutions[J].Analytica Chim ica Acta,2006,563:15-25. [52]Santos-Buelga C,Francia-A richa EM,de Pascual-Teresa S,et al.Contribution to the identification of the pigments responsible for the browning of anthocyanin-flavanol solutions[J].European Food Research and Technology,1999,209:411-415. [53]Mateus N,Oliveira J,Haettich-Motta M,et al.New family of bluish pyranoanthocyanins[J].Journal of Biomedicine and Biotechnology,2004,5:299-305. [54]Carvalho ARF,Oliveira J,de Freitas V,et al.A theoretical interpretation of the colo rof two classes of pyranoanthocyanins[J].Journal of Molecular Structure:Theochem,2010,948:61-64. [55]Francia-A richa EM,Rivas-Gonzalo JC,Santos-Buelga C.Effect of malvidin-3-monoglucoside on the brow ning of monomeric and dimeric flavanols[J].Zeitschrift für Lebensmittelun tersuchung und-Forschung A,1998,207:223-228. [56]Oliveira J,Azevedo J,Silva AM S,et al.Pyranoanthocyanin dimers:A new family of turquoise blue anthocyanin-derived pigments found in po rt wine[J].Journal of Agricultural and Food Chemistry,2010,58:5154-5159. Relation Between Anthocyan in Structures and Color in Red Wine:a Review HAN Fu-liang1,2, L I Yang1,2, L IJi-ming3, XU Yan*1,2 Anthocyanins are responsible for red wine color.In this review,the anthocyanins are classified into four groups according to their structure:common anthocyanins(non-acylated anthocyanins),acylated anthocyanins, pyranoanthocyanins and polymeric anthocyanins;then expatiate on their contribution for wine color based on their structures in order to better understand the color changing mechanism of red wine. red wine,anthocyanins,structure,co lo r TS 262.6 A 1673-1689(2011)03-0328-09 2010-09-24 中国博士后科学基金项目(20090451168);“泰山学者”建设工程专项项目。 韩富亮(1979-),男,工学博士,河南林州人,主要从事酿酒科学与工程研究。Email:hfl109@yahoo.com.cn *通信作者:徐岩(1962-),男,浙江慈溪人,工学博士,教授,博士研究生导师,主要从事酿酒科学与工程研究。Email:yxu@jiangnan.edu.cn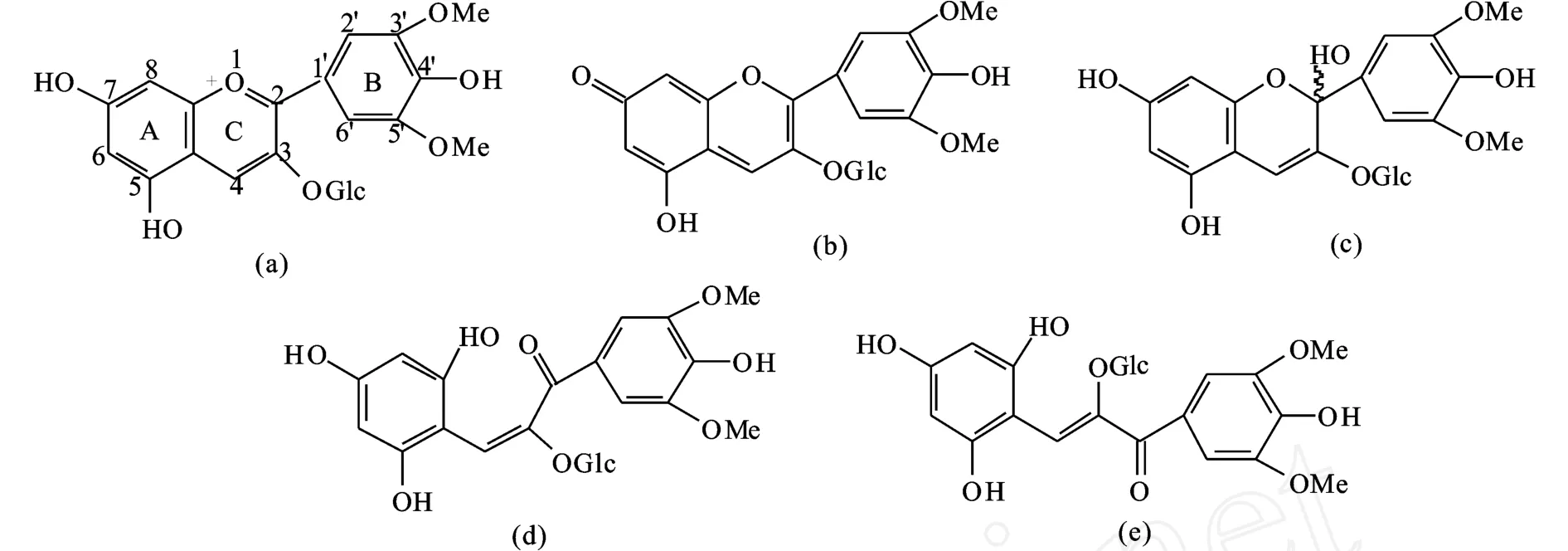
2 酰化花色苷和颜色

3 吡喃花色苷和颜色

4 聚合花色苷和颜色
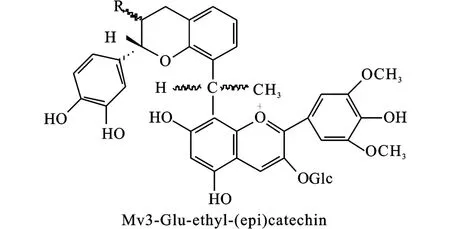

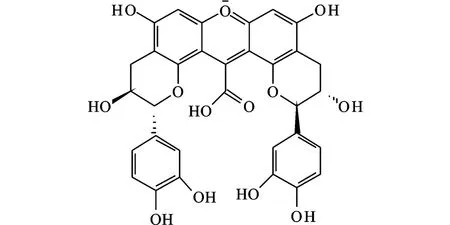

5 总结和展望
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;3.Yantai Changyu Pioneer Wine Company Limited,Yantai 264000,China)

