基于特异性基因的副溶血性弧菌快速分离鉴定
翁仕强, 赵 勇, 潘迎捷, 卢 瑛
(上海海洋大学食品学院,上海 201306)
基于特异性基因的副溶血性弧菌快速分离鉴定
翁仕强, 赵 勇, 潘迎捷, 卢 瑛
(上海海洋大学食品学院,上海 201306)
副溶血性弧菌(Vibrio parahaemolyticus)是海洋环境中常见的食源性致病菌。采用自行设计的改良初筛方案结合tlh、toxR这2种特异性基因的2次筛选开发了一种副溶血性弧菌的快速分离鉴定方法。应用该法从海水、海泥及3种海产品中分离得到了19株副溶血性弧菌,再经16S rDNA测序对分离鉴定结果的特异性进行了验证。实验结果显示基于tlh、toxR这两种特异性基因分离鉴定所得19株菌的准确性为100%,全程检测时间为3 d。上述结果显示本研究开发的基于特异性基因的副溶血性弧菌分离鉴定法是一种高效、快速的检测方法,特异性强且耗时短,在食源性致病菌的风险评估和大规模样本的分析检测领域具有较高的潜在应用价值。
副溶血性弧菌;特异性基因;tlh;toxR;鉴定
副溶血性弧菌(Vibrio parahaemolyticus,简称V.parahaemolyticus或V p)是一种革兰氏阴性的嗜盐微生物,属于弧菌属,是沿海地区常见的一种食源性致病菌,能够引起人类肠胃炎[1],同时也能感染鱼、虾、蟹类以及甲壳类等多种水产动物,对其养殖带来不利[2-3]。它主要存在于海水环境中,如海产鱼、虾、贝类以及海水、海泥等。副溶血性弧菌引起的食物中毒事件在世界各地区频繁发生,以沿海城市为主[4]。目前,副溶血性弧菌的传统分离鉴定流程为:样品先经液体培养基培养增菌,然后用副溶血性弧菌的选择性培养基进行培养分离纯化出单菌落,最后经一系列的生理生化鉴定来确定分离菌是否为副溶血性弧菌。因为弧菌属的多种细菌在分类学上与副溶血性弧菌很相近,它们的生理生化鉴定结果很相像,因此传统的分离鉴定方法有假阳性反应,在可靠性方面有所欠缺,此外整个流程耗时长,一般需要5~7 d。
PCR方法应用于检测环境中的微生物有助于提高检测的迅速性和准确性。研究显示,副溶血性弧菌中的tlh、toxR基因具有特异性保守片段[5-7],可用于设计PCR的特异性引物,其中tlh基因编码副溶血性弧菌的不耐热溶血毒素(TLH),所有的副溶血性弧菌都有该基因,因此tlh基因具有种特异性,目前国内外研究者在开发副溶血性弧菌的PCR检测技术时大都选用该基因。toxR基因最早是在霍乱弧菌中发现,后来研究人员发现toxR基因在副溶血性弧菌中也存在,主要起调控基因的功能[8]。本研究采用自行设计的改良初筛方案结合tlh、toxR这两种特异性基因的2次筛选方法开发了一种副溶血性弧菌的快速分离鉴定方法,为今后副溶血性弧菌的大规模分离纯化及高通量式快速分离鉴定方法的开发奠定了基础。
1 材料与方法
1.1 实验材料
菌株:副溶血性弧菌标准菌株A TCC 33846,购自中国科学院微生物研究所;样品:海泥、海水、蟹和黄泥螺于2009年6月采自上海市临港新城东海大桥附近滩涂,蛤蜊于2009年5月购自上海新芦苑集贸市场;培养基及试剂:碱性蛋白胨水(APW)自行配制,硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂(TCBS)、胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB),三糖铁(TSI)琼脂购自北京陆桥公司,TaqDNA聚合酶购自TA KARA公司,D2000 DNA Ladder Marker购自贝博公司;主要仪器:Stomacher 细菌分离器:德国 Eppendorf公司产品,UVP EC3凝胶成像系统:美国UVP产品,Eppendorf A G PCR仪等:法国 Intersecince产品。
1.2 实验方法
1.2.1 副溶血性弧菌的分离方法 各取海水25 m L、海泥25 g,分别加至225 m LAPW培养基中,混匀后放入37℃培养箱内过夜培养;食物样品无菌操作各取25 g,分别放入均质袋中,各加入225 m L APW培养基,然后放入均质器(Stomacher 细菌分离器)中拍打2 min(拍打速度为6次/s)后,扎好袋口置于37℃培养箱内过夜培养。次日取上述2种培养液于含3 g/dL NaCL的 TCBS平板上划线分离,37℃过夜培养。挑取TCBS平板上的绿色或蓝绿色可疑单菌落划线于3 g/dL NaCl TSA平板上纯化培养后做下一步鉴定。上述实验均在无菌超净台中进行。
1.2.2 副溶血性弧菌的鉴定 首先采用3 g/dL NaCl TSI试验进行初筛,然后将TSI试验现象符合的可疑菌落采用PCR扩增tlh与toxR基因以确定副溶血性弧菌,最后对含tlh、toxR2种基因的分离菌进行16S rDNA测序进行验证。
1)TSI试验 挑取3 g/dL NaCl TSA平板上的纯培养菌落接种于3 g/dL NaCl TSI斜面(底部穿刺,斜面划线),37℃培养过夜。底部变黄,斜面变红,不产气泡为副溶血性弧菌的试验现象。
2)菌株总DNA的提取 DNA提取采用热裂解法,刮取一环3 g/dL NaCl TSI斜面上可疑菌落培养物接至100μL 3 g/dL生理盐水中,悬浮后10 000 g离心10 min,除去上清。在沉淀中加入100 μL无菌NaOH(50 mmol/L),重悬后100℃加热处理10 min。然后取50μL处理液,加入8μL Tris-HCl(1 mol/L,p H值为7.0)中和p H值后10 000 g离心10 min,取上清(即DNA模板)-20℃保存。
3)tlh、toxR基因的PCR扩增及其特异性表征
PCR引物见表1,扩增条件见表2。tlh、toxR2种基因PCR扩增产物的特异性表征采用1 g/dL琼脂糖凝胶电泳结合16S rDNA测序方式,测序结果首先在NCBI上进行基因比对,然后通过M EGA 4软件构建包括19株分离菌、9株弧菌以及2株非弧菌16S rDNA序列的系统发育树。
2 结果与分析
2.1 副溶血性弧菌分离鉴定结果
从TCBS选择性培养基上挑取28株蓝绿色菌落,所有菌落均先划线于 TSA平板上纯化培养后再做鉴定实验。

表1 tlh、toxR基因的扩增引物Tab.1 Oligonucleotide primers of tlh gene and toxR gene

表2 tlh、toxR基因的PCR扩增条件Tab.2 Amplification profiles of PCR
2.1.1 TSI试验结果 28株分离菌的 TSI试验显示,有23株与对照的标准菌株一样显示底部变黄,斜面变红,不产气泡现象,因此我们选取了这23株疑似副溶血性弧菌进行后续的PCR鉴定。
2.1.2tlh、toxR基因的 PCR扩增结果 23株副溶血性弧菌疑似菌的tlh基因扩增结果见图1。由图1可知,有19株分离菌在450 bp附近处扩增出与标准菌株一致的基因片段,与预期的tlh基因片段大小吻合,说明这19株分离菌含有tlh基因。随后我们选取这19株含tlh基因可疑菌株进行了toxR基因的PCR扩增,结果发现这19株分离菌在368 bp附近处均扩增出与标准菌株一致的基因片段(见图2),该片段大小与预期的toxR基因相吻合。
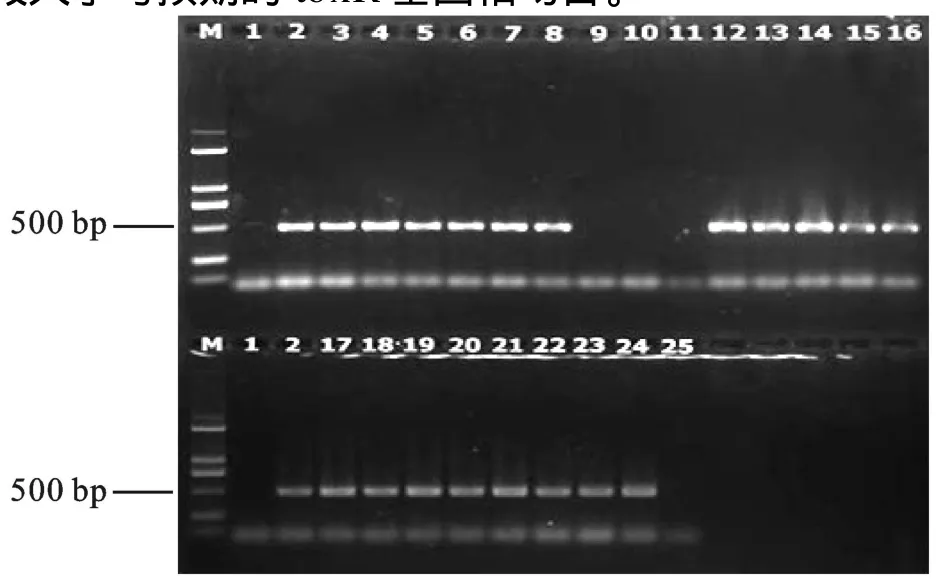
图1 PCR扩增分离菌株 tlh基因电泳图谱Fig.1 PCR profiles of tlh gene of suspectable strains isolated from samples

图2 PCR扩增分离菌株toxR基因电泳图谱Fig.2 PCR profiles of toxR gene of suspectable strains
2.1.3 16S rDNA测序验证 以含有tlh和toxR基因的19株菌为对象,扩增了这19株分离菌的16S rDNA,然后送上海桑尼生物科技有限公司测序,再进行序列比对并构建系统发育树。测序结果显示,这19株分离菌与副溶血性弧菌的序列相似度为99%~100%。以这19株分离菌和11株已知菌的16S rDNA序列比对并通过M EGA 4软件分析建立的系统发育树(见图3),系统发育树显示这19株分离菌与副溶血性弧菌的遗传距离最近。上述结果显示,这19株含有tlh和toxR基因的分离菌均为副溶血性弧菌。
3 结 语
目前,食源性致病菌的检测正朝着快速、灵敏、特异性强、成本低的方向发展,目前在我国的食品工业领域,食源性致病菌的检测以传统的生理生化分离鉴定方法为主,一般需要7 d左右,耗时长,步骤多,给质控和监控部门带来很大的不便性。Ying Bu Kim等[7]用373株已确定的副溶血性弧菌分别做理化鉴定和PCR鉴定,结果显示理化结果有47株显示为阴性,而PCR鉴定结果全为阳性。由此可见,PCR分离鉴定方法准确性较高。本研究采用国标GB/T 4789.7-2008的增菌方法结合改良式初筛和PCR扩增特异性基因的方法来分离鉴定海水环境中的副溶血性弧菌。首先,我们利用副溶血性弧菌的嗜盐性设计了选择性培养基(3 g/dL NaCl的TCBS)结合三糖铁理化试验进行可疑菌株的初筛,之所以在初筛中选择三糖铁试验是因为我们经过多次分菌筛选发现三糖铁试验的结果对副溶血性弧菌的筛选性能最好。初筛结束后,选取了副溶血性弧菌的tlh和toxR这2种特异性基因进行PCR扩增对可疑菌株进行2次筛选,最后通过测序比对来验证基于这2种基因的2次筛选结果的准确性。实验结果显示初筛时选取的可疑菌株其准确率为82.6%。初筛后再经副溶血性弧菌的tlh和toxR这2种特异性基因的2次筛选,测序比对分析后发现其准确性为100%,说明本研究所选用的引物特异性强,可靠性高。
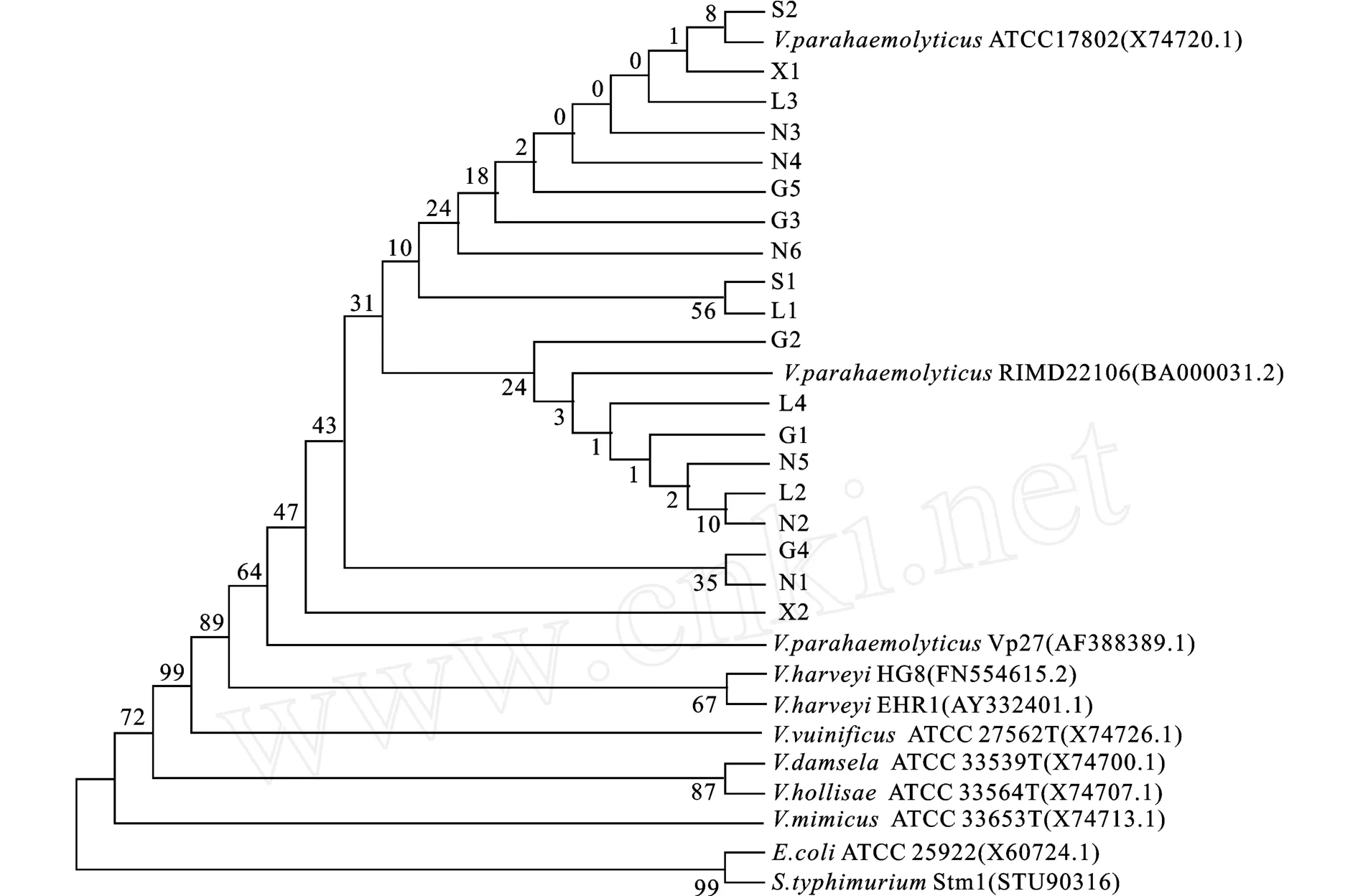
图3 M EGA4软件构建的19株分离菌的16S rDNA系统发育树Fig.3 Phylogenetic tree of the 19 isolated strains structure by MEGA4
副溶血性弧菌的特异性基因有:tlh基因、gyrB基因、Fla基因、toxR基因等。它们在副溶血性弧菌弧菌中均有一定的保守性。另外,还有研究者设计耐热直接溶血素基因(tdh)的特异性PCR引物,用于分离致病性副溶血性弧菌[10]。作者所在研究室过往在以tlh基因鉴定副溶血性弧菌时曾发现有2株分离菌 PCR检测时为tlh阳性,但经16S rDNA测序比对后发现是哈维氏弧菌。故此,本研究在2次筛选时选用了tlh与tox R2种基因进行PCR检测以确保高准确性,同时因为准确性有了双重保险,建议实际应用时可以省略测序过程以减低检测成本。
综上所述,相较于传统的理化分离鉴定法,本研究开发的基于特异性基因的副溶血性弧菌快速分离鉴定法检测特异性强且耗时短、成本低,整个过程包括分离、纯化、鉴定,耗时3 d,检测结果准确性高,是一种快速简便且高效的方法(见图4)。

图4 传统方法与本研究的PCR方法流程图Fig.4 Flow chart of conventional isolation and PCR method in our study
若结合全自动核酸提取仪,今后还可以在此方法的基础上进一步开发副溶血性弧菌的高通量检测方法,在食源性致病菌的风险评估和大规模样本的分析检测领域具有较高的潜在应用价值。
(References):
[1]Yi-Cheng Su,Chengchu Liu.Vibrio Parahaemolyticus:a concern of seafood safety[J].Food Microbiology,2007,24(6):549-558.
[2]陶保华,胡超群,吴蔚.斑节对虾弧菌病的病原生物学研究 [J].热带海洋学报,2001,20(2):80-86.
Tao Bao-hua,Hu Chao-qun,Wu Wei.Studies on pathogenetic biology of vibriosisoccurring in penaeusmonodon[J].Tropic Oceanology,2001,20(2):80-86.(in Chinese)
[3]吴后波,潘金培.弧菌属细菌及其所致海水养殖动物疾病[J].中国水产科学,2001,8(3):89-93.
Wu Hou-bo,Pan Jin-pei.Progress in studies of vibriosis in aquaculture[J].Journal of Fishery Sciences of China,2001,8(3):89-93.(in Chinese)
[4]Belkin,Colwell.Oceans and health:pathogens in the marine environment[M].New Yo rk:Sp ringer,2005,277-295.
[5]Zhang XH,Austin B.Haemolysins in vibrio species[J].Journal of Applied Microbiology,2005,98(5):1011-1019.
[6]王豪,孙晓红.利用PCR技术快速检测水产品中副溶血性弧菌[J].安徽农业科学,2009,37(15):6909-6910,6913.
Wang Hao,Sun Xiao-hong.Rapid detection of vibrio parahaemolyticus in aquatic products by PCR technology[J].Journal of Anhui Agricultural Sciences,2009,37(15):6909-6910,6913.(in Chinese)
[7]Kim YB,Okuda J,Matsumoto C,et al.Identification ofVibrio parahaemolyticusstrainsat the species level by PCR targeted to the toxR gene[J].Journal of Clinical Microbiology,1999,37(4),1173-1177.
[8]Lin Z,Kumagai K,Baba K,et al.V ibrio parahaemolyticushas a homolog of theVibrio choleraetoxRSoperon that mediates environmentally induced regulation of the thermostable direct hemolysin gene[J].Journal of Bacteriology,1993,175(12):3844-3855.
[9]Bej A,Patterson D,Brasher C,et al.Detection of total and hemolysin-producingV ibrio parahaemoly ticusin shellfish using multiplex PCR amplification oftl,tdhandtrh[J].Journal of Microbiological Methods,1999,36(3):215-225.
[10]王娜,陶妍.水产品三种致病菌多重PCR检测方法的建立 [J].食品与生物技术学报,2009,28(3):397-402.
WANG Na,TAO Yan.Establishment of a multiplex PCR for detection of three types of pathogen in aquatic foods[J].Journal of Food Science and Biotechnology,2009,28(3):397-402.(in Chinese)
Rapid Isolation and Identification Method Based on Specific Gene for Vibrio parahaemolyticus
WENG Shi-qiang, ZHAO Yong, PAN Ying-jie, LU Ying
(College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
Vibrio Parahaemolyticusis a frequent food-borne pathogen in marine environments.A rapid isolation and identification method for Vibrio Parahaemolyticus was developed in this study by combining an imp roved screening method with a second screening based on specific genes(tlhandtox R).By using this method,19 strains ofVibrio parahaemolyticuswere isolated from marine water,ooze and threemarine products.Also,the 16S rDNA from the isolated strains was sequenced to validate the specificity.The results obtained by the specifictlh,toxRgene identification method were consistent with that from 16S rDNA sequencing,show n that the veracity of the identification method based on specific gene is 100%.Our results appeared that the isolation and identification method based on specific genes forVibrio parahaemoly ticusis an efficient and rapid method,which has high specificity and is timesaving,only need 3 days.It would be high potential application in the field of risk assessment of food-borne pathogens and of the large-scale detection researches.
Vibrio parahaemolyticus,specific gene,tlh,toxR,identification
*
卢瑛(1971-),女,浙江东阳人,理学博士,副教授,主要从事食品安全与风险评估、纳米生物技术等方面研究。Email:y-lu@shou.edu.cn
S 37
A
1673-1689(2011)03-0417-05
book=421,ebook=478
2010-05-22
国家“十一五”科技支撑计划项目(2008BAD94B09);上海市教育委员会科研创新项目(09YZ274);上海市科技兴农重点攻关项目;上海市教育委员会重点学科建设项目(J50704)。

