室温下二氧化锰刺球的合成及其电化学性能研究
付 娇,王又容,程四清
(武汉工业学院化学与环境工程学院,湖北武汉 430023)
具有独特性能的过渡金属氧化物被广泛地应用于各个领域,锰氧化物因其自然资源丰富价格低廉且环境友好而倍受关注,二氧化锰就是这个大家族的重要的组成部分。黑色粉末状二氧化锰的晶型结构非常丰富,有几十种,其中常见的晶体结构有α,β,γ型等。由于其结构的多样性及其独特的物理化学特性,在许多领域有着广阔的应用前景,如作催化剂、离子筛、分子筛、能源存储等。尤其是作为重要的储能材料,它被广泛用于超级电容器、干电池、碱锰电池、锂锰电池等储能元件中。虽然对二氧化锰的研究已有大量报道[1-2],但至今对二氧化锰认识还不够全面。
颗粒大小、形貌、晶体结构参数等是材料性能的重要影响因素。为了更好地利用MnO2,具有独特性质的微/纳米MnO2的可控合成引起了科学工作者们极大的兴趣。常见的MnO2制备方法有固相法、模板法[3]、水热法、共沉淀法[4]、回流法、凝胶 —溶胶[5]法及热分解法等,其中水热法是研究的最多、研究成果最为丰富的方法之一[6-9]。通过这些方法,许多研究者已经成功地合成出各种不同晶型不同形貌的二氧化锰。然而,在室温下合成二氧化锰的报道却并不多见。为此,室温制备微纳米二氧化锰,并在工艺条件优化和产品性能关系方面展开研究具有一定意义。本文研究了室温下刺球二氧化锰材料的合成,考察了盐酸用量变化对产物晶型、形貌和电化学性能的影响。
1 实验部分
1.1 MnO2的制备
将 2mmolKMnO4溶解于 50mL盐酸溶液中,室温下放置,当溶液变为无色后离心将所得沉淀收集,分别用蒸馏水和乙醇洗涤 3次。在 50℃下真空干燥后得到产品。在其他反应条件保持不变的情况下,更改盐酸和水的量考察酸浓度对于材料结构、形貌和性能的影响。
1.2 性能与表征
1.2.1 X衍射和 SEM
将产物分别用 X射线衍射表征,XRD图谱由日本 Rigaku公司 X射线衍射仪测定,CuKα靶,40 kV×50mA,λ=0.154178 nm,扫描速度 0.02 °/s,扫描范围 10—70°,通过衍射位置和强度来反映产物的结晶特性。用 S-3000N型扫描电子显微镜 (SEM)观察产物的形貌。
1.2.2 充放电性能的测定
按质量比 75∶15∶5称所得样品、乙炔黑和 PTFE(聚四氟乙烯),在研钵中研磨均匀后,用压膜机压成为一定厚度的薄膜。将薄膜裁减成尺寸为 1 cm2的小片压到不锈钢集流网上制成电极。以此电极为正极,相应大小的锂圆片为负极,Celgard2400聚丙烯为隔膜,1mol/L LiC lO4/EC+DMC(体积比 1∶1)为电解液。在充满氩气的 Super(1220/750/900)手套箱 (米开罗那 (中国)有限公司)内将负极片、吸液纸、隔膜、正极片依次加入电池底壳中,组装成CR2016型扣式电池。恒流充放电测试采用武汉金诺电子有限公司生产的兰电电池测试系统,以 0.1C恒定电流,在 4V到 2V之间对体系进行充放电测试。
2 结果与讨论
2.1 X衍射结果分析
图1列出了室温下不同浓度盐酸中合成的二氧化锰粉末的 X射线衍射图谱。a、b、c、d分别为盐酸和水体积比为 12%,8%,4%,2%时合成样品的衍射图谱。从图1可以看出,谱线 d在 2θ为 12.1°,24.6°和 37.1°处出现了衍射峰,属于典型的δ-MnO2晶型[10]。表明在一定条件下 K MnO4和 HCl经室温液相反应可制得层状结构的δ-MnO2,但衍射峰的峰值都较小,说明合成的δ-MnO2结晶度较低。c比 d多出一些特征峰 ,分别是 22.1°,28.0°,42.4°,56.3°,由此可见产物晶型发生了转变,从特征峰可以判断变为γ-MnO2。说明在 H2O∶HCl=48∶2时合成出的二氧化锰为γ型。44.3°,55.8°是α-MnO2的特征峰[11],说明 b为α-MnO2,但图中的峰强较弱且衍射峰较宽,说明产物具有较弱的晶形和较小晶粒尺寸。a和 b衍射峰数目和峰位置基本相同,均在2θ为 18.1°,28.6°,37.1°,56.2°,60.0°附近出峰 ,但 a各衍射峰的强度要高于 b,这说明 a的结晶度比 b的结晶度高。
由以上分析可以看出,随着盐酸浓度的增加,MnO2产物的晶型结构发生了变化,从层状结构的δ-MnO2变为γ-MnO2然后变成隧道结构的α-MnO2。实验还发现,进一步增加盐酸的量,晶型不再发生变化,但是产物越来越少,最后没有沉淀物,溶液变得澄清。可能原因是产物MnO2进一步与强酸发生反应,生成溶于水的二价盐。因此,室温下,控制合适的盐酸浓度可以制备不同晶型MnO2。
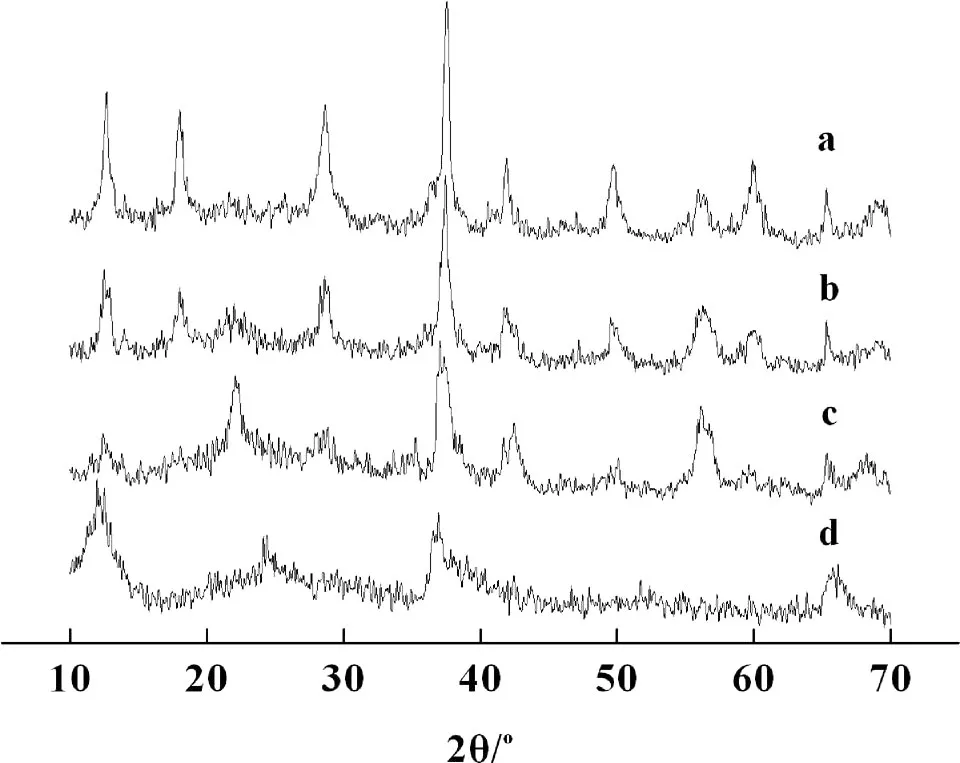
图1 不同盐酸浓度下合成MnO2的 XRD图
2.2 扫描电镜分析
图2—5为不同浓度盐酸溶液中制备的MnO2样品的电镜图。由图可以看出,随着盐酸浓度的变化,产物的形貌发生了非常明显的改变。图2为 VH2O∶VHCl=49∶1时合成 MnO2的电镜图,由图可以看出,MnO2呈球状,表面带有非常短的毛刺,MnO2微球颗粒直径约为 2μm,分布不均匀。图3为 VH2O∶VHCl=48∶2时所得MnO2材料的电镜图。由图可以看出,在此条件下生成的MnO2仍然是微米球,但是球的颗粒大小分布更为均匀,并且球上出现了许多放射状的毛刺,与图2相比,这些毛刺更长更密,毛刺的直径约在 50—100 nm之间。此外,从有些球可以看出该刺球为空心结构。图4中,除了和图3中较为相似的纳米刺球外,还可以观察到一些块状物的存在,上面带有残存的毛刺,说明溶液酸性较强时,合成样品中有部分刺球已经开始被破坏。当溶液的酸性进一步增强,这些刺球将被完全破坏,只见到一些无规则的颗粒碎片,如图5所示。值得一提的是,文献中合成MnO2刺球,需要水热条件或者是添加特定的还原剂[12],合成空心刺球,需要添加某些金属离子[13]。本实验不需要水热和添加任何离子,只需控制好盐酸溶液的浓度,即可以合成具有空心结构的MnO2刺球,并且刺球的粒径均匀。由此可见,产物的形貌因为加入盐酸的量不同而产生了很大的变化,当 VH2O∶VHCl=48∶2时 ,合成的 MnO2微米球带有长而密的纳米刺,并且微米球分布均匀。

图2 VH2O ∶VHCl=49∶1时合成 MnO2电镜图

图3 VH2O ∶VHCl=48∶2时合成 MnO2电镜图
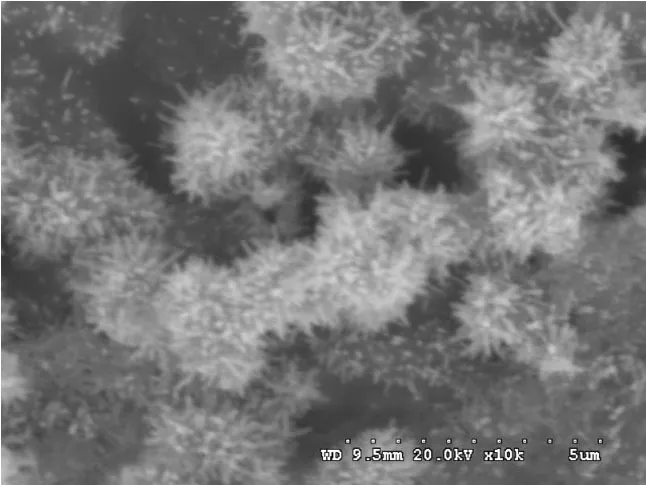
图4 VH2O ∶VHCl=46∶4时合成 MnO2电镜图

图5 VH2O ∶VHCl=44∶6时合成 MnO2电镜图
2.3 电化学性能测试
为了研究室温条件下盐酸溶液浓度对合成MnO2电化学性能的影响,实验将不同条件合成的MnO2制备成电池正极,以金属锂片为电池负极,在2—4V电压范围内,30mAg-1电流下进行充放电测试。
图6为不同浓度盐酸溶液中合成产物的首周放电性能曲线。a、b、c、d分别为盐酸体积比为 2%,4%,8%,12%时合成样品的放电曲线。由图6可见,随着溶液酸性的增强,合成样品的放电比容量先增加 ,后降低。当 VH2O∶VHCl=48∶2时 ,合成样品的放电比容量最高,达到 172 mA h·g-1,如图6中曲线 b所示。不同条件下合成的样品的放电性能的差异可能与两个因素有关,一是晶体的晶型结构不同引起的。晶体结构不同,晶格中的孔隙大小和结构不同,充放电过程中,锂离子在晶体中受力不同,并且移动的路径不同。这些因素可能导致不同晶型的MnO2具有不同的充放电性能。二是晶体的形貌引起的。材料的形貌不同将导致颗粒的大小和比表面积不同。颗粒小、比表面积大的材料在充放电过程中利用更充分,比容量更高。盐酸体积比为 4%时合成的样品具有很特别的形貌,其表面分布有很多长而密的纳米刺,并且从电镜图可以看出,其内部为空心结构。这种特殊的结构可能是该样品具有较高比容量的原因。

图6 不同酸度合成的MnO2的首次放电曲线图
可充锂离子电池的循环性能是电池材料的重要指标。因此,实验测试了形貌均匀、性能较好的刺球MnO2的循环性能,如图7所示。由图7可以看出,样品具有较高的首次放电比容量,达到 172mA h·g-1。第二周和第三周,样品的比容量衰减很快,随后,样品的比容量逐渐趋于稳定,循环 50周后,样品的比容量仍然有 100mA h·g-1。循环性能测试表明,MnO2刺球材料具有较好的循环性能。MnO2刺球开始几周容量的衰减现象和文献一致[14]。容量的衰减和材料的结构以及电极的结构有关。MnO2材料结构不稳定,在锂离子嵌入和脱出过程中,材料内部的孔道部分发生坍塌,阻碍了锂离子的扩散运动。并且,在充放电过程中,MnO2发生反应,产生不可逆产物 (如 Mn3O4),这些不可逆产物,一方面导致活性物质的减少,另一方面包覆在活性物质表面,阻碍化学反应的进行。这些都导致MnO2放电比容量的降低。文献[15]还表明,充放电过程中,活性物质颗粒之间、活性物质与导电活性碳材料以及电极之间的接触变差,将导致电池材料内阻增加,也将导致活性物质比容量的下降。进一步提高材料的循环性能还在研究中。

图7 MnO2刺球的放电循环曲线图
3 结论
本文采用简单的方法合成了MnO2刺球。实验不需要水热条件、模板剂和还原剂,在室温下,盐酸溶液中高锰酸钾直接分解法合成刺球。研究表明,刺球的均匀性和表面形貌可以通过改变盐酸的浓度进行调节。并且,不同浓度盐酸溶液中合成的MnO2材料具有不同的晶型结构。当盐酸体积百分比为4%时,合成样品为γ-MnO2,具有球形结构,球体大小均匀,表面分布有长而密的纳米刺。该样品具有较高的放电比容量和较好的循环性能。
[1] Wang X,Li Y D.Selected-control hydrothermal synthesis of alpha-and beta-MnO2single crystal nanowires[J].Journal of the American Chemical Society,2002,124:2880-2881.
[2] Wang X,Li YD.Synthesis and For mation Mechanism of Manganese Dioxide Nanowires/Nanorod[J].Chem.Eur.,2003,9(1):300-306.
[3] Tang X.Synthesis and capacitive property of hierarchical hollow manganese oxide nanospheres with large speci?c surface area[J].J Power Sources,2009,193:939-943.
[4] Staiti P,Lufran F.Study and optimisation of manganese oxide-based electrodes for electrochemical supercapacitors[J].Journal of Power Sources,2009,187:284-289.
[5] Reddy R N,Reddy R G.Synthesis and electrochemical characterization of amorphous MnO2electrochemical capacitor electrode material[J].J Power Sources,2004,132(1):315-320.
[6] Chen Y,Zhang M L,Jing X Y.Preparation and characterization of rod- shaped MnO2crystal[J].Solid State Communications,2005,133(2):121-123.
[7] Xu R,Wang X,Wang D S.Surface structure effects in nanocrystal MnO2and Ag/MnO2catalytic oxidation of CO[J].Journal of Catalysis,2006,237(2):426.
[8] LIX,Chen X,Shi C.Hydrothermal synthesis and charaeterization of orehid - like MnO2nanostruetures[J].Journal of Crystal Growth,2006,297(2):387-389.
[9] Li W N,Yuan J K,Shen X F.Hydrothermal synthesis of strueture- and shape- controlled manganese oxide oetahedral molecular sieve nanomaterials[J].Ady Funet Mater,2006,16:1247-1253.
[10] Zhu G.Low-temperature synthesis of δ-MnO2with large surface area and its capacitance[J].Materials Letters,2010,64(5):1763-1765.
[11] Laboratoire.One-Step Electrochemical synthesis of α-MnO2andα·γ-MnO2compounds for lithium batteries[J].Electrochemical and Solid-State Letters,2001,4(11):180-183.
[12] Yuan J,Li W N,Sinue G,et al.Shape-controlled synthesis of manganese oxide octahedral molecular sieve three-dimensional nanostructures[J].J AM CHEM,2005,127:14184-14185.
[13] He X X,Yang M Y,Ni P,et al.Rapid synthesis of hollow structured MnO2microspheres and their capacitance[J].Colloids and Surfaces A:Physicochem Eng Aspects,2010,363,64-70.
[14] Cheng F,Zhao J,Wene S,et al.Facile controlled synthesis of MnO2nanostructures of novel shapes and their application in batteries[J].Inorganic Chemistry,2006,45,2038-2044.
[15] Hsieh Y C,Lee K T,Lin Y P,et al.Investigation on capacity fading of aqueous MnO2·nH2O electrochemical capacitor[J].J Power Sources,2008,177:660-664.

