黄伞子实体多糖PAP2的分离纯化及其结构初步鉴定
聂永心,姜红霞,苏延友,朱常香,温孚江
1(山东农业大学作物生物学国家重点实验室,山东泰安,271018)2(泰山医学院,山东泰安,271016)
真菌多糖是自然界中存在种类较多、生物活性较高的一类活性多糖,近年来研究发现,真菌多糖具有免疫增强与调节、抗肿瘤、抗氧化、抗衰老等广泛的生物活性[1-2],是公认的安全低毒活性物质,成为国内外专家学者关注的焦点。数据显示,黄伞多糖具有抑菌[3]、抗氧化[4]、抗肿瘤[5-6]等广泛的生物活性。目前有关黄伞子实体多糖的研究很少,对其多糖的分离纯化及结构分析方面还未见有报道。本研究主要对黄伞子实体多糖进行提取与纯化,通过高效液相色谱(HPLC)、高效凝胶渗透色谱(HPGPC)、红外光谱(IR)、核磁共振(NMR)等方法对其结构进行初步鉴定,以期为进一步研究黄伞子实体多糖的药理作用及构效关系提供参考。
1 材料与方法
1.1 材料与试剂
黄伞子实体,由泰山医学院苏延友教授培育提供;单糖标准品,上海国药集团,三氟乙酸(TFA),Sigma公司,Dextran系列标准品,GE公司产品;无水乙醇、甲醇、氯仿、正丁醇等所用试剂均为国产分析纯。
1.2 主要仪器与设备
KTA Purifier纯化系统,美国GE公司;S-3100紫外分光光度计,韩国SCINCO公司;Agilent 1200高效液相色谱仪(配备1200 serials蒸发光散射检测器),美国安捷伦公司;Nicolet380傅立叶变换红外光谱仪,美国热电集团;AVANCE 600傅立叶变换核磁共振波谱仪,瑞士布鲁克公司
1.3 方法
1.3.1 黄伞子实体多糖的提取纯化
称取黄伞子实体100 g,加入1∶1的乙醇-乙醚混合液,于65℃水浴回流脱脂2 h,残渣中加适量水(水料比20∶1),100℃水浴提取3次,每次4 h,过滤,将滤液合并,浓缩,加入氯仿-正丁醇(4∶1),充分振荡30 min,5 000 r/min离心20 min,取上层水相重复除蛋白质8次,水相用1 mol/L的HCl调节pH至4.0,加入1%的活性炭,50℃脱色30 min,离心除去活性碳,重复2次,上清液过滤,加入5倍体积的无水乙醇,4℃静置过夜,离心,加适量水溶解,真空冷冻干燥得灰白色絮状黄伞子实体粗多糖(PAP)。
将PAP过DEAE-Sepharose Fast Flow柱(1.6 cm×10 cm),先以蒸馏水洗脱,再用0~2 mol/L的NaCl进行梯度洗脱,洗脱液3 mL/管收集,苯酚硫酸法A490检测,合并相同流分,浓缩,透析,冷冻干燥得PAP1和PAP2两个组分,PAP2为主要组分。PAP2再过SuperdexTM200柱(1 cm×30 cm),蒸馏水洗脱,1 mL/管收集,苯酚硫酸法A490检测,合并相同流分,浓缩,透析,冷冻干燥,得白色絮状黄伞子实体多糖(PAP2)。
1.3.2 黄伞子实体多糖PAP2的均一性和分子质量测定
采用高效凝胶渗透色谱法(HPGPC)对PAP2进行均一性及分子质量的测定。色谱条件:色谱柱为TSK-G4000PWXL 柱(7.8 mm ×300 mm,10 μm),流动相为双重纯蒸水;流速1 mL/min;进样量20 μL;柱温40℃;蒸发光散射检测器(ELSD)检测。
1.3.3 HPLC-ELSD法测定黄伞子实体多糖PAP2的单糖组成
(1)色谱条件:Prevail Carbohydrate ES柱(4.6 mm ×250 mm,5 μm),柱温 25℃;流动相为乙腈-水(85∶15),流速0.8 mL/min;ELSD检测器温度80℃,辅助气(N2)压力3.5 bar,增益(gain)为6。
(2)样品处理:称取5 mg黄伞子实体多糖于安培瓶中,加入2 mol/L三氟乙酸(TFA)2 mL,110℃封管水解2 h,水解液减压浓缩至干,再加甲醇3 mL蒸干,重复3次,以除尽TFA。加少量水溶解,水解产物经0.45 μm微孔滤膜过滤,取滤液20 μL用于液相分析,与7种标准单糖对照品的色谱图比较确定单糖的种类和比例。
1.3.4 黄伞子实体多糖PAP2的红外光谱分析
称取5 mg黄伞子实体多糖PAP2与200 mg干燥的KBr粉末在研钵中研磨均匀,压片,上机在4000~400 cm-1内进行扫描。
1.3.5 黄伞子实体多糖PAP2的核磁共振波谱分析
取10 mg多糖PAP2溶于0.5 mL重水中,在核磁共振仪上进行1H NMR、13C NMR谱测定。
2 结果与分析
2.1 黄伞子实体多糖PAP2的分离纯化
黄伞子实体经热水提取、醇沉、Sevag脱蛋白及活性炭脱色得黄伞子实体粗多糖(PAP),PAP经DEAESepharose Fast Flow离子交换柱分离得到2个组分(如图1A),其中PAP2为主要组分;PAP2经SuperdexTM200凝胶柱进一步分离纯化得到1个组分(如图1B),将洗脱液浓缩、透析、冷冻干燥得白色絮状多糖PAP2。
2.2 PAP2的均一性及分子质量测定
将系列葡聚糖(Dextran)标准品用超纯水配成质量体积分数为0.2%的溶液,按上述HPGPC色谱条件测定保留时间,与葡聚糖标准品分子质量对数作图得线性回归方程:lgMw=8.558 4-0.4849tR,r2=0.997。PAP2在HPGPC上得到一个单一对称峰(如图2所示),表明其为均一组分。根据PAP2的保留时间,由回归方程计算得PAP2的平均分子质量为2.1 ×106u。
2.3 PAP2的单糖组成分析
黄伞子实体多糖水解产物的高效液相色谱分析结果如图4所示,与混合标准单糖的高效液相色谱图(图3)中各标准单糖的保留时间进行对照分析,发现在黄伞子实体纯化多糖PAP2水解产物中只有葡萄糖,表明其是由葡萄糖组成的均一多糖。本课题组前期研究表明黄伞子实体多糖(PAP)单糖组成中主要含有葡萄糖外,还含有少量木糖和甘露糖[7],可能为其他多糖组分含有的单糖或游离的单糖。
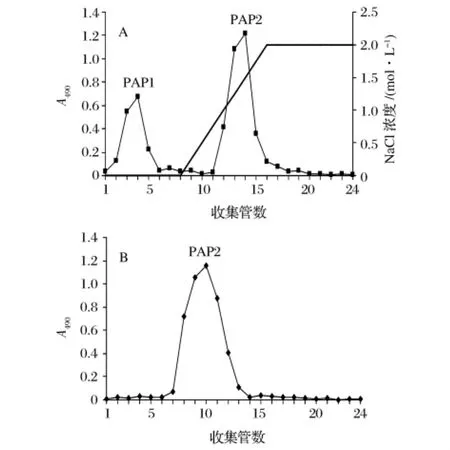
图1 黄伞子实体多糖(PAP)的DEAE-Sepharose Fast Flow(A)与SuperdexTM 200(B)柱层析图
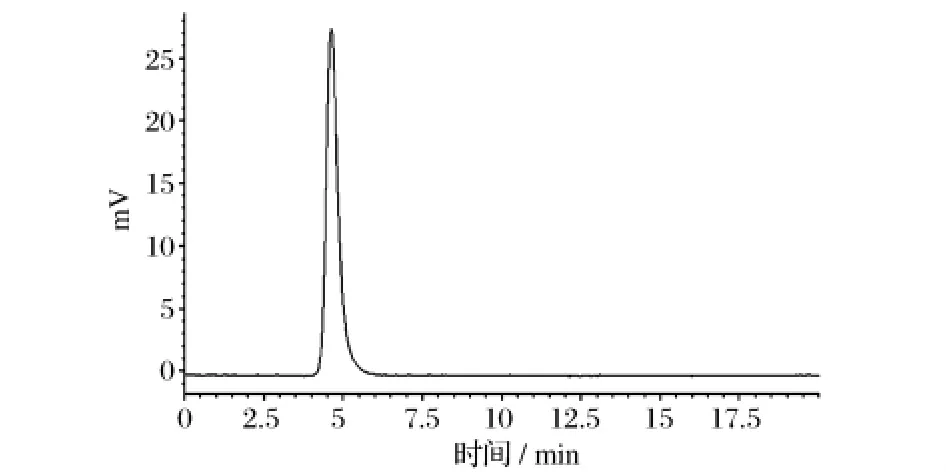
图2 黄伞子实体多糖纯化组分PAP2的HPSEC色谱图
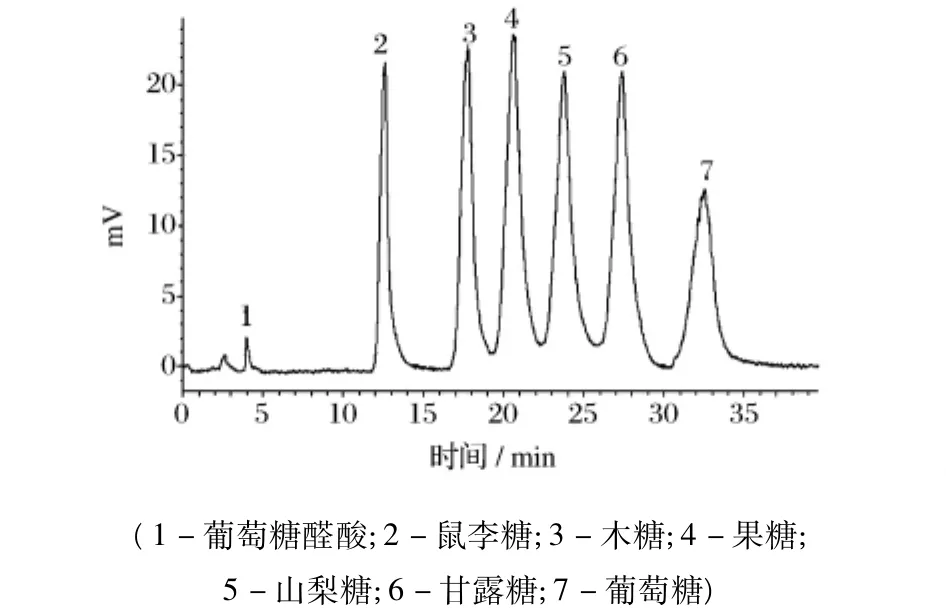
图3 7种标准单糖的高效液相色谱图
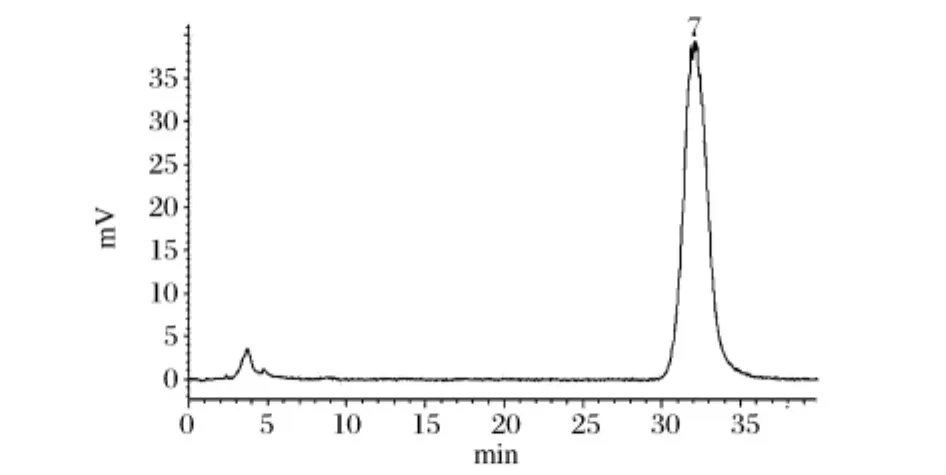
图4 黄伞子实体多糖PAP2中单糖组分的高效液相色谱图
2.4 PAP2的红外光谱分析
PAP2红外光谱分析结果如图5所示,其中3 349.34 cm-1处的强吸收峰是-OH伸缩振动引起的吸收;2 921.86 cm-1为饱和C-H伸缩振动吸收;在1 641.74 cm-1的 峰 是 多 糖 水 合 振 动 吸 收 峰[8];1 369.07 cm-1出现的峰是由于C-H变角振动引起的;1 150.42 cm-1、1 078.99 cm-1、1 022.77 cm-1三个峰为吡喃糖环特征吸收峰,是其糖苷键C-O-C的非对 称振 动峰[9]; 红 外光 谱在 860.82 cm-1、930.09 cm-1的吸收峰,为α型葡聚糖的振动光谱特征带[10],761.44 cm-1的吸收峰表明存在葡萄吡喃糖残基,在1 730 cm-1左右没有吸收峰表明不含糖醛酸。红外分析结果表明PAP2是一种α-D-吡喃葡聚糖,与单糖组成分析结果一致。

图5 黄伞子实体多糖纯化组分PAP2的红外光谱图
2.5 PAP2的核磁共振波谱分析
黄伞子实体多糖PAP2的1H NMR如图6所示。在PAP2的1H NMR谱图中,异头质子的共振区域δ 4.6~5.5 ppm只存在一个异头氢的共振峰δ 5.403,说明PAP2只有一种单糖组成,这与单糖组成分析结果一致,其质子化学位移大于4.95,表明这些糖残基为 α 型吡喃糖[11]。
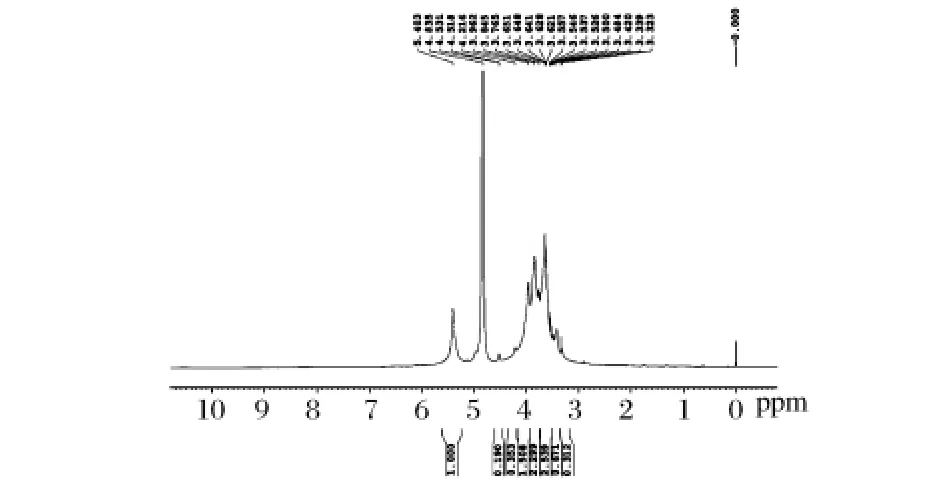
图6 黄伞子实体多糖纯化组分PAP2的1H NMR谱图(注:图中吸收峰从左到右依次为 5.403、4.835、4.531、4.518、4.216、3.962、3.845、3.765、3.651、3.648、3.641、3.628、3.621、3.557、3.546、3.537、3.526、3.500、3.484、3.420、3.339、3.232ppm)
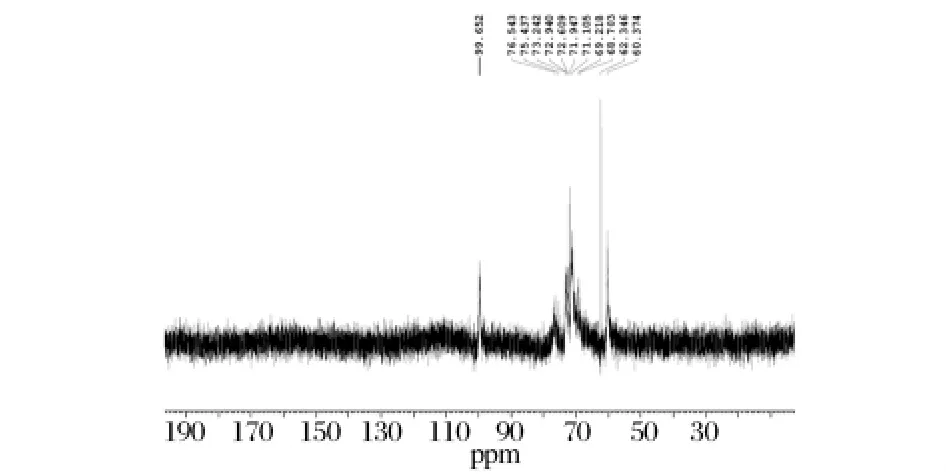
图7 黄伞子实体多糖纯化组分PAP2的13C NMR谱图
黄伞子实体多糖PAP2的13C NMR谱如图7所示。在PAP2的13C NMR谱图中,低场区化学位移δ 99.652 ppm处的信号为葡萄糖残基的异头碳信号,由于化学位移小于δ 103,表明葡萄糖残基的构型为α吡喃型[12],这与IR结果一致。在13C NMR谱中δ 99.652 ppm 处的位移,表明 C1 发生取代[13];δ 76.543 ppm的信号表明糖链中存在C4位取代的葡萄糖残基;δ 69.21 ppm附近的化学位移为6位取代的碳信号[14];δ 62.346 ppm 处的强吸收峰说明大部分葡萄糖的C6未发生取代;在δ 82.5 ppm附近没有吸收峰,表明C3没有发生取代。根据峰高比例大致可以看出黄伞子实体多糖PAP2的主链为1-4糖苷键,存在1-6糖苷键的支链。
3 结论
通过热水提取、sevag脱蛋白、活性炭脱色、柱层析等方法,首次从黄伞子实体中分离得到一种水溶性多糖组分PAP2,并对其结构进行了初步鉴定。经HPGPC、HPLC-ESLD、IR、NMR 等方法分析,确定黄伞子实体纯化多糖PAP2的分子质量约为2.1×106u,由α-D吡喃葡萄糖残基组成的葡聚糖,主链为1-4糖苷键,存在1-6糖苷键的支链。
[1] Sun Y X,Wang S S,Li T B,et al.Purification,structure and immunobiological activity of a new water-soluble polysaccharide from the mycelium ofPolyporusalbicans(Imaz.)Teng[J].Bioresour Technol,2008,99:900 -904.
[2] Chen Y,Xie M Y,Nie S P,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J].Food Chem,2008,107:231–241.
[3] Basaran Dulger.Antimicrobial activity of the macrofungus Pholiota adiposa[J].Fitoterapia,2004,75:395 -397.
[4] Deng P,Zhang G Q,Zhou B,et al.Extraction and in vitro antioxidant activity of intracellular polysaccharide by Pholiota adiposa SX -02[J].J Biosci Bioeng,2011,111:50-54.
[5] 蒋晓琴,丁晓明,刘海燕,等.黄伞粗多糖抗肿瘤及对荷瘤小鼠免疫功能影响的研究[J].中国药师,2007,10(2):119-121.
[6] 赵永勋,李克颖,张跃华.多脂鳞伞菌丝体多糖抗肿瘤活性研究[J].食用菌学报,2007,14(2):49-51.
[7] 聂永心,姜红霞,苏延友,等.黄伞子实体多糖的提取纯化及单糖组成分析[J].食品与发酵工业,2010,36(4):198-200.
[8] 张惟杰.糖复合物生化研究技术[M].2版.杭州:浙江大学出版社,1999:196-197.
[9] Zhao G,Kan J,Li Z,et al.Structural features and immunological activity of a polysaccharide from Dioscorea opposita Thunb roots[J].Carbohydr Polym,2005,61:125 -131.
[10] 周继国,刘刚,刘剑虹,等.毛头鬼伞的红外光谱研究[J].光谱学与光谱分析,2008,2(2):321-323.
[11] Wu Y L,Pan Y J,Sun C R.Isolation,purification and structural investigation of a water-soluble polysaccharide from Solanum lyratum Thunb[J].Int J Biol Macromol,2005,36(4):241-245.
[12] Gorin P A J.Carbon 13 nuclear magnetic resonance spectroscopy of polysaccharides[J].Adv Carbodydr Chem Biochem,1981,38:13-39.
[13] Peng Y F,Zhang L N,Zeng F B,et al.Structure and antitumor activities of the water-soluble polysaccharides from Ganoderma tsugae mycelium[J].Carbohydr Polym,2005,59:385-392.
[14] Bao X F,Wang X S,Dong Q,et al.Structural features of immunologically active polysaccharides from Ganoderma lucidum[J].Phytochemistry,2002,59:175-181.

