TODGA-DHOA体系从硝酸介质中萃取碱土金属
朱文彬,叶国安,李峰峰,蒋德祥,李会蓉
中国原子能科学研究院 放射化学研究所,北京 102413
乏燃料元件冷却10年后其活度的92%是由90Sr和137Cs贡献的[1];冷却100年后,乏燃料元件的释热率近80%由这两个核素贡献。90Sr是高放废液中半衰期最长的高释热裂变产物核素之一。从酸性废液中萃取锶的流程主要有2种:美国橡树岭实验室开发的SREX流程[2-3]和由美国能源部与俄罗斯共同开发的UNEX流程[4-5]。SREX流程采用二叔丁基环己基18冠6作为萃取剂,加入1.2~1.5 mol/L的TBP作为相改性剂,稀释剂改用Isopar异构烷烃溶剂。UNEX流程采用0.08 mol/L的氯化双碳烷基试剂、0.5%的聚二乙醇和0.02 mol/L CMPO作为萃取剂,苯基三氟代甲烷砜作为稀释剂,这两个流程都采用真实高放废液进行了验证实验,但萃取体系较复杂。
近年来,四川大学首先合成了结构较简单的酰胺荚醚萃取剂,并把这类萃取剂直接用于中等浓度的HNO3介质中Ln(Ⅲ)和Sr2+的萃取,从而取得了突破性进展。这类试剂辐照稳定性好,合成方法简单、成本低,由C、H、O、N组成,不含P,可以彻底焚烧,二次废物少,具有较好的应用前景。刘秀琴等[6]研究了四丁基取代的酰胺荚醚萃取液闪法测定高放废液中的Sr,认为该萃取剂对Sr的萃取能力大于二环己基18冠6(DCH18C6),并且酰胺荚醚的价格更便宜,更适于在Sr的分析中应用。早期研究主要集中在四丁基、四异丁基或不对称的酰胺荚醚方面,主要存在萃取体系必须加入辛醇来改善界面污物、且水溶性较大等问题[7]。
Sasaki等[8]研究了N,N,N′,N′-四辛基-3-氧戊二酰胺(TODGA)从硝酸介质中对各种金属离子的萃取行为,根据分配比的大小将这些金属离子分成了4组。Tachimori等[9]研究了TODGA负载容量的条件,认为TODGA的萃取容量不仅与水相酸度、温度有关,而且与烷基溶剂的分子大小和水相阳离子有关,加入单酰胺DHOA可以有效的消除三相的生成。印度的Ansari等[10]研究了TODGA的萃取热力学行为,认为TODGA的萃取过程是放热过程。Suzuki等[11]根据TODGA对Am和Sr的萃取分配比,提出了Am和Sr的两种分离方法。Morita[12]等提出并优化了基于TODGA分离Am和Sr的流程,该流程进行了计算机模型的模拟计算。
本工作以TODGA和DHOA为萃取剂,正十二烷为稀释剂,拟研究各种条件下对二价碱土金属元素的萃取行为,计算相应的热力学参数,以提出从高放废液中分离回收Sr的主要方案。
1 实验部分
1.1 试剂和仪器
N,N,N′,N′-四辛基-3-氧戊二酰胺(TODGA),由中国原子能科学研究院合成,其合成路线见文献[13]。产品经MS、IR、1H NMR、13C NMR和元素分析等手段鉴定,纯度大于98%,在萃取时未进行进一步纯化。分子结构式为:

N,N-二己基辛酰胺(DHOA)由本实验室合成,其具体合成方法见文献[14],分子结构式为:
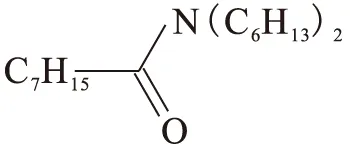
粗产品经过酸洗、碱洗、水洗后在旋转蒸发仪上除去其中的溶剂后,经过减压蒸馏得到纯产品,产品经MS、IR、1H NMR、13C NMR和元素分析等手段鉴定,纯度大于99%。
正十二烷,纯度99%,英国Alfa Aesar公司;Ca(NO3)2、Sr(NO3)2、Ba(NO3)2,分析纯,北京化学试剂公司;硝酸溶液,浓硝酸经高纯水(R>18 MΩ)稀释制得,其浓度用NaOH溶液滴定;其余试剂均为分析纯级。
JA50003N电子分析天平,上海精密科学仪器有限公司,感量为10-4g;HX-101恒温循环水槽,北京长流科学仪器公司;ZD-2型调速多用振荡器,江苏省金坛市环宇科学仪器厂;800型离心机,江苏省金坛市荣华仪器制造有限公司;ICAP 6000 ICP-OES测量仪,英国Thermo公司。
1.2 实验方法
在离心萃取管中,取一定体积(通常为1 mL)的含Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的硝酸溶液和相同体积的用相应硝酸浓度预平衡3次的有机相,在水浴恒温条件下机械震荡30 min(以前实验证实震荡时间为20 min足够达到两相的平衡),离心分相后,水相样品中Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)浓度委托北京大学公共卫生学院中心仪器测量室直接采用ICP-OES测量;有机相样品采用稀硝酸反萃3次后,合并水相用ICP-OES测量Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)浓度,分配比D定义为有机相金属离子浓度与水相金属离子浓度之比。
2 结果与讨论
2.1 TODGA和DHOA分别对碱土金属的萃取
2.1.1TODGA/正十二烷体系中TODGA初始浓度对萃取的影响 TODGA萃取碱土金属离子M(Ⅱ)时,其萃取平衡可以表示如下:
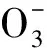
M(NO3)2·nTODGA(org)
其中aq和org分别代表水相和有机相。分配比D1与萃取平衡常数k1可以表示如下:
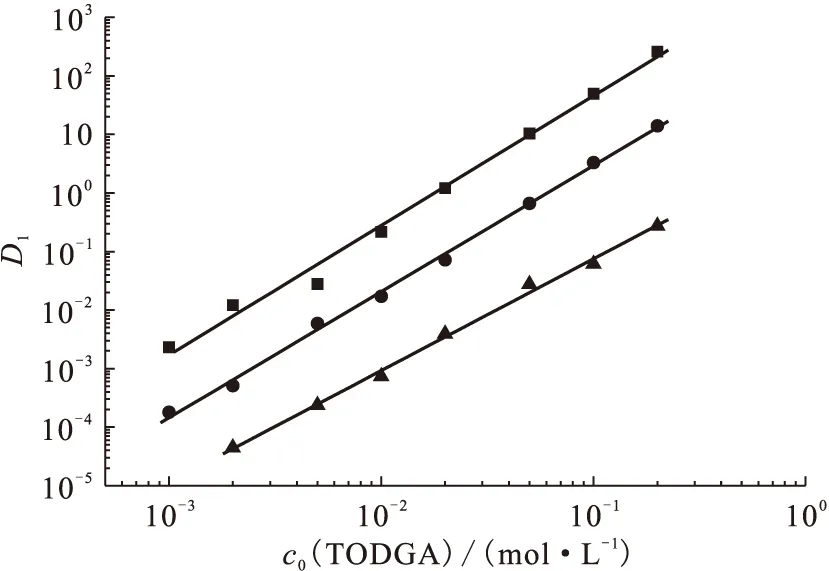
图1 TODGA初始浓度对分配比D1的影响(无DHOA)
为了考察TODGA/正十二烷萃取金属离子的萃合物的组成,研究了在(25±0.1) ℃下、在3.0 mol/L HNO3介质中、改变TODGA初始浓度对分配比的影响,结果示于图1。图1结果表明,在考察的TODGA初始浓度范围内,对于Ca(Ⅱ)、Sr(Ⅱ)和Ba(Ⅱ),lgD1与lgcorg(TODGA)呈线性关系,其直线斜率分别为2.21±0.08、2.15±0.04和1.91±0.05。对于TODGA/正十二烷萃取碱土金属元素,其lgD1与lgcorg(TODGA)的直线斜率均约为2,表明在不存在DHOA情况下,1个碱土金属离子与2个TODGA分子形成萃合物M(Ⅱ)·2TODGA。在研究的条件下,Ca(Ⅱ)的分配比大于Sr(Ⅱ)的分配比,Ba(Ⅱ)的分配比最小。这可能与金属离子的离子半径存在一定关系(Ca2+的离子半径为0.099 nm,Sr2+的离子半径为0.113 nm,Ba2+的离子半径为0.135 nm),随着离子半径的增加,TODGA/正十二烷萃取碱土金属离子的分配比降低。
2.1.2DHOA/正十二烷体系中DHOA初始浓度对萃取的影响 DHOA萃取碱土金属离子M(Ⅱ)时,其萃取平衡可以表示如下:
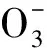
M(NO3)2·nDHOA(org)
分配比D2与萃取平衡常数k2可以表示如下:
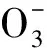
同样条件下研究了有机相中不存在TODGA时,DHOA/正十二烷对Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的萃取行为,结果示于图2。图2结果表明,在萃取体系中不存在TODGA时,DHOA对Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)存在一定的萃取,对于Ba(Ⅱ)而言其分配比约为3,而对Ca(Ⅱ)和Sr(Ⅱ)其萃取分配比约为1。在考察的DHOA初始浓度范围内lgD2与lgcorg(DHOA)呈线性关系,其直线斜率分别为0.02±0.02、0.03±0.02和0.01±0.02,表明DHOA初始浓度对从硝酸介质中萃取Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的分配比影响不大。
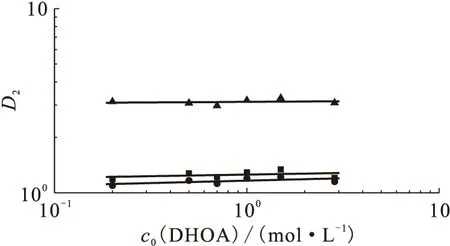
图2 DHOA初始浓度对分配比D2的影响(无TODGA)
2.2 TODGA与DHOA同时存在时对碱土金属的萃取行为
2.2.1TODGA初始浓度的影响 有机相体系中当DHOA初始浓度固定为1.0 mol/L时,改变TODGA初始浓度,研究了该体系从3.0 mol/L HNO3介质中对Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的萃取行为,结果示于图3。图3结果表明,DHOA初始浓度固定为1.0 mol/L,在考察的TODGA初始浓度范围内,对于Ca(Ⅱ)、Sr(Ⅱ)和Ba(Ⅱ)而言,lgD与lgcorg(TODGA)呈线性关系,其直线斜率分别为1.94±0.08、1.93±0.11、1.84±0.05,其分配比均随着TODGA初始浓度的增加而增加。对于TODGA/正十二烷萃取碱土金属元素,其lgD与lgcorg(TODGA)的直线斜率均约为2,表明在存在DHOA情况下时,1个碱土金属离子同样与2个TODGA分子形成萃合物M(Ⅱ)·2TODGA。
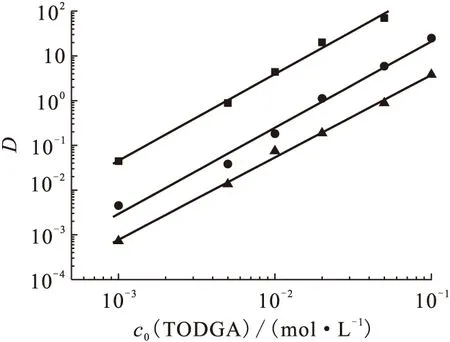
图3 存在1.0 mol/L DHOA时TODGA初始浓度对分配比D的影响
2.2.2DHOA初始浓度的影响 有机相体系中当TODGA初始浓度固定为0.1 mol/L时,改变DHOA初始浓度,研究了该体系从3.0 mol/L HNO3介质中对Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的萃取行为,结果示于图4。图4结果表明,当TODGA初始浓度为0.1 mol/L时,改变DHOA初始浓度,随着DHOA初始浓度的增加,它们的萃取分配比均是降低的,并且在考察的DHOA初始浓度范围内,对于Ca(Ⅱ)、Sr(Ⅱ)和Ba(Ⅱ)而言,lgD与lgcorg(DHOA)呈线性关系,其直线斜率分别为-1.08±0.10、-1.16±0.09、-1.12±0.04。其lgD与lgcorg(DHOA)的直线斜率均约为-1,表明在该萃取体系下,DHOA抑制TODGA对碱土金属的萃取。通过上述2种萃取剂对二价碱土金属离子的萃取行为研究表明,TODGA和DHOA分别萃取二价碱土金属离子的分配比之和D1+D2大于在相同条件下两种萃取剂混合时的萃取分配比,表明这2种萃取剂混合萃取二价碱土金属离子时具有反协同效应,导致分配比降低。
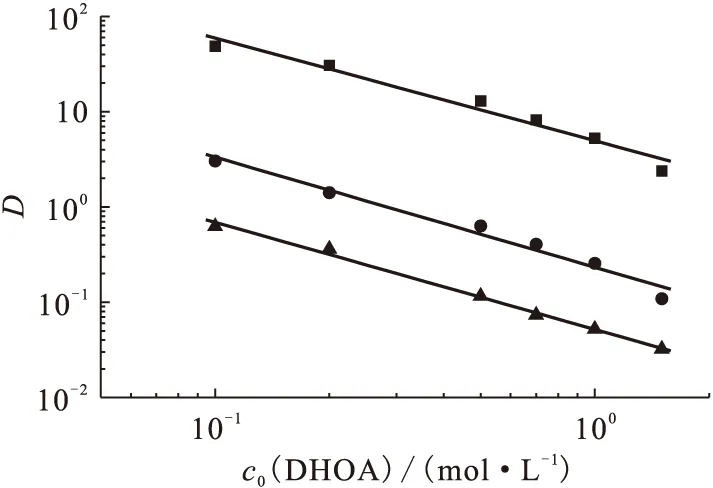
图4 存在0.1 mol/L TODGA时DHOA初始浓度对萃取分配比D的影响

图5 HNO3初始浓度对萃取分配比D的影响
2.2.3HNO3初始浓度的影响 研究了有机相体系为0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷时在不同硝酸初始浓度介质中对Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的萃取行为,结果示于图5。图5结果表明,在硝酸初始浓度为0.1~3.0 mol/L范围内,随着初始硝酸浓度的增加,0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷萃取Ca(Ⅱ)、Sr(Ⅱ)和Ba(Ⅱ)的分配比增加,并且lgD与lgcaq(HNO3)呈线性关系,其直线斜率分别为2.17±0.12、1.83±0.06和1.94±0.11;当硝酸初始浓度大于3.0 mol/L时,随着硝酸初始浓度的增加,Ca(Ⅱ)、Sr(Ⅱ)和Ba(Ⅱ)的分配比降低。硝酸初始浓度在0.1~3.0 mol/L范围内,由于硝酸的盐析作用,使得TODGA萃取碱土金属离子的分配比增加,当硝酸初始浓度大于3.0 mol/L时,由于TODGA对硝酸有一定的萃取,此时,硝酸主要起竞争作用,导致TODGA萃取Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的分配比降低。表明0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷萃取碱土金属离子的最佳硝酸初始浓度为3.0 mol/L左右。
2.2.4NaNO3初始浓度的影响 研究了有机相体系为0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷时对Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的萃取行为,水相硝酸初始浓度为1.0 mol/L,改变NaNO3初始浓度后,其萃取结果示于图6。图6结果表明,当萃取体系为0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷、水相硝酸初始浓度为1.0 mol/L时,在考察的NaNO3初始浓度范围内,0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷萃取Ca(Ⅱ)、Sr(Ⅱ)的分配比增加,随着NaNO3初始浓度的增加,萃取盐析作用明显增加,导致萃取分配比增加,且lgD与lgcaq(NaNO3)呈线性关系,其直线斜率分别为1.17±0.04、0.94±0.16,在整个考察的NaNO3初始浓度范围内,Ba(Ⅱ)的分配比基本保持不变,直线斜率为-0.09±0.07,可能的原因是,该萃取体系对Ba(Ⅱ)基本不萃取,盐析作用不明显。
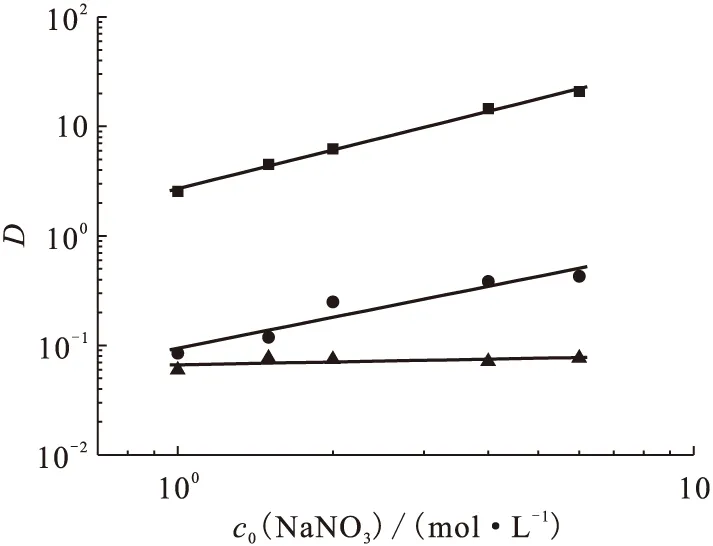
图6 NaNO3初始浓度对萃取分配比D的影响
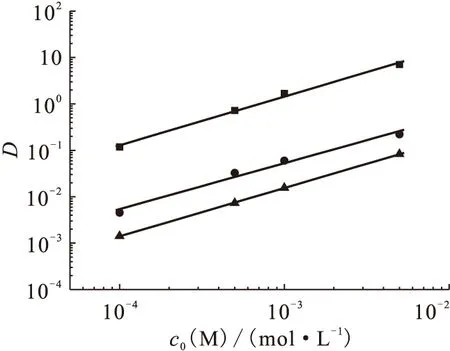
图7 被萃取金属离子浓度对萃取分配比D的影响
2.2.5被萃取金属离子浓度的影响 研究了有机相体系0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷对Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的萃取行为,水相硝酸初始浓度为3.0 mol/L,被萃取金属离子浓度变化范围为1×10-4~5×10-3mol/L,其萃取结果示于图7。图7结果表明,当萃取体系为0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷、水相硝酸初始浓度为3.0 mol/L时,在考察的Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)浓度范围内,0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷萃取Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的分配比随着金属离子浓度的增加而增加,lgD与lgcaq(M(Ⅱ))呈线性关系,其直线斜率分别为1.05±0.05、0.99±0.08、1.05±0.05,对于TODGA萃取Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)而言,形成的络合物组成中仅有一个金属离子参与配位,形成单核配位化合物。
2.2.6温度的影响 对于TODGA萃取二价碱土金属离子,其萃取平衡方程式可以表示如下:
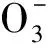
M(NO3)2·2TODGA(org)
(1)
其平衡常数Kex可以表示如下:
Kex=αorg(M(NO3)2·2TODGA)·
γ(M(NO3)2·2TODGA)/
(2)
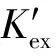
(3)
则分配比为:
(4)
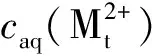
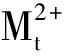
(5)
因此方程(3)可以表示为:
(6)
(7)
ΔH=-R×2.303×slope
(8)
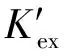
(9)
ΔG=ΔH-TΔS
(10)
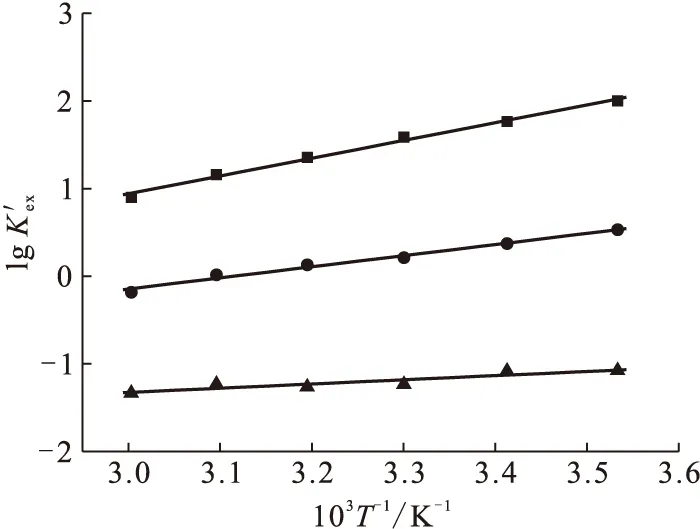
图8 lg 与温度变化的关系

表1 20 ℃下萃取碱土金属离子热力学参数
注(Note):水相(Aqueous phase):3.0 mol/L HNO3,5×10-3mol/L M(Ⅱ);有机相(Organic phase):0.1 mol/L TODGA /正十二烷(n-dodecane)
3 结 论
(1) DHOA/正十二烷对Ca(Ⅱ)、Sr(Ⅱ)的萃取分配比约为1,对Ba(Ⅱ)的分配比约为3,而且DHOA初始浓度变化对萃取分配比影响不大;在TODGA/正十二烷萃取体系中,随着TODGA初始浓度的增加,Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的分配比增加;
(2) 在混合萃取体系中,DHOA会抑制TODGA对碱土金属的萃取,随着DHOA初始浓度的增加,TODGA萃取Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的分配比降低;硝酸初始浓度在整个萃取中对分配比的影响比较大,硝酸初始浓度为3.0 mol/L时,Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的分配比达到最大值;
(3) 温度实验结果表明:TODGA萃取Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)本质上都是放热反应;萃取过程中焓变起主导作用;吉布斯自由能(-ΔG)变化的顺序说明Ca(Ⅱ)最容易被萃取,Sr(Ⅱ)其次,Ba(Ⅱ)的萃取效果最差。
在TODGA中加入DHOA可以降低TODGA对Ca(Ⅱ)、Sr(Ⅱ)、Ba(Ⅱ)的萃取分配比,因此TODGA和DHOA的组合可以有效的阻止TODGA从HLLW中对Sr(Ⅱ)的萃取,当DHOA初始浓度大于1.0 mol/L时,Sr(Ⅱ)的分配比远小于1。在应用TODGA从高放废液中分离锕系和镧系元素时,可以首先采用0.1 mol/L TODGA-1.0 mol/L DHOA/正十二烷将锕系和镧系从高放废液中进行分离,Sr(Ⅱ)保留在萃余水相中,然后再采用0.1 mol/L TODGA/正十二烷从萃余水相中回收Sr(Ⅱ)。
[1] 童利斌. 杯冠化合物的制备及其对酸性废液中137Cs的萃取性能研究[D]. 北京:清华大学,2000.
[2] Wood D J,Tranter T J. Effect of the Interference of Alkaline Earth Metal Ions on the Extraction of90Sr From Acidic Nuclear Waste Solutions by 18-Crown-6 Derivatives[J]. Solvent Extr Ion Exch,1995,13(5): 829-844.
[3] Wood D J,Law J D. Evaluation of the SREX Solvent Extraction Process for the Removel90Sr and Hazardous Metals From Acidic Nuclear Waste Solutions Containing High Concentrations of Interfering Alkali Metal Ions[J]. Sep Sci Technol,1997,32(1-4): 241-253.
[4] Romanovsky V N,Smirnov I G,Babain V A. The Universal Solvent Extraction Process I. Development of the UNEX Process Solvent for the Separation of Cesium,Strontium,and the Actinides From Acidic Radioactive Waste[J]. Solvent Extr Ion Exch,2001,19(1): 1-21.
[5] Law J D,Herbst R S. The Universal Solvent Extraction ProcessⅡ. Flowsheet Development and Demonstration of the UNEX Process for the Separation of Ceium,Strontium,and the Actinides From Acidic Radioactive Waste [J]. Solvent Extr Ion Exch,2001,19(1): 23-36.
[6] 刘秀琴,粱俊福,郭一飞,等.TIBOGA萃取液闪法测定高放废液中的89,90Sr[J].原子能科学技术,2000,34(增刊):134-138.
[7] 叶国安,何建玉,姜永青.酰胺荚醚对Am(Ⅲ)和Eu(Ⅲ)的萃取行为研究:Ⅰ.萃取机理研究[J].核化学与放射化学,2000,22(2):65-70.
[8] Sasaki Y,Zhu Zhi-xuan,Sugo Y,et al. Novel Compounds,Diglycolamides(DGA),for Extraction of Various Metal Ions From Nitric Acid to n-Dodecane[C]∥Proceedings of GLOBAL 2005. Tsukuba,Japan,Oct. 9-13,2005 paper No.344.
[9] Tachimori S,Sasaki Y,Suzuki S. Modification of TODGA-n-Dodecane Solvent With a Monoamide for High Loading of Lanthanides(Ⅲ) and Acti-nides(Ⅲ)[J]. Solvent Extr Ion Exch,2002,20(6): 687-699.
[10] Ansari S A,Pathak P N,Husain M,et al. Extraction of Actinides UsingN,N,N′,N′-Tetraoctyl Diglycolamide(TODGA):A Thermodynamic Study[J]. Radiochim Acta,2006,94: 307-312.
[11] Suzuki H,Sasaki Y,Sugo Y,et al. Extraction and Separation of Am(Ⅲ) and Sr(Ⅱ) byN,N,N′,N′-Tetraoctyl-3-Oxapentanediamide(TODGA)[J]. Radiochim Acta,2004,92: 463-566.
[12] Morita Y,Sasaki Y,Tachimori S. Actinide Separation by TODGA Extraction[C]∥JAERI-Conf,2002-004: 255-260.
[13] Sasaki Y,Sugo Y,Suzuki S,et al. The Novel Extactants,Diglycolamides,for the Extraction of Lanthanides and Actinides in HNO3-n-Dodecane System[J]. Solvent Extr Ion Exch,2001,19(1): 91-103.
[14] Mowafy E A,Aly H F. Extraction of Actinides abd Selected Fission Products From Nitric Acid Medium Using Long Chain Monoamides[J]. Solvent Extr Ion Exch,2001,19(4): 629-641.

