黑龙江立克次体感染血管内皮细胞的初步研究*
孟艳芬,段长松,王锡乐,熊小路,温博海
黑龙江立克次体感染血管内皮细胞的初步研究*
孟艳芬,段长松,王锡乐,熊小路,温博海
目的 通过黑龙江立克次体感染体外培养人脐静脉内皮细胞(human umbilical vein endo thelial cells,HUVEC)探讨其在内皮细胞内的生长规律。方法将泛影葡胺密度梯度超速离心纯化的黑龙江立克次体(HLJ-054株)感染体外培养的 HUVEC,通过间接免疫荧光和扫描电镜检测与观察不同时相黑龙江立克次体在内皮细胞内的生长状况。热灭活黑龙江立克次体做平行对照。结果立克次体粘附并侵入内皮细胞,在感染后第6 h及第24 h分别为感染高峰;感染5 d后细胞内立克次体逐渐增殖,第8~9 d细胞内立克次体急剧增殖,并见细胞核内有少量立克次体,细胞出现病变,第12 d细胞内充满立克次体,大部分细胞皱缩脱落。结论黑龙江立克次体能够感染血管内皮细胞,在血管内皮细胞内不断增殖而使细胞死亡。
黑龙江立克次体;血管内皮细胞;细胞病变
立克次体属为α-变形菌纲(α-p roteobacteria)的一类专性细胞内寄生的革兰阴性菌,分为斑点热群(Spotted fever group,SFG)和斑疹伤寒群(Typhus group,TG),分别引起斑点热和斑疹伤寒。斑点热是重要的人兽共患病,经典的斑点热有立氏立克次体引起的落矶山斑点热、康氏立克次体引起的地中海斑点热(钮扣热)、西伯利亚立克次体引起的北亚热、澳大利亚立克次体引起的昆士兰斑点热、小蛛立克次体引起的立克次体痘等[1-2]。近30年来在世界各地新发现了10多种斑点热立克次体,我国已在至少10多个省、市、自治区证实有斑点热立克次体感染,并从新疆、内蒙古、黑龙江、吉林、北京等地的病人和/或蜱体内分离到斑点热立克次体[3],分子生物学研究证实从新疆、内蒙古、北京分离的斑点热立克次体为西伯利亚立克次体,而从黑龙江、吉林分离的立克次体为——斑点热立克次体新种——黑龙江立克次体(Rickettsia heilongjiangensis)[4]。
黑龙江立克次体是我国1982年首先从黑龙江绥芬河的森林革蜱(Derm acentor silvarum)分得的一斑点热群立克次体新种,1996年又从东北病人血液首次分离到该病原体,证实其对人的致病性。2003年俄罗斯亦发现黑龙江立克次体感染的急性蜱传斑点热患者和从蜱样本中扩增到该立克次体DNA[5-6]。黑龙江立克次体引起的蜱传斑点热被WHO命名为“远东蜱传斑点热”[7],为新发现的人兽共患病。
斑点热立克次体可以在体外培养的真核细胞(上皮细胞如绿猴肾上皮细胞即Vero细胞,成纤维细胞如鸡胚成纤维细胞,内皮细胞及造血细胞系等)内生长繁殖,但其在体内主要侵犯血管内皮细胞[8-9]。斑点热的发病主要是由携带立克次体的蜱直接叮咬皮肤,进入体内,首先侵染血管内皮细胞。斑点热立克次体通过其表面外膜蛋白A和B(rOmpB和 rOmp A)与血管内皮细胞表面受体Ku70结合而侵入血管内皮细胞。斑点热立克次体在宿主细胞质内生长繁殖,以其RickA蛋白诱导宿主细胞骨架肌动蛋白聚合形成肌丝,推动立克次体从细胞内释放感染相邻细胞,引起血管损伤[8-12]。斑点热立克次体感染的临床表现主要由全身血管内皮细胞损伤所致,引起急性血管炎、血管周围炎及相应器官病变。
微血管内皮细胞为斑点热群立克次体的靶细胞。本文采用体外分离培养人脐静脉内皮细胞(human um bilical vein endo the lial cells,HUVEC)作为黑龙江立克次体的宿主细胞,通过间接免疫荧光抗体染色检测和扫描电镜观察,分别测定不同时相黑龙江立克次体在宿主内皮细胞的数量,分析黑龙江立克次体感染内皮细胞及其在内皮细胞的生长增殖规律,为进一步研究黑龙江立克次体的致病机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 黑龙江立克次体054株感染鸡胚卵黄囊膜,为本室保存。
1.1.2 感染血清 黑龙江立克次体054株感染BALB/c小鼠21 d血清。
1.1.3 细胞 Vero细胞由本室保存,HUVEC由本室分离、培养。
1.1.4 细胞培养液 RPM I-1640培养液(Hy-Clone),胎牛血清(HyClone),胶原酶Ⅰ型(Gibco),0.25%胰蛋白酶(HyClone),内皮细胞培养液及内皮细胞生长添加剂(ScienCell),青、链霉素(Hy-Clone)、NaHCO3(HyClone),HEPES(HyClone),脑心浸液(Becton Dickinson)。
1.2 方法
1.2.1 黑龙江立克次体培养及纯化[13]复苏Vero细胞,加入含10%胎牛血清的 RPM I-1640培养液(p H 7.2),置37℃、5%CO2孵箱内培养长至细胞单层,分瓶传代培养。用3.7%脑心浸液研磨黑龙江立克次体感染的鸡胚卵黄囊膜,制备适当浓度的卵黄囊膜悬液,用10%悬液感染C3H/HeN小鼠,第3 d取小鼠脾脏,研磨成细胞悬液,200钼铜网过滤后感染无青、链霉素培养液(含2%~5%FBS)培养的Vero细胞单层,感染24 h后弃上清,加入新鲜培养基,置33 ℃、5%CO2孵箱内继续培养5~7 d,倒置显微镜下见细胞单层出现空斑,Giménez染色检测可见Vero细胞内黑龙江立克次体散在分布。将传代扩大培养的正常Vero细胞与黑龙江立克次体感染的Vero细胞混悬共培养,当细胞内黑龙江立克次体感染严重时富集细胞。富集的Vero细胞,经玻璃珠破碎,3 000 r/min离心20 min去除细胞碎片,17 000 r/min离心1 h富集黑龙江立克次体。将富集的黑龙江立克次体制成悬液,过泛影葡胺密度梯度,超速离心后得到纯化的黑龙江立克次体,分装并保存于-70℃冰箱备用。空斑计数定量纯化的活的黑龙江立克次体[14-16],为 1.2×107PFU/m L。
1.2.2 HUVEC培养[17]将正常产后6h内、健康新生儿脐带放入含1%青、链霉素的无菌 PBS中,4℃保存。在生物安全柜,剪除脐带破损、夹痕、血肿部分,脐静脉一端插入与三通管接通的平针头,用止血钳固定,PBS冲洗脐静脉至无血迹。脐静脉另一端用止血钳夹闭固定,向脐静脉内灌注0.1%Ⅰ型胶原酶溶液,使脐静脉完全充盈,37℃水浴孵育15~20 m in。孵育完毕,收集脐静脉内消化液,用PBS冲洗脐静脉1次,将洗液一并收集到50 m L离心管。1 200 r/m in离心10 min,弃上清,洗细胞1遍,向细胞沉淀中加入内皮细胞培养液(含5%胎牛血清、内皮细胞基础培养液 ECM、内皮细胞生长添加剂 ECGS 100 U/m L青霉素、100μg/mL链霉素),用吸管轻轻吹打制成均匀的细胞悬液,接种于25 mL细胞培养瓶,置37 ℃、5%CO2孵箱内培养24 h换新鲜培养液,以后每2~3 d换液。原代培养的 HUVEC长满培养面80%以上时,弃细胞上清,用PBS洗细胞1遍,用1 m L 0.25%胰蛋白酶室温消化2~3 min后弃胰蛋白酶,加入含血清的培养液终止胰酶消化。用吸管轻轻吹打使贴壁细胞完全脱落,收集细胞悬液,1 200 r/min离心10 min后弃上清,加入内皮细胞培养液传代培养。
1.2.3 黑龙江立克次体感染 HUVEC 将3代培养的HUVEC作为实验细胞。消化 HUVEC单层细胞成悬液,接种至铺有盖玻片的24孔细胞培养板,待 HUV EC在盖玻片上长至单层,分别用活或热灭活的黑龙江立克次体与 HUV EC(MO I=200∶1)共培养,置33 ℃、5%CO2孵箱内培养24 h后弃细胞上清,再加入细胞培养液继续培养。分别在此后1~24 h及 2~12 d取出盖玻片,用黑龙江立克次体感染小鼠21 d血清作间接免疫荧光检测(IFA),计算黑龙江立克次体感染指数及评价黑龙江立克次体在内皮细胞的增殖水平。黑龙江立克次体感染指数=每个细胞含立克次体均数×感染细胞百分率×100[18]。
1.2.4 扫描电镜观察 于24孔细胞培养板取出立克次体感染 1 d、3 d、5 d、9 d、12 d 的内皮细胞盖玻片,浸入PBS轻轻洗细胞表面,将细胞盖玻片放入含有固定剂的小瓶,在4℃固定2 h;吸出固定剂,PBS轻洗2次(每次10 min),再用预冷的10 g/L锇酸在4℃固定1 h;用 PBS轻洗2次后用系列梯度乙醇脱水(乙酸异戊酯置换),经 CO2临界点干燥后将细胞片置扫描电镜观察内皮细胞内立克次体。
2 结 果
2.1 黑龙江立克次体感染 HUV EC 用纯化的活黑龙江立克次体感染爬片生长的 HUVEC,分别在第 1 h、3 h、6 h、9 h、12 h、24 h 取出盖玻片 ,IFA 检测内皮细胞内立克次体,结果显示1~3 h内皮细胞内立克次体感染数较少,仅有约10%细胞感染,平均每个细胞内含黑龙江立克次体<1;在感染后6 h和24 h时,各出现一个感染高峰,IFA检测显示感染后第24 h约85%内皮细胞被感染。灭活黑龙江立克次体与内皮细胞共同培养,结果显示内皮细胞内立克次体数亦无明显增加(图1A)。

图1 黑龙江立克次体感染内皮细胞效率(A)及黑龙江立克次体在内皮细胞内生长曲线(B)Fig.1 R.heilong jiangensis infected HUVECs during 24 hours(A)and grew in HUVECs during 12 days(B)
2.2 黑龙江立克次体在 HUVEC内生长 黑龙江立克次体以感染爬片生长的 HUV EC 24 h后弃细胞上清,加入新的细胞培养液继续培养。将立克次体感染内皮细胞24 h定为0 d,其后每天取感染细胞荧光染色镜检。感染后第1 d,平均每个细胞内含
5~10个立克次体;感染后第1~4 d,细胞内立克次体未见明显增殖,但第5~7 d细胞内立克次体数逐渐增加,宿主细胞未见明显病变;第8~9 d细胞内立克次体急剧增加,并可见细胞胞核内有少量立克次体;第12 d胞质内弥漫立克次体,细胞由梭形变成瘦长形(图1B;图2);第15 d,大部分细胞皱缩脱落或破碎,悬浮细胞及碎片染色镜检可见大量立克次体。灭活黑龙江立克次体与内皮细胞共培养,染色镜检仅见细胞内含极少量立克次体,第5~7 d细胞内基本观察不到立克次体。
2.3 扫描电镜观察黑龙江立克次体感染 HUVEC黑龙江立克次体感染细胞后1~3 d,可见立克次体存在于内皮细胞胞质中,当立克次体进入胞质,以游离状态分散于胞质内,菌体外周有一层电子密度低的“环带”将立克次体与宿主细胞胞质分隔开。感染5 d后,立克次体感染细胞增多,细胞内立克次体数量明显增加,立克次体感染细胞胞膜形成突触,相邻受感染的细胞胞膜凹陷将立克次体摄入胞质。处于分裂状态的立克次体长短不等,呈杆状、棒状,均以二分裂方式繁殖,还可见立克次体互相纵行连接成链状结构,链状结构可含有3个或4个形态相似的立克次体。电镜下观察到细胞胞核内存在立克次体,胞核内立克次体一般出现在感染5d后的细胞内(图 3)。
3 讨 论
斑点热立克次体的宿主细胞为内皮细胞,为了研究黑龙江立克次体与宿主内皮细胞的相互作用,我们分离、培养原代人脐静脉内皮细胞,传代培养3代的内皮细胞作为黑龙江立克次体感染宿主细胞。用黑龙江立克次体感染内皮细胞24 h后,去除细胞上清,添加新鲜无青、链霉素的内皮细胞培养液,观察黑龙江立克次体感染内皮细胞及其在内皮细胞的生长繁殖规律。结果显示黑龙江立克次体与内皮细胞共培养24 h内,在第6 h及第24 h各出现一个感染高峰,与在3~7 h和24 h各出现一个感染高峰的立氏立克次体感染人脐静脉内皮细胞的结果基本一致[19]。
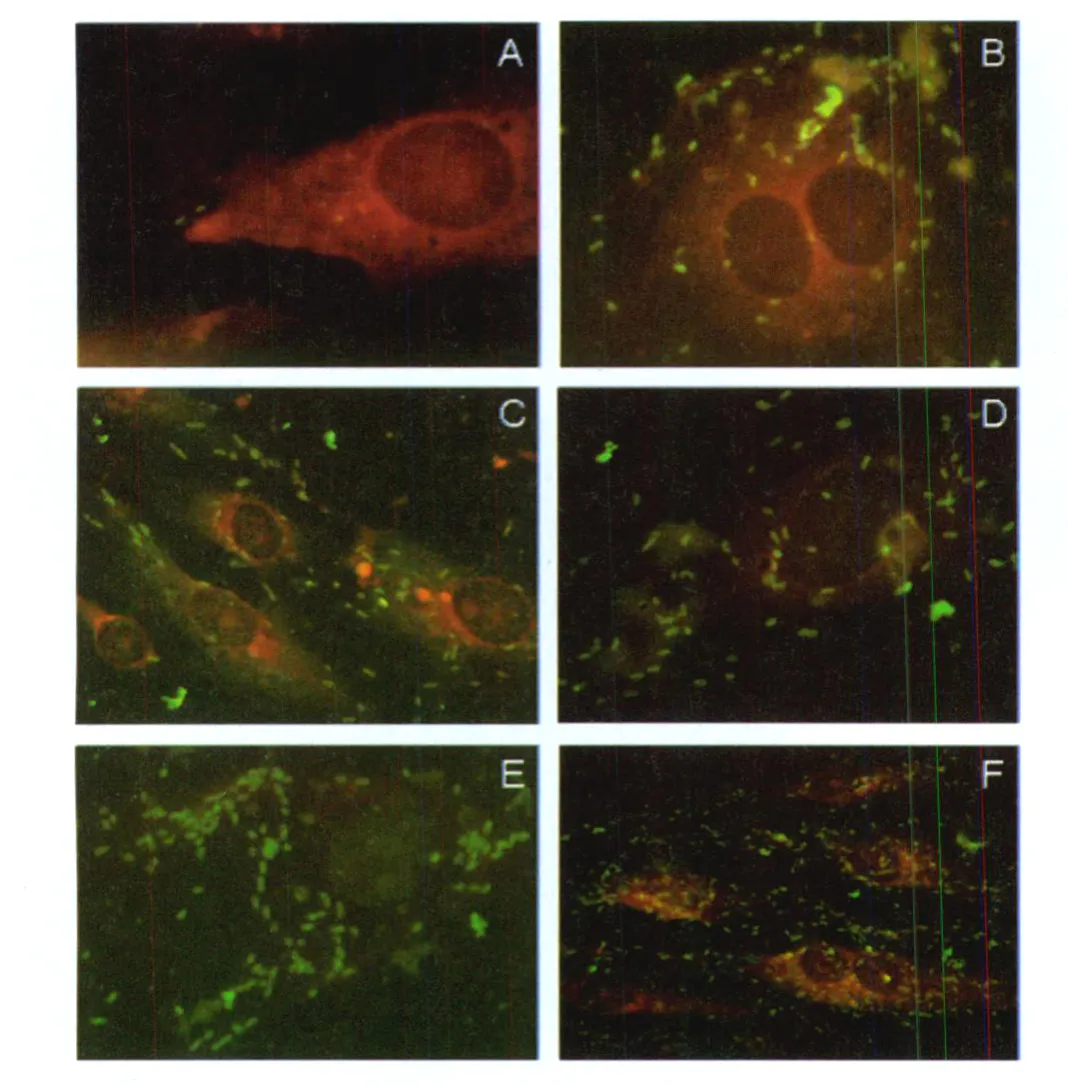
图2 IFA检测黑龙江立克次体感染内皮细胞A:感染后12 h,内皮细胞摄入立克次体;B:感染5d后,细胞内立克次体逐渐增多,但内皮细胞继续分裂增殖;C:立克次体呈棒状,处于即将分裂状态;D:少量立克次体进入内皮细胞胞核内;E:感染后9 d,立克次体互相纵行连接成链状结构,链状结构可含有3个或4个立克次体;F:感染后10 d,细胞由梭形变成瘦长形,含大量立克次体。Fig.2 R.heilong jiangensis infected HUVECs revealed by indirect immunofluorescence assay A:internalization of rickettsiae by the endothelial cell at 12h postinfection;B:cell proliferation with more rickettsiae;C:long rod-shape forms of rickettsiae thatwould divided;D:transmitted and entry into the nuclei of rickettsiae;E:rickettsiae formed a chain-shape by three o r four organism s in cytop lasm on day 9 postinfection;F:HUVECs became long and thin with high load of rickettsiae
黑龙江立克次体进入内皮细胞后,能够在内皮细胞生长繁殖,并且维持较长的增殖时间。为了解黑龙江立克次体在内皮细胞的生长规律,本研究用IFA及扫描电镜观察,分析黑龙江立克次体在内皮细胞内12 d的生长繁殖规律。从感染后第1 d到第4 d,黑龙江立克次体在内皮细胞内无显著增殖,IFA检测可见细胞内少量立克次体散在分布于细胞质。第5~9 d立克次体在内皮细胞以二分裂方式快速增殖,立克次体数量急剧增加,并且内皮细胞核
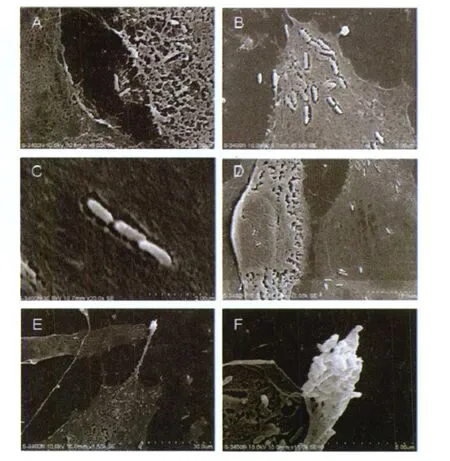
图3 扫描电镜观察黑龙江立克次体感染内皮细胞A:立克次体从感染细胞释放感染邻近细胞;(B,C):位于胞内的立克次体外周包裹低密度物质,正在分裂及分裂形成链状排列的立克次体;(D,E):3 000倍及1 500倍电镜下立克次体分布在胞质及胞核;F:内皮细胞胞质皱缩,立克次体密集成团。Fig.3 R.heilong jiangensis infected HUVEC observed under scanning electron m icrographs(SEM)A:rickettsiae sp read from the infected cells to normal cells;(B,C):intracellular rickettsiae coated with low electron density materials;(D,E):intracellular rickettsiae p roliferated and formed chains;rickettsiae existed in cytop lasm and nuclei at low power of SEM(E);F:an intensive cluster of rickettsiae was observed in cytoplasm at high power of SEM.
内出现立克次体侵入,立克次体在内皮细胞大量增殖,倒置显微镜下观察细胞状态无明显改变,IFA及扫描电镜观察发现黑龙江立克次体使细胞形成突触释放感染相邻细胞,即通过细胞间播散感染相邻细胞。第10 d检测,内皮细胞由梭形贴壁伸展生长逐渐呈瘦长形,胞质内充满立克次体,每个细胞内立克次体超过100个,细胞核内立克次体亦有增多。感染后第12 d,大部分内皮细胞变圆脱落,悬浮于细胞培养基,将脱落的内皮细胞离心甩片做 IFA检测,可见内皮细胞内有大量立克次体,并可见内皮细胞碎片及碎片中也带有立克次体,在细胞上清中也发现大量立克次体。这是由于立克次体在细胞内大量繁殖致使细胞裂解,立克次体释放到细胞上清中。
立克次体病是一类严重威胁人类健康的人兽共患自然疫源性疾病。斑点热群立克次体是以侵犯血管内皮细胞为主使人致病的细胞内寄生病原菌。斑点热群立克次体感染微血管内皮细胞,首先要接触、粘附内皮细胞,然后侵入内皮细胞,但其机制值得进一步研究。黑龙江立克次体是我国首次发现的斑点热群立克次体新种,我们也将采用新的技术和方法进一步研究黑龙江立克次体如何与内皮细胞相互作用,发现我国斑点热立克次体的致病相关毒力分子,在细胞和分子水平上进一步阐明黑龙江立克次体致病机理。
[1]Walker DH.Rickettsiae and Rickettsial Infections:The current state of know ledge[J].Clin Infect Dis,2007,45:39-44.
[2]Walker DH,Ismali N.Emerging and re-emerging rickettsioses:endothelial cell infection and early disease events[J].Nature,2008,6:375-386.
[3]俞树荣,陈香蕊.立克次体与立克次体病[M].北京:军事医学科学出版社,1999:33-59.
[4]张军,焦艳梅,陈梅玲,等.基于ompB基因序列的立克次体精河株的系统发育分析与鉴定[J].寄生虫与医学昆虫学报,2007,14:24-28.
[5]Foumier PE,Dum ler JS,Greub G,et al.Gene sequence-based criteria for identification of new rickettsia isolates and description of Rickettsa beilongiiangsis sp,nov[J].JClin Microbiol,2003,41:5456-5465.
[6]吴益民,魏安明,胡玲美,等.从患者血液分离的斑点热群立克次体HLJ-H5株的鉴定[J].中国人兽共患病学杂志,1998,14:23-26.
[7]Mediannikov OY,Sidelnikov Y,Ivanov L,et al.Acute tickebome rickettsiosis caused by Rickettsia heilongiangensis in Russian far east[J].Emerg Infect Dis,2004,10:810-817.
[8]Olanno JP.Rickettsial infections[J].ANN N Y Acad Sci,2005,1063:187-196.
[9]Valbuena G,Walker DH.The endothelium as a target for infections[J].Annu Rev Pathol,2006,1:171-198.
[10]Balraj P,Nappez C,Raoult D,et al.Western-blot detection of Rick A within spotted fever group rickettsiae using a specific monoclonal antibody[J].FEMS Microbiol Lett,2008,286(2):257-262.
[11]Martinez JJ,Seueau S,Veiga E,et al.Ku 70,a component of DNA-dependent protein kinase,is a mammalian receptor for rickettsia conorii[J].Cell,2005,123:1013-1023.
[12]Walker TS.Rickteesial interactions with human endothelial cell in vitro:adherence and entry[J].Infect Immun,1984,44:205-210.
[13]Ammerman NC,Beier-Sexton M,Azad AF.Laboratory Maintenance of Rickettsia rickettsii[J].Curr Protoc Microbiol,2008,3:Unit 3A.5.1-3A.5.21.
[14]Weinberg EH,Stakebake JR,Gerone PJ.Plaque assay for Rickettsia ricketisii[J].JBacteriol,1969,98:398-402.
[15]Wike DA,Tallent G,Peacock M G,et al.Studies of the rickettsial plaque assay technique[J].Infect Immun,1972,5:715-722.
[16]M cDade JE,Stakebake JR,Gerone PJ.Plaque assay system for several species of Rickettsia[J].J Bacteriol,1969,99:910-912.
[17]Jaffe EA,Nachman RL,Kecker CG,et al.Culture of human endothelial cell derived from unbilical veins[J].J Clin Invest,1973,52:2745-2756.
[18]李丽莉,温博海,张晶波,等.贝氏柯克斯体被单核细胞吞噬及其在单核细胞内生长的初步研究[J].中国人兽共患病杂志,2005,21:940-944.
[19]Sporn LA,Sahni SK,Lerner NB,et al.Rickettsia rickettsii infection of cultured human endothelial cells induces NF-kappaB activation[J].Infect Immun,1997,65:2786-2791.
Primary study on Rickettsia heilong jiangensis infection of vascular endothelial cells
M ENG Yan-fen,DUAN Chang-song,WANG Xi-le,XIONG Xiao-lu,WEN Bo-hai
(State Key Laboratory of Pathogens and Biosecurity,Institute of Microbiology and Epidem iology,Beijing 100071,China)
The Rickettsia heilongjiangensis organisms purified by Renografin renografin gradient centrifugation were app lied to infected human umbilical vein endothelial cells(HUVEC)grow n in monolayer on cover slips.Rickettsiae were examined by both indirect immune fluorescence assay(IFA)and scanning electron micrograph(SEM)after rickettsial infection.During the first 24 hours postinfection(ip),two infection peaks were found at 6 and 24 hours pi,respectively.Multip lication of rickettsiae and pathological changes of host cells wereob served at 5 days pi,while the amount of intracellular rickettsiae was markedly increased within 5 to 9 days pi.A few of rickettsiae were observed in the nucleus of host cells that appeared severe pathological changes within 8 to 9 dayspi.Due to the overw helming rickettsial infection,most of the infected host cells shed 12 days pi.Our results demonstrated that R.heilong jiangensis has a capability to infect vascular endo the lial cells to cause vascular injury of humans.
Rickettsia heilong jiangensis;vascular endothelial cells;pathological change
R376
A
1002-2694(2011)06-0470-05
*国家基础研究计划(973计划课题 2010CB530200/2010CB530205)和国家科技重大专项(重大传染病预防与控制课题2008ZX10004-002)联合资助
温博海,Email:bohaiwen@sohu.com
军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071
2011-03-02;
2011-03-22

