铜绿假单胞菌及其L型诱导血管内皮细胞凋亡的实验研究*
陈登宇,刘 勇,徐萍萍,夏佩莹
血管内皮细胞衬覆于血管内壁,是构成血管通透性屏障的主要结构,在机体血液循环和免疫防御方面发挥重要作用。本实验用铜绿假单胞菌(Pseudomonas aeruginosa,PA)及其L型刺激体外培养的血管内皮细胞,采用Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率,Giemsa染色观察细胞形态变化判断细胞受损情况,并比较PA和PA-L型致细胞病变作用的差异,以探讨铜绿假单胞菌感染引起的败血症和感染性休克时对血管内皮细胞损伤的机制。
1 材料与方法
1.1 菌株 铜绿假单胞菌标准菌株:CMCC10104株,购于中国药品生物制品检定所。采用平板纸片法,以哌拉西林药物纸片诱导铜绿假单胞菌成稳定L型[1],传代培养获得新鲜培养物,用无菌3%NaCl高渗盐水制成108CFU/ml菌液;常规细菌培养获得对数生长期的原菌,用无菌生理盐水制成108CFU/ml菌液,计数采用麦氏比浊法。
1.2 细胞系 人血管内皮细胞株 ECV-304,购于中科院上海细胞生物学研究所。
1.3 主要试剂 Annexin V FITC/PI双染细胞凋亡检测试剂盒,购于深圳晶美生物工程有限公司;Giemsa染色液母液,Sigma公司。
1.4 主要仪器 流式细胞仪 FACS Calibur:美国BD公司;光学显微镜:日本Nikon。
1.5 细胞培养 将低温冻存的 ECV-304细胞复苏,加入 RPMI-1640+10%FCS培养液,置 37℃、5%CO2孵箱中培养,收获指数生长期细胞,以105/mL浓度接种于24孔细胞培养板、每孔2mL细胞悬液,常规培养12h后弃去陈旧培养液,更换成不含小牛血清的新鲜RPMI-1640培养液进行试验。
1.6 实验分组及诱导 实验分组如下:A组:PA诱导组,在细胞培养板试验孔中每孔加用无菌生理盐水制成108CFU/mL铜绿假单胞菌菌液100μL;B组:PA-L型诱导组,在细胞培养板试验孔中每孔加用无菌高渗盐水(3%NaCl溶液)制成108CFU/mL铜绿假单胞菌L型菌液100μL;C组:生理盐水对照组,在实验空白对照孔中加100μL无菌生理盐水。各组于诱导因素加入后 2、4、6、8、10h分别收集细胞,0.25%胰蛋白酶消化为单个细胞悬液,进行Annexin V-FITC/PI双染后流式细胞仪检测细胞凋亡率。若做细胞爬片,在细胞培养板各孔预置清洁无菌小玻片,后进行实验,在各时间点将细胞爬片取出行 Giemsa染色。
1.7 细胞凋亡检测
1.7.1 流式细胞仪法 采用AnnexinV-FITC/PI双染法检测凋亡细胞,操作方法:用0.25%胰蛋白酶消化贴壁细胞成单个细胞悬液;用4℃预冷的PBS染色缓冲液洗涤细胞两次(1000r/min×5min);200μL结合缓冲液洗涤细胞 1次(1000r/min×5min),弃上清,管底留 20μL 结合缓冲液 ,混匀;加入 2μL Annexin V-FITC 和 5μL PI,稍加振荡,室温下避光孵育15min;1h内上机、流式细胞仪检测,Cellquest软件获取数据,WinMDI 2.9软件分析细胞凋亡率。
1.7.2 Giemsa染色 细胞爬片用4%多聚甲醛固定20min;在爬片上滴加新鲜配制 Giemsa染液应用液,染30min,冲洗干燥镜检。
1.8 统计学方法 采用q检验,SPSS10.0统计分析软件进行数据处理。
2 结 果
2.1 流式细胞术检测细胞凋亡结果 通过 FITC和PI荧光做双参数点图,可将实验样品细胞分为4区:Annexin V-FITC-/PI-(左下象限:LL区)代表正常活细胞;Annexin V-FITC+/PI-(右下象限:LR区)代表早期凋亡细胞;Annexin V-FITC+/PI+(右上象限:UR区)代表晚期凋亡和坏死细胞;Annexin V-FITC-/PI+(左上象限:UL区)代表机械性损伤细胞。流式细胞仪检测结果见图1~图6,统计结果显示:PA和PA-L型感染组与对照组相比,血管内皮细胞在各时间段的凋亡率均明显增高(P<0.05或P<0.01);PA感染组与PA-L型感染组相比,血管内皮细胞在6h和8h时间段的凋亡率均明显增高(P<0.01)(见图4)。随着诱导时间的延长,在前8h内各组细胞的凋亡率逐渐增加(P<0.05或P<0.01),铜绿假单胞菌细菌型诱导组在8h时间点出现细胞凋亡高峰(见图5)。实验中,细胞总体死亡(凋亡和坏死)的比例显著(P<0.05或P<0.01)(见图6),说明 PA及其L型引起血管内皮细胞既有凋亡,又有大量坏死。
2.2 Giemsa染色观察结果 在铜绿假单胞菌及其L型诱导组均观察到凋亡细胞,PA-L组比PA组数目少,有细胞皱缩、染色质浓缩、核断裂、细胞膜泡化和凋亡小体形成等细胞凋亡时具有的特征性形态学变化(见图7);对照组,具有凋亡细胞特征形态的细胞少见。
3 讨 论
血管内皮细胞衬覆于血管内壁,是构成血管通透性屏障的主要结构,参与体内许多生理和病理过程,发挥凝血及免疫防御作用[2-3]。铜绿假单胞菌感染引起的败血症和感染性休克与血管内皮细胞损伤有关,而细菌L型为细菌在体内抗菌物质作用下的常见存在形式,本实验研究 PA及L型对体外培养的血管内皮细胞的影响,探讨该菌对血管内皮细胞的损伤作用。
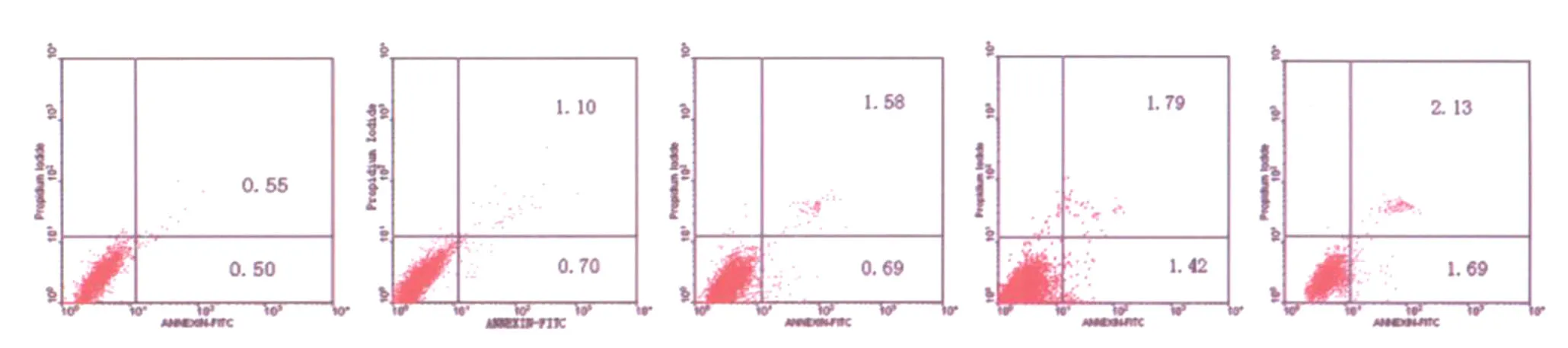
图1 对照组血管内皮细胞凋亡流式图Fig.1 Flowcytometric figures of vascular endothelial cells apoptosis in control groupFrom left to right,cells apoptosis ratios were 0.50%in 2h,0.70%in 4h,0.69%in 6h,1.42%in 8h,and 1.69%in 10h
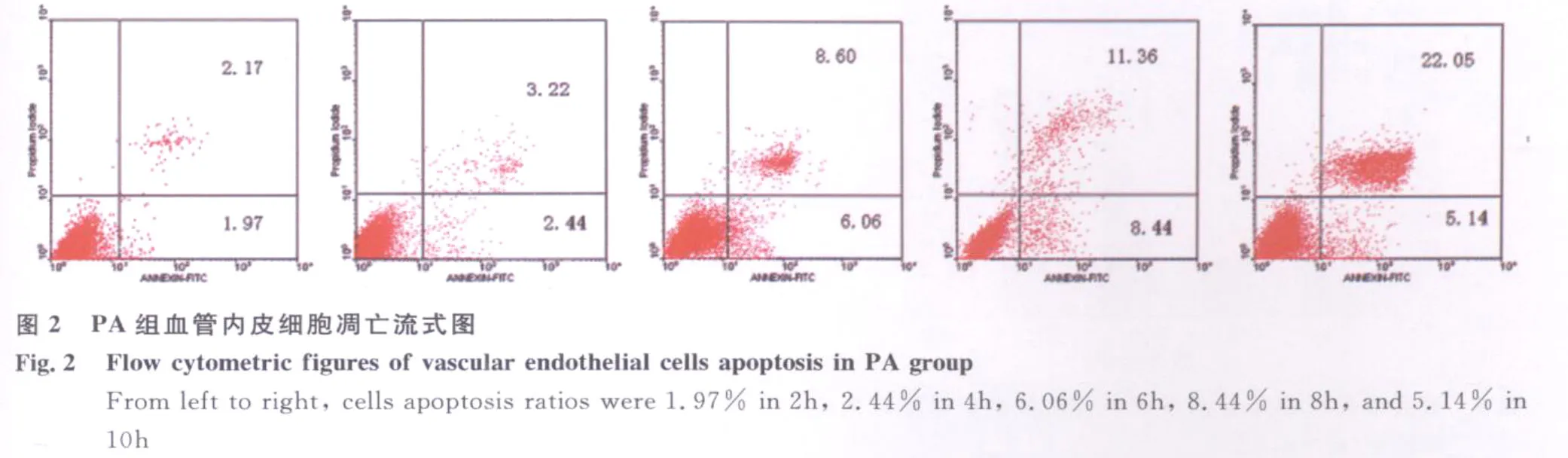
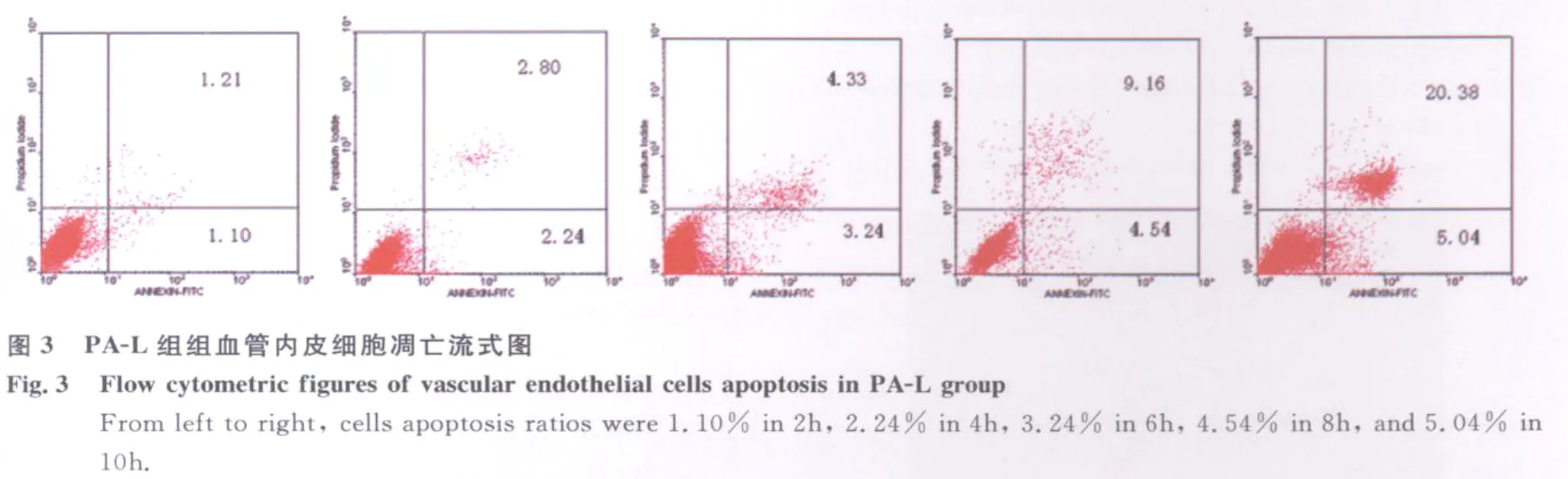
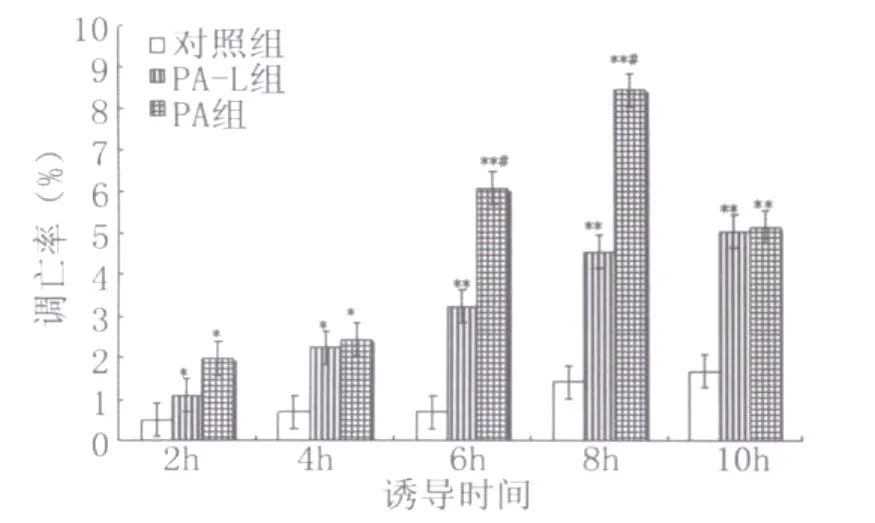
图4 流式细胞仪检测各组不同时间血管内皮细胞早期凋亡率比较(ni=4,±s)Fig.4 Apoptosis ratios of vascular endothelial cells in different groups were compared(ni=4,±s)q test:compared to control group*P<0.05**P<0.01compared to PA-L group#P<0.01
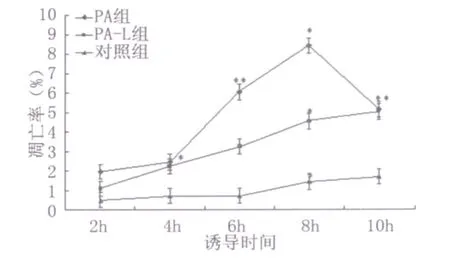
图5 流式细胞仪检测各组内不同时间段细胞凋亡的时相变化(ni=4,±s)Fig.5 Apoptosis ratios of vascular endothelial cells in different time were compared(ni=4,±s)q test:compared to previous time*P<0.05**P<0.01
实验中将PA及L型与血管内皮细胞共培养,采用Annexin V-FITC/PI双染、流式细胞仪检测细胞凋亡情况。Annexin V可与凋亡早期细胞的胞膜翻向外侧的磷脂酰丝氨酸结合,为检测细胞早期凋亡的灵敏指标之一;碘化丙啶(Propidium Iodide,PI)不能透过完整的细胞膜,能够透过细胞膜不完整的凋亡中晚期的细胞和坏死细胞细胞膜而使细胞核染红。将Annexin V和 PI两者结合使用,利用流式细胞仪检测可准确的检测出细胞膜完整的凋亡细胞的比例。实验中发现PA及L型可明显诱导血管内皮细胞凋亡,并且随着作用时间的延长,细胞凋亡率随之增加,说明PA及L型具备诱导血管内皮细胞凋亡的能力。PA引发血管内皮细胞凋亡可能与内毒素有关,细菌内毒素脂多糖是PA的一种重要致病物质,可激活血管内皮细胞产生大量的细胞因子和炎症介质,如 TNF-α和 NO等,诱导细胞凋亡[3-4]。PA的Ⅲ型分泌系统产生的外毒素和菌体表面的菌毛也可上调细胞表面 Fas的表达,导致细胞凋亡[5-6]。PA-L型较其原菌诱导血管内皮细胞凋亡能力明显减弱,原因可能为PA变异为L型后,细胞壁结构发生改变,菌毛、孔道蛋白等黏附结构减少降低细菌对宿主细胞的黏附能力,致病物质如内毒素、外毒素等较原菌大为减少,减弱了细菌对细胞的损伤作用。
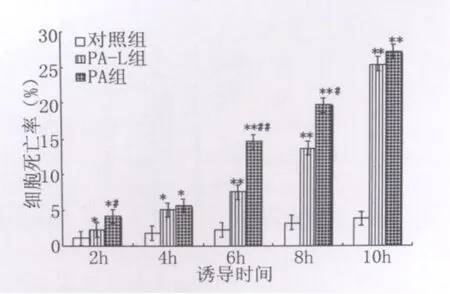
图6 流式细胞仪检测各组不同时间血管内皮细胞总死亡率比较(ni=4,x ±s)Fig.6 Total dead ratios of vascular endothelial cells in different groups were compared(ni=4,x ±s)q test:compared to control group*P<0.05**P<0.01compared to PA-L group#P<0.01##P<0.01

图7 PA组凋亡细胞 Giemsa染色 ×400细胞皱缩、核固缩Fig.7 Apoptosis cells in PA group Giemsa stain×400 cell shrinkage,nuclear condensation
铜绿假单胞菌感染时可释放毒素诱导血管内皮细胞凋亡,而血管内皮细胞异常凋亡增多会造成血管内皮细胞减少,损伤血管结构和影响血管功能,会导致循环系统功能紊乱和细菌扩散能力加强,造成PA及其L型感染难以控制,病情恶化,诱发DIC和感染性休克的发生。铜绿假单胞菌L型常与其原菌混合感染,不易清除常导致慢性感染的发生,PAL型可诱导血管内皮细胞凋亡可能是其致病机制之一。虽然单一的细胞体外培养模型不能完全反映体内血管损伤的复杂过程,但可从一个侧面在一定程度上反映铜绿假单胞菌及其L型对细胞的损伤作用,故体外研究该菌诱导血管内皮细胞凋亡,有助于阐明铜绿假单胞菌及其L型感染损伤血管内皮细胞引起引起循环功能紊乱导致败血症及感染性休克的致病机制,以期用于指导临床防治铜绿假单胞菌及其L型引起的严重感染。
[1]陈登宇,夏佩莹,孟庆荣.铜绿假单胞菌L型的诱导及其产绿脓菌素能力的研究[J].实用医药杂志,2008,25(1):77-79.
[2]杨颖乔,刘晓晴.血管内皮细胞与急性肺损伤[J].中国急救医学,2004,24(5):434-436.
[3]Bannerman DD,Goldblum SE.Mechanisms of bacrerial lipopolysaccharide-induced endothelial apoptosis[J].Physiol Lung Cell Mol Physiol,2003,284(6):899-914.
[4]Valente E,Assis MC,Alvim IM,et al.Pseudomonas aeruginosainduces apoptosis in human endothelial cells[J].Microb Pathog,2000,29(6):345-356.
[5]Assis MC,Freitas C,Saliba AM,et al.Up-regulation of Fas expression by Pseudomonas aeruginosa-infected endothelial cells depends on modulation of iNOS and enhanced production of NO induced by bacterial type III secreted proteins[J].Int J Mol Med,2006,18(2):355-363.
[6]Jendrossek V,Fillon S,Belka C,et al.Apoptotic response of chang cells to infection withPseudomonas aeruginosastrains PAK and PAO-I:molecular ordering of the apoptosis signaling cascade and role of type IV Pili[J].Infect Immun,2003,71(5):2665-2673.

