盐酸昂丹司琼氯化钠注射液处方工艺控制研究
李 洁,黄桂华,崔美兰,邵义红,王丽华
(1.山东大学药学院,山东济南250012;2.山东齐都药业有限公司,山东淄博255400)
盐酸昂丹司琼(ondansetron hydrochloride)作为一类抗肿瘤辅助用药,为高选择5-羟色胺受体阻断剂,临床上主要用于肿瘤放疗、化疗以及手术治疗所引起的呕吐[1],盐酸昂丹司琼已明确的主要微量杂质包括:1,2,3,4-四氢-9-甲基-4 H-咔唑酮(中间体I)、9-甲基-3-(二甲胺基)甲基-1,2,3,9-四氢-4 H-咔唑-4-酮盐酸盐(中间体Ⅱ)、1,2,3,9-四氢-9-甲基-3-亚甲咔唑酮(杂质Ⅲ)[2]。生产过程中发现该产品可见异物和灭菌后的有关物质受pH值影响较大,产品灭菌后有明显变化的杂质峰出现。直接接触药液的包装材质不同,贮存过程中会出现沉淀;临床使用过程中与pH值大于5.7的药液配伍会发生沉淀反应[4]。为此,我们对盐酸昂丹司琼氯化钠注射液生产工艺进行研究,考察最佳的pH值控制范围,直接接触药液的包装材料,灭菌参数,储存条件等,以减少生产和储存过程中药物的降解,提高产品质量,为该药物的质量控制参数提供依据。
1 仪器与试药
PHS-3C型pH计(上海精科雷磁仪器厂),BS110S电子天平(北京赛多利斯仪器系统有限公司),SPX智能生化培养箱(宁波江南仪器厂),ZWF-J6激光注射液微粒分析仪(天津市天河医疗仪器有限公司),YB-2澄明度检测仪(天津药典标准仪器厂),WD-B药物稳定性检查仪(天津药典标准仪器厂),600-717-2414型Waters高效液相色谱仪(美国Waters公司)。
盐酸昂丹司琼氧化钠注射液样品(山东齐都药业有限公司),活性炭(上海活性炭厂)。
2 方法与结果
2.1 处方 盐酸昂丹司琼(二水合物)8 g,氯化钠900 g,注射用水适量,溶解定容至100 L。
2.2 生产工艺
2.2.1 制备工艺 在配制罐中加入适量注射用水,加入氯化钠,加入适量1 mol·L-1稀盐酸调节pH值在3.5~5.5范围内,于搅拌下加入处方量的盐酸昂丹司琼,溶解后,加入已预先润湿的活性炭,搅拌吸附10 min后,检验pH值、含量,精滤、灌装。灌装好的产品于121℃水浴灭菌15 min,灯检,包装。
2.2.2 检测方法 照高效液相色谱法(《中国药典》2010年版二部附录V D)测定[3]。
盐酸昂丹司琼:色谱条件与系统适用性试验用氰基硅烷键合硅胶为填充剂,以0.02 mol·L-1磷酸二氢钠溶液(用氢氧化钠溶液调节pH至5.4)-乙腈(50∶50)为流动相,检测波长310 nm。理论塔板数按盐酸昂丹司琼峰计算,应不低于2 000。
测定法:精密量取本品适量,加流动相稀释制成每1 mL中约含昂丹司琼80 μg的溶液,精密量取10 μL注入液相色谱仪,记录色谱图;另取盐酸昂丹司琼对照品,精密称定,同法测定,按外标法以峰面积计算,即得。
有关物质检测方法:本品适量,加流动相制成每1 mL中约含80 μg的溶液,作为供试品溶液;精密量取1 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液。除检测波长为216 nm外,照含量测定项下的色谱条件,取对照溶液10 μL注入液相色谱仪,调节仪器检测灵敏度,使主成分色谱峰的峰高约为满量程的10%~15%,再精密量取供试品溶液与对照溶液各10 μL,分别注入色谱仪,记录色谱图至主成分峰保留时间的4倍。供试品溶液的色谱图中如有杂质峰,各杂质峰面积的和不得大于对照溶液主峰面积的0.5倍(0.5%)。
2.3 产品控制参数的筛选
2.3.1 调节剂选择及用量的确定 本品主要有效成分为盐酸昂丹司琼,因其助溶基团为盐酸基,制备注射液时加入稀盐酸来调节pH值,使制剂中不再引入其他成分,保持制剂的稳定性。
2.3.2 pH值控制范围的筛选 pH值筛选试验:盐酸昂丹司琼氯化钠注射液pH值范围为4.5~6.5(盐酸昂丹司琼氯化钠注射液质量标准YBH01592003),参照其pH值范围,按处方配制一定量的药液,分别用10%盐酸溶液和10%氢氧化钠溶液调节pH值至3.5、4.5、5.5、6.0、6.3左右后灌装50瓶(中性高硼硅玻璃瓶包装),每个pH值条件留样2瓶,剩余样品121℃,12 min灭菌。比较不同pH值条件下,样品灭菌前后性状、pH值、含量、有关物质等指标变化情况。根据试验结果选择最佳pH值控制范围。试验结果见表1。
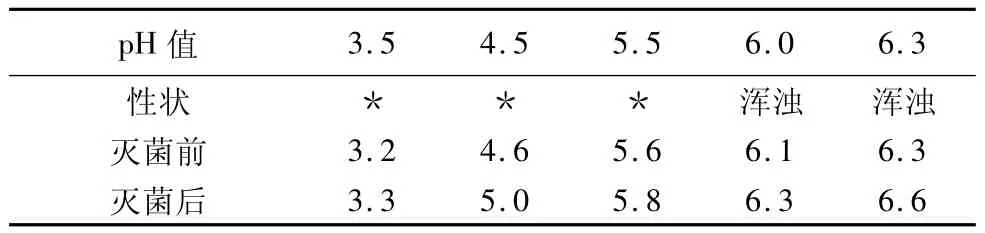
表1 pH值范围的筛选试验结果
分析:随着药液pH值的升高,特别是pH值大于5.8以后,样品变浑浊。取样检测,有关物质及含量。将浑浊的药液加入稀盐酸溶解至澄清状态,取样检测。检测结果见表2、3、4。

表2 不同pH值范围的有关物质检测结果(%)
分析结论:随着药液pH值的升高,在调节pH值5.5以上时,药液灭菌后有关物质检测色谱图上在保留时间4 min左右有明显的新杂质峰出现,该杂质峰随pH值的升高呈明显上升趋势,成品pH值5.8的样品其有关物质已超出限度。
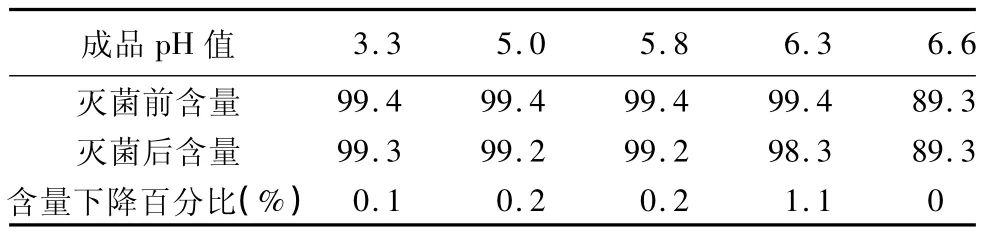
表3 不同pH值范围的盐酸昂丹司琼含量检测结果(%)
分析结论:随着pH值的升高,盐酸昂丹司琼溶解度呈明显下降趋势,含量偏低。
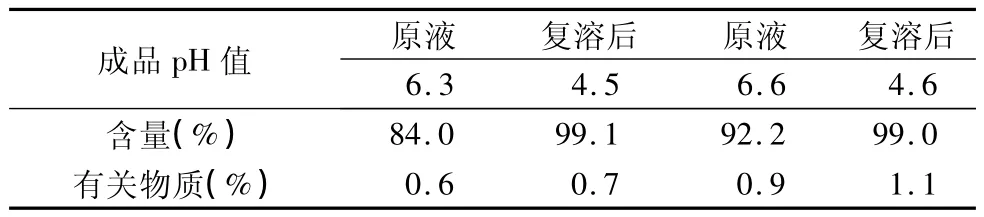
表4 复溶后的盐酸昂丹司琼注射液含量及有关物质检测结果
由试验结果可知:各个pH值条件的样品灭菌后与灭菌前相比pH值均有不同程度的升高,但有灭菌前半成品pH值越高,灭菌后pH值升高幅度越大的趋势。另由表2、表3统计结果可知:随着pH值的升高,样品中盐酸昂丹司琼含量呈下降趋势,灭菌后有关物质呈上升趋势。
表4结果显示,即随着pH值的升高,盐酸昂丹司琼的溶解度降低,原先已溶解的主药析出结晶,含量下降,有关物质增加。但复溶后原料重新溶解,含量与初始配制液吻合。但有关物质稍有增加。
2.3.3 直接接触药液包装材料的选择 分别采用普通钠钙玻璃瓶、高硼硅玻璃瓶、中性高硼硅玻璃瓶、非PVC包装,注射液pH值控制在5.0和5.5,40℃加速条件放置1个月后室温放置6个月,检测外观、pH值、含量、有关物质,检测结果如表5。
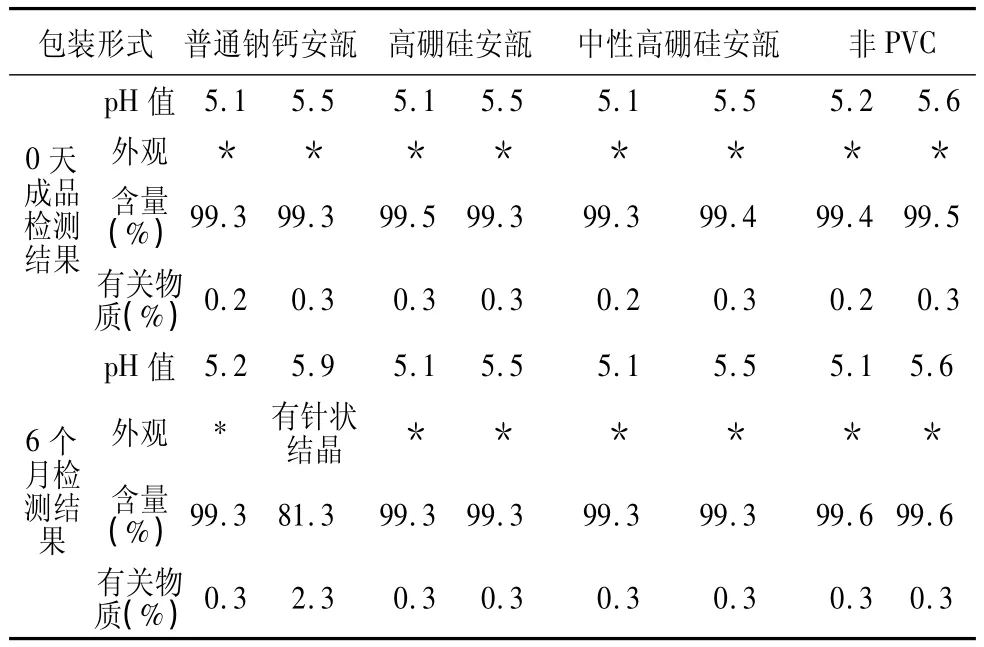
表5 稳定性考察的盐酸昂丹司琼注射液含量及有关物质检测结果
分析:普通钠钙玻璃瓶含有过多的玻璃碱或对水的抵抗力不强时,经热灭菌或长期储存后将显著增加注射液的pH值,导致昂丹司琼析出结晶。
2.3.4 灭菌参数选择 由盐酸昂丹司琼的化学性质及结构可知,本品对灭菌温度有一定的敏感性,主要体现在灭菌后产品有关物质增高,我们分别按制备工艺制备了3批样品,批号100901、100902、100903,三批产品各取50瓶,采用121℃、12 min条件灭菌,剩余样品115℃、30 min灭菌,灭菌结束后按本品含量测定和有关物质测定项下方法测定有关物质及主药含量,对比灭菌条件对产品造成的影响,结果如表6。

表6 不同灭菌条件对有关物质及盐酸昂丹司琼含量的影响
分析结论:121℃、12 min灭菌条件较115℃、30 min灭菌条件剧烈,产品有关物质增高,但检测结果均合格。为增加无菌保证值,因此首选灭菌参数是121℃、12 min,F0≥12的过热灭菌条件。
2.3.5 影响因素试验 影响因素试验在较为激烈的条件下进行的。其目的探讨药物的固有稳定性,了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析提供科学依据。
取样品(批号:100901),于低温(4℃)和高温(60℃)及光照,照度为(4500±500)lx条件下考察10 d,于第5、10天取样,考察其性状、可见异物、pH值、含量、有关物质是否有明显变化,试验结果见表7。

表7 影响因素试验结果
由试验结果可知,本品在光照(4500±500)lx、低温4℃和高温60℃条件下放置10 d后,光照条件下有关物质略有升高,其性状、可见异物、含量均无明显变化,故本品应避光密闭条件下保存。
2.3.6 低温冻融试验 由于本品在水中溶解度较低(略溶),故储存过程中易析出片状结晶。我们进行低温冻融试验,考察试制样品的稳定性。取样品(批号:100901)分别于-15℃条件下放置2 d,然后于40℃条件下融化并放置2 d,而后检查样品性状、可见异物、pH值,如此反复循环共3次。试验结果见表8。

表8 冻融循环试验结果
由试验结果可知:冻融试验前后,监测的各项指标均无明显变化,但低温析出结晶,建议常温保存。
3 讨论与结论
3.1 讨论
3.1.1 通过pH值调节剂及范围的选择实验结果可以看出,pH值大小对盐酸昂丹司琼溶解度影响较大,当pH值较高时,盐酸基与氢氧化钠发生反应,昂丹司琼游离,溶解度减小,易析出结晶。
3.1.2 直接接触药品的包装材料材质对产品影响极大,当玻璃瓶内壁保护膜退落后,玻璃中含有过多的玻璃碱,在贮存过程中可增加注射液的pH值,导致昂丹司琼析出结晶。
3.1.3 低温冻融试验结果表明,低温易析出结晶,需2次加热溶解,增加了产品质量风险,因此注射剂要避免低温放置。
3.1.4 通过稳定性及影响因素的考察结果表明,该产品室温放置过程各质量指标无明显变化,产品质量稳定。
3.2 结论 通过pH值调节剂及范围的选择、包装材料的选择、灭菌工艺的选择、影响因素、低温冻融等试验结果表明,生产过程中发现该产品可见异物和灭菌后的有关物质受pH值影响较大,不同的pH值控制条件,产品灭菌后有明显变化的杂质峰出现。贮存过程中会出现沉淀。为此,采用盐酸调节pH值;半成品pH值控制在3.5~5.5之间;采用中、高硼硅玻璃瓶和非PVC包装,过热灭菌的制备工艺能够得到稳定优质的产品。产品避光保存,更利于保证质量。
[1] Wilde MI,Markham A.Onlansetron.A review of its pharmacology and preliminary clinical findings in novel applications[J].Drugs,1996,52(5):773-794.
[2] 冯茹,费绍芳,杨蓓蓓,等,HPLC/DAD/MS法测定盐酸昂丹司琼及其3种微量杂质[J].药物分析杂志,2010,30(3):499-503.
[3] 国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010:731-732.
[4] 冯国旗.中西药注射剂配伍变化[M].北京:军事医学科学出版社,2005:3.
[5] 张春红,张晓颖,张秀华.常见药物及液体配伍问题[J].护理研究,2006,20(6):1563-1564.
- 药学研究的其它文章
- 单硝酸异山梨酯口崩片的制备及质量评价

