大肠杆菌色氨酸转运系统多基因敲除对色氨酸生产的影响
赵志军,陈晟,吴丹,吴敬,陈坚
1 江南大学 食品科学与技术国家重点实验室,无锡 214122
2 江南大学生物工程学院 工业生物技术教育部重点实验室,无锡 214122
L-色氨酸作为人体内的一种必需氨基酸,广泛应用于医药、食品和饲料等行业[1]。工业上一般采用微生物发酵法生产色氨酸,其生产菌株的筛选主要是通过诱变或者基因工程的手段,去除色氨酸合成代谢中的各种反馈调控作用[2]。然而由于微生物合成色氨酸的代谢调控机制非常复杂,通过现有手段很难完全去除,此时其残余的调控作用往往会阻碍色氨酸的进一步合成[3]。此类现象在其他氨基酸的菌种选育中也广泛存在[4]。
针对以上情况,转运系统工程为氨基酸生产菌株的选育提供了一种新的育种思路。转运系统工程通过提高胞内氨基酸的分泌速率或者降低胞外氨基酸的吸收速率,使细胞内氨基酸浓度一直保持在较低水平,从而使氨基酸的反馈调控作用减弱或不起作用,最终达到高效生产某种氨基酸的目的[5]。近年来,关于赖氨酸、苏氨酸和半胱氨酸等氨基酸转运系统的研究表明,转运系统工程可能会成为氨基酸生产菌株选育过程中规避残余调控作用,高效积累目的氨基酸的一种重要的方法[6-9]。
大肠杆菌的色氨酸转运系统分为分泌系统和吸收系统,其中关于色氨酸分泌系统的相关基因仍未得到完全鉴定[10-11],而色氨酸的吸收系统则相对受到了更多的关注[12-14]。大肠杆菌中主要由mtr、tnaB和aroP 3个基因编码的通透酶参与调控色氨酸的吸收。其中AroP通透酶是芳香族氨基酸共用通透酶,还负责细胞对苯丙氨酸和酪氨酸的吸收;Mtr通透酶是高亲和性的色氨酸专用通透酶;TnaB通透酶是低亲和性的色氨酸专用通透酶[13]。本实验室前期的研究发现色氨酸转运系统mtr、tnaB和aroP 3个基因的单基因敲除均有利于大肠杆菌合成更多的色氨酸,其中mtr单基因的敲除对菌株生产色氨酸的促进作用最大,与对照菌相比色氨酸产量提高了约40% (数据另文发表)。本研究在mtr单基因敲除菌的基础上,运用 Red重组技术分别构建了 mtr.tnaB和mtr.aroP双基因敲除菌和mtr.tnaB.aroP三基因敲除菌,并通过发酵实验着重考察了色氨酸转运系统多基因敲除对大肠杆菌菌体生长及色氨酸生产的影响。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
出发菌株为色氨酸生产菌株大肠杆菌FB-T1/pSV03,其宿主菌FB-T1是大肠杆菌FB-02[15]的 mtr单基因敲除的衍生菌株,基因型为 W3110 (∆trpR、∆tnaA和∆mtr)。质粒pSV03是带有抗反馈调控作用的大肠杆菌色氨酸合成途径关键酶基因aroF和trpED的低拷贝,且具有PR和PL双启动子的原核表达质粒[15]。菌株FB-T1/pSV03由实验室前期通过基因工程手段构建。本研究以 FB-T1/pSV03为出发菌株,分别构建了mtr.tnaB和mtr.aroP双基因敲除菌以及mtr.tnaB.aroP三基因敲除菌。敲除所需的工具质粒pKD13、pKD46和pCP20购自美国耶鲁大学大肠杆菌菌株库 (E. coli Genetic Stock Center,New Haven,USA)[16]。本研究中使用的菌株和质粒的具体特性见表1。
1.1.2 试剂和溶液
各种限制性内切酶、Taq DNA聚合酶、PrimeSTAR HS DNA聚合酶和T4 DNA连接酶购自宝生物工程 (大连) 有限公司;细菌质粒DNA抽提试剂盒、细菌基因组DNA抽提试剂盒、DNA凝胶回收试剂盒以及试剂氨苄青霉素 (Amp)、卡那霉素(Kan) 和 L-阿拉伯糖购自生工生物工程 (上海) 有限公司。
1.1.3 培养基和培养条件
种子培养基为LB培养基:10 g/L蛋白胨,10 g/L NaCl,5 g/L酵母膏。摇瓶发酵培养基的成分包括:3 g/L MgSO4·7H2O,0.015 g/L CaCl2·H2O,3 g/L KH2PO4,1 g/L NaCl,5 g/L (NH4)2SO4,0.07 g/L FeSO4·7H2O,0.1 g/L Na-Citrate,0.2 g/L酵母膏,20 g/L葡萄糖和 1.5 mL/L微量元素液 (2 g/L Al2(SO4)3·18H2O, 0.75 g/L CoSO4·7H2O,2.5 g/L CuSO4·5H2O,0.5 g/L H3BO3,2.4 g/L MnSO4·H2O,3 g/L Na2MoO4·2H2O,2.5 g/L NiSO4·6H2O,15 g/L ZnSO4·7H2O)。当在3 L发酵罐中进行分批发酵时,发酵培养基中的初始葡萄糖浓度降低至8 g/L,其余成分同摇瓶发酵培养基。
摇瓶发酵时,菌株在50 mL LB培养基中37 ℃培养8~10 h,按10% (V/V) 比例转接至100 mL摇瓶发酵培养基中37 ℃振荡培养,每隔4 h添加适量的浓氨水调节培养基pH值至pH 7.0~7.2。发酵罐发酵时,菌株在50 mL LB培养基中37 ℃培养8~10 h,按10% (V/V) 比例转接至1.2 L发酵罐培养基中发酵。发酵初始温度为33 ℃,当菌体生长至对数生长期前期时,升温至38 ℃培养,诱导产色氨酸。当发酵液中初始葡萄糖基本耗尽时,开始流加500 g/L的葡萄糖溶液,并调控流速使发酵液中的葡萄糖浓度小于5 g/L。发酵过程中,通过流加浓氨水使培养基pH保持在6.8。
1.1.4 引物
根据大肠杆菌W3110的基因组序列,设计引物gene_p1和gene_p2,其中下划线部分为目标基因上下游各50 bp的同源臂序列,以pKD13 DNA为模板,扩增 1 403 bp的目标基因打靶 DNA片段geneD50-Kan-geneD50。三对引物 gene_v1和 k1,k2和gene_v2,gene_v1和gene_v2分别用于鉴定目标基因的敲除,其中引物gene_v1和gene_v2分别是大肠杆菌W3110基因组中目标基因上游和下游的某段DNA序列,引物k1和k2分别为质粒pKD13中Kan基因内部序列[16]。本研究所用引物的DNA序列见表 2,引物的合成及相应的测序工作由生工生物工程 (上海) 有限公司完成。
1.2 方法
1.2.1 大肠杆菌基因的敲除
大肠杆菌基因的敲除参照文献[16]。
1.2.2 胞外发酵代谢物的测定
发酵液中色氨酸浓度的测定参照文献[15]。发酵液中的葡萄糖浓度由 SBA-40C生物传感分析仪测定 (山东省科学院生物研究所)。发酵液中的菌体密度以在600 nm波长下分光光度计检测的吸光值OD600表示,细胞干重根据前期构建的经验公式获得 (1 OD=0.492 g/L CDW)。

表1 菌株和质粒Table 1 Strains and plasmids

表2 本研究使用的引物Table 2 Primers used in this study
2 结果
2.1 mtr.tnaB双基因敲除菌的构建
由于色氨酸合成关键酶的表达质粒pSV03和敲除用工具质粒pKD13都是Kan抗性标记,为避免质粒pSV03在基因敲除过程中产生不利影响,本研究首先在出发菌株FB-T1/pSV03的宿主菌FB-T1的基础上进行色氨酸转运系统多基因敲除菌的构建,进而通过质粒 pSV03转化实验获得出发菌株FB-T1/pSV03的多基因敲除菌。以质粒pKD13 DNA为模板,利用引物tnaB_p1和tnaB_p2扩增得到的打靶PCR片段tnaBD50-Kan-tnaBD50,转化至大肠杆菌 FB-T1/pKD46的感受态细胞中,同源重组后在Kan平板上初步筛选tnaB基因的敲除突变株。分别利用两对引物tnaB_v1和k1,k2和tnaB_v2对tnaB敲除菌进行菌落PCR鉴定。根据序列分析,出发菌株不会获得任何PCR片段,而 tnaB敲除菌经扩增后应分别获得784 bp和991 bp的PCR片段。DNA凝胶电泳的结果与理论值相符,表明tnaB基因敲除成功 (图1,泳道1~2)。将质粒pCP20转化至tnaB基因敲除菌中,消除其Kan抗性基因,并利用引物tnaB_v1和tnaB_v2进行菌落PCR鉴定。根据序列分析,Kan基因消除后,PCR扩增应获得643 bp的DNA片段。DNA凝胶电泳的结果与理论值相符 (图1,泳道3)。将PCR片段连接至pMD18-T载体后送测序,测序结果验证 tnaB基因敲除正确。命名mtr.tnaB敲除菌为FB-T2。
2.2 mtr. aroP双基因和mtr. tnaB. aroP三基因敲除菌的构建
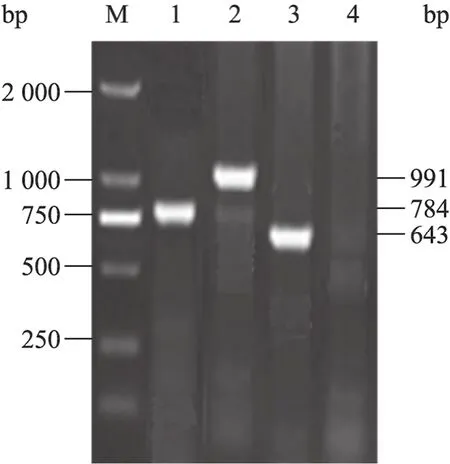
图1 tnaB基因敲除菌的PCR鉴定Fig. 1 Identification of the tnaB knockout strain by PCR. M: DL 2 000 marker; 1: tnaB_v1→k1; 2: k2→tnaB_v2; 3: tnaB_v1→tnaB_v2.

图2 aroP基因敲除菌的PCR鉴定Fig. 2 Identification of the aroP knockout strains by PCR. M: DL 2 000 marker; 1, 5: aroP_v1→k1; 2, 6: k2→aroP_v2; 3, 7: aroP_v1→aroP _v2.
在mtr单基因和mtr.tnaB双基因敲除的基础上,通过引物aroP_p1和aroP_p2扩增得到PCR片段aroPD50-Kan-aroPD50,用于菌株FB-T1和FB-T2基因组上aroP基因的敲除。利用两对鉴定引物aroP_v1和k1,k2和aroP_v2分别进行两种aroP基因敲除菌的PCR鉴定。DNA凝胶电泳的结果显示两种aroP基因敲除菌经PCR扩增后获得的DNA片段大小均与理论值742 bp和961 bp相符 (图2,泳道1~2为mtr.aroP 双基因敲除菌的鉴定;泳道 5~6为mtr.tnaB.aroP三基因敲除菌的鉴定)。Kan基因消除后,利用引物aroP_v1和aroP_v2再次对两种aroP基因敲除菌进行 PCR鉴定,电泳结果均与理论值571 bp相符 (图2,泳道3为mtr.aroP双基因敲除菌的鉴定;泳道7为mtr.tnaB.aroP三基因敲除菌的鉴定)。经测序证明两种 aroP基因敲除均正确,从而分别获得 mtr.aroP 双基因敲除菌 FB-T3和mtr.tnaB.aroP三基因敲除菌FB-T4。
2.3 色氨酸基因工程菌的构建
将含有色氨酸合成关键酶基因的质粒 pSV03分别转化至大肠杆菌色氨酸转运系统多基因敲除菌 FB-T2、FB-T3和 FB-T4中,构建色氨酸基因工程菌 FB-T2/pSV03、FB-T3/pSV03和 FB-T4/ pSV03。
2.4 色氨酸基因工程菌的摇瓶发酵
为了初步考察大肠杆菌色氨酸转运系统多基因敲除对菌株生产色氨酸的影响,本研究对出发菌株FB-T1/pSV03及构建的色氨酸工程菌FB-T2/pSV03、FB-T3/pSV03和 FB-T4/pSV03进行了摇瓶发酵实验。由于菌体在利用发酵培养基中的葡萄糖之后,培养液中pH值将下降至pH 6以下,进而严重抑制菌体的生长及色氨酸合成,因此本实验每隔4 h,利用浓氨水调节培养液中 pH值至 pH 7.0~7.2。如图3A所示,与对照菌株相比,mtr.tnaB或者 mtr.aroP双基因敲除对菌体的生长影响较小;但当3个色氨酸转运基因mtr、tnaB和aroP均被敲除时,菌体的生长受到了明显抑制。在色氨酸生产方面,mtr.tnaB双基因敲除菌 FB-T2/pSV03的色氨酸产量为1.38 g/L,与对照菌株FB-T1/pSV03 (1.17 g/L) 相比提高了17%;mtr.aroP双基因敲除菌FB-T3/pSV03的色氨酸产量为1.27 g/L,与对照菌株FB-T1/pSV03相比提高了 9%;而 mtr.tnaB.aroP三基因敲除菌FB-T4/pSV03生长缓慢,发酵过程中仅积累了0.63 g/L的色氨酸 (图3B)。
2.5 色氨酸基因工程菌的补料分批发酵
由摇瓶发酵试验得知,在构建的色氨酸转运系统工程菌中,mtr.tnaB的双基因敲除菌FB-T2/pSV03的产色氨酸能力最高,为了进一步考察其发酵生产色氨酸的潜力,本研究在3 L发酵罐中对出发菌株FB-T1/pSV03及 mtr.tnaB双基因敲除菌 FB-T2/ pSV03进行了补料分批发酵实验。如图4所示,虽然在发酵罐中菌株FB-T2/pSV03的菌体生长滞后于对照菌FB-T1/pSV03,但在发酵过程中2个菌株最高可积累的生物量相近,分别为39.4 g/L和41.8 g/L (表3)。在色氨酸生产方面,菌株FB-T2/pSV03的发酵液中最高可以积累12.2 g/L色氨酸,与出发菌株FB-T1/pSV03 (9.6 g/L) 相比提高了 27%;菌株FB-T2/pSV03的葡萄糖转化率为 9%,与对照菌FB-T1/pSV03 (6%) 相比提高 50% (表 3)。研究结果表明色氨酸转运系统 mtr.tnaB双基因敲除对菌体发酵生产色氨酸最为有利。
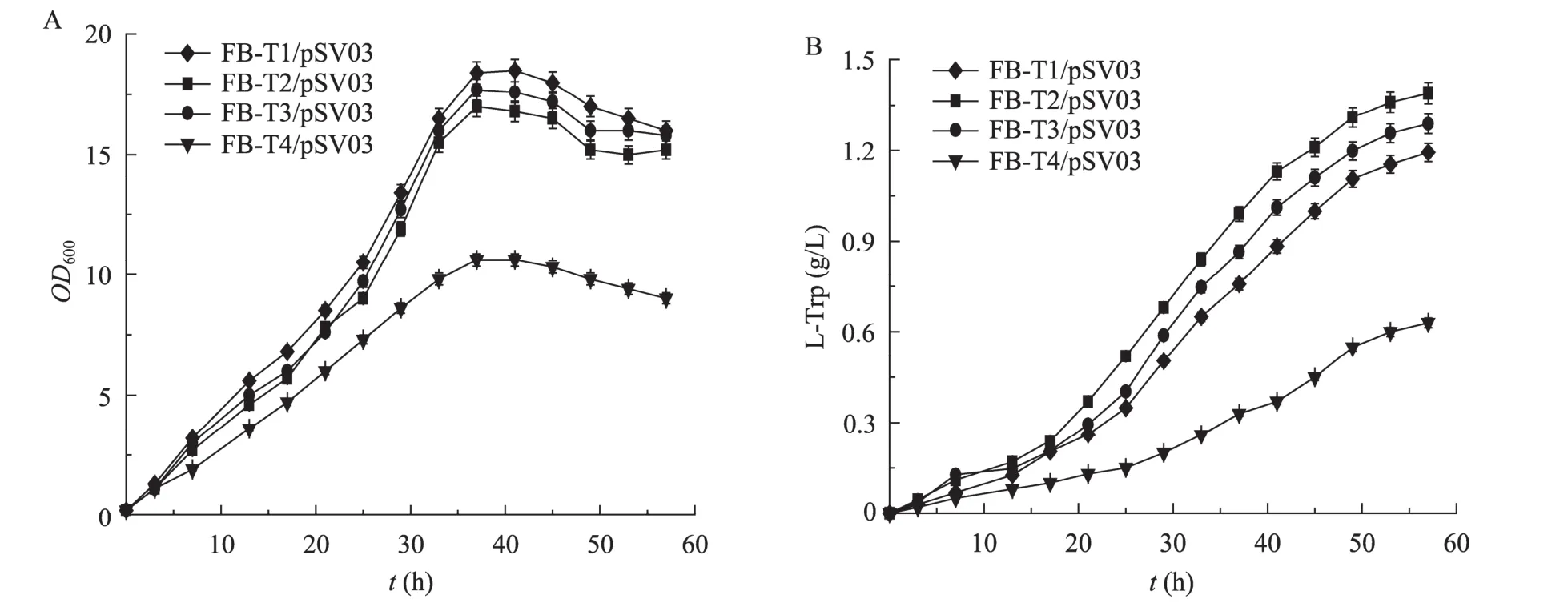
图3 大肠杆菌FB-T1/pSV03色氨酸转运系统多基因敲除菌的摇瓶发酵Fig. 3 Shake-flask fermentations of multi-gene knockout mutants of L-Trp transport system of E. coli FB-T1/pSV03. The data represent the ±s from three measurements.

图4 菌株FB-T1/pSV03和FB-T2/pSV03的分批发酵Fig. 4 Fed-batch fermentations of E. coli FB-T1/pSV03 and FB-T2/pSV03. The data represent the ±s from three measurements.

表3 大肠杆菌FB-T1/pSV03和FB-T2/pSV03分批补料发酵的参数比较Table 3 Comparison of fermentation parameters of E. coli FB-T1/pSV03 and FB-T2/pSV03
3 讨论
在氨基酸合成途径本身得到广泛研究之后,转运系统的改进被认为是今后氨基酸育种研究中的重要内容。但由于仍有许多氨基酸转运系统的基因尚未得到鉴定,因此目前仅有少数文献考察了转运系统工程对相应氨基酸生物合成的影响[5]。就色氨酸而言,相关研究主要集中在谷氨酸棒杆菌上[12,14]。在谷氨酸棒杆菌中,色氨酸向胞内的转运仅受到AroP通透酶的调控。Ikeda等以谷氨酸棒杆菌KY9225为出发菌株,通过诱变获得了色氨酸吸收活性降低的 3株突变菌,其色氨酸产量与对照菌相比分别提高了 10%~20%,因此推测色氨酸吸收系统的受损有利于菌体的色氨酸合成[12]。但其不足之处是 Ikeda等[12]在色氨酸吸收系统突变菌的构建过程中多次采用了诱变的手段。由于诱变过程中往往会发生各种次级突变,无法确认这些次级突变是否也影响了菌体的色氨酸合成,进而也不能准确确定色氨酸吸收系统受损对色氨酸产量提高的贡献量。在大肠杆菌方面,本实验室在前期的研究中发现色氨酸转运系统的单基因敲除均对菌体生产色氨酸有促进作用,其中 mtr单基因敲除的作用最大 (数据未显示),但关于大肠杆菌转运系统多基因缺失对菌株发酵生产色氨酸的影响仍未见报道。因此,本研究在mtr单基因敲除菌的基础上,分别构建了mtr.tnaB和mtr.aroP双基因敲除菌以及mtr.tnaB.aroP三基因敲除菌,着重考察了色氨酸转运系统多基因敲除对菌株生产色氨酸的影响。结果表明,mtr.tnaB和mtr.aroP双基因敲除均对菌体的生长影响较小,且mtr.tnaB和 mtr.aroP双基因敲除菌的色氨酸产量与对照菌相比分别提高了17%和9%。在进一步的分批补料发酵实验中 mtr.tnaB双基因敲除菌最高可积累12.2 g/L的色氨酸,与对照菌相比提高了27%;此外,在获得的相近菌体生物量的情况下,发酵过程中 mtr.tnaB双基因敲除菌消耗了较少的葡糖糖,因此其葡萄糖转化率达到 9%,与对照菌相比提高了50% (表3)。此外,由于本研究涉及的出发菌株及基因敲除菌均是通过基因工程手段构建而成,具有确定的基因组信息 (表 1),因此有助于准确反映色氨酸转运系统受损对菌体生产色氨酸的影响,从而为色氨酸菌种的进一步改良提供依据。
值得注意的是,目前氨基酸转运系统工程的研究仍然存在一些问题。例如,前期的研究发现过量表达某种氨基酸吸收基因会导致相应氨基酸的产量急剧下降[8,14],但当通过各种手段致使氨基酸吸收系统受损时,相应氨基酸的产量并没有得到数倍的增长[12]。此外,在氨基酸分泌系统的研究中,尽管存在氨基酸分泌基因的过量表达促进相应氨基酸生产的实例[17-18],但研究中也发现个别氨基酸分泌基因的缺失对相应氨基酸的产量基本没有影响[5,19]。这些问题一方面需要通过对氨基酸转运机制的探索来寻找原因,但另一个不可忽视的方面是,受制于许多氨基酸转运基因尤其是分泌基因尚未得到鉴定,目前大多数的相关研究都单独对氨基酸吸收系统或者分泌系统进行考察,而氨基酸转运系统作为一个有机整体,是其吸收系统和分泌系统的共同作用决定了微生物细胞内的氨基酸浓度,并最终影响了相应氨基酸的生物合成。因此,随着越来越多的氨基酸转运基因尤其是氨基酸分泌基因被鉴定和研究[10],氨基酸吸收系统和分泌系统必将作为一个整体同时进行考察和研究,从而使色氨酸以及其他氨基酸的转运系统工程在氨基酸生产菌株的理性改造过程中发挥更加重要的作用。
REFERENCES
[1] Leuchtenberger W, Huthmacher K, Drauz K. Biotechnological production of amino acids and derivatives: current status and prospects. Appl Microbiol Biotechnol, 2005, 69(1): 1−8.
[2] Ikeda M. Towards bacterial strains overproducing L-tryptophan and other aromatics by metabolic engineering. Appl Microbiol Biotechnol, 2006, 69(6): 615−626.
[3] Azuma S, Tsunekawa H, Okabe M, et al. Hyper-production of L-tryptophan via fermentation with crystallization. Appl Microbiol Biotechnol, 1993, 39(4/5): 471−476.
[4] Ikeda M. Amino acid production processes. Adv Biochem Eng Biotechnol, 2003, 79: 1−35.
[5] Burkovski A, Kramer R. Bacterial amino acid transport proteins: occurrence, functions, and significance for biotechnological applications. Appl Microbiol Biotechnol, 2002, 58(3): 265−274.
[6] Lee KH, Park JH, Kim TY, et al. Systems metabolic engineering of Escherichia coli for L-threonine production. Mol Syst Biol, 2007, 3: 149.
[7] Daβler T, Maier T, Winterhalter C, et al. Identification of a major facilitator protein from Escherichia coli involved in efflux of metabolites of the cysteine pathway. Mol Microbiol, 2000, 36(5): 1101−1112.
[8] Okamoto K, Kino K, Ikeda M. Hyperproduction of L-threonine by an Escherichia coli mutant with impaired L-threonine uptake. Biosci Biotechnol Biochem, 1997, 61(11): 1877−1882.
[9] Vrljic M, Sahm H, Eggeling L. A new type of transporter with a new type of cellular function: L-lysine export from Corynebacterium glutamicum. Mol Microbiol, 1996, 22(5): 815−826.
[10] van Dyk TK. Bacterial efflux transport in biotechnology. Adv Appl Microbiol, 2008, 63: 231−247.
[11] Doroshenko V, Airich L, Vitushkina M, et al. YddG from Escherichia coli promotes export of aromatic amino acids. FEMS Microbiol Lett, 2007, 275(2): 312−318.
[12] Ikeda M, Katsumata R. Tryptophan production by transport mutants of Corynebacterium glutamicum. Biosci Biotechnol Biochem, 1995, 59(8): 1600−1602.
[13] Yanofsky C, Horn V, Gollnick P. Physiological studies of tryptophan transport and tryptophanase operon induction in Escherichia coli. J Bacteriol, 1991, 173(19): 6009−6017.
[14] Ikeda M, Katsumata R. Transport of aromatic amino acids and its influence on overproduction of the amino acids in Corynebacterium glutamicum. J Ferment Bioeng, 1994, 78(6): 420−425.
[15] Zhao ZJ, Zou C, Zhu YX, et al. Development of L-tryptophan production strains by defined genetic modification in Escherichia coli. J Ind Microbiol Biotechnol, 2011, 38: 1921−1929.
[16] Baba T, Ara T, Hasegawa M, et al. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: the Keio collection. Mol Syst Biol, 2006, 2(1): 1−11.
[17] Pfefferle W, Möckel B, Bathe B, et al. Biotechnological manufacture of lysine. Adv Biochem Eng Biotechnol, 2003, 79: 59−112.
[18] Simic P, Willuhn J, Sahm H, et al. Identification of glyA (encoding serine hydroxymethyltransferase) and its use together with the exporter ThrE to increase L-threonine accumulation by Corynebacterium glutamicum. Appl Environ Microbiol, 2002, 68(7): 3321−3327.
[19] Marin K, Krämer R. Amino acid transport systems in biotechnologically relevant bacteria. Microbiol Monographs, 2007, 5: 289−325.

