女运动员三联征
刘晓丽,王人卫,赵 璨,洪润肖,李 合
能量摄入短缺和大强度运动易引起闭经,进而导致雌激素降低和饮食失调、压力性骨折、骨质疏松及增加心血管系统疾病提前发生等临床症状[67]。特别是对闭经运动员骨密度(Bone Mineral Density,BMD)的研究显示,其BMD值与绝经期女性相似,故增加了骨折风险,经研究发现,闭经是压力性骨折的高发生率原因之一[29]。
女运动员三联征是指相互影响的饮食失调、闭经和骨质疏松三因素形成的综合症[43]。三联征发生的可能原因是当能量摄入不能满足运动耗能要求,引起体内能量再分配,此时机体牺牲耗能较高的生殖系统,从而支持运动的能耗[60]。由于女性参加竞技体育的人数增多,女性三联征的症状引起越来越多的关注。但迄今为止的研究仅限于对运动员群体三联征的检查,未能扩大到业余体育爱好者的评价范围[26]。仅有对闭经预防与治疗的临床建议是增加运动员的能量摄入和降低训练强度,但是由于运动本身在运动性闭经中并不是一个具有因果关系的原因,故降低训练强度的原理也是一个很保守的途径[4]。因此,本研究就三联征三因素的含义、相互联系和存在的问题进行阐述,为正确理解三联征提供参考。
1 女运动员三联征的内涵和研究现状
1.1 三联征的定义
1997年,美国运动医学学会提出:女运动员三联征指能相互影响的饮食失调、闭经和骨质疏松三因素形成的综合症[13]。这三者相互联系:饮食失调引起月经周期紊乱,也会引起骨质疏松,另外,闭经对骨质疏松也会产生不良后果,三者间形成一定关系(图1)。值得注意的是,出现任一因素都是严重性的持续,若按对饮食失调、闭经和骨质疏松的定义那样严格区分会低估从检测和治疗其中一个或几个因素获得益处的人数,特别是亚临床症状者。此外,对“异常”的检查必须有标准化的定义,但是,关于三联征的各组成部分的标准定义的理解仍有待于提高。三联征中用骨量丢失较骨质疏松表述更为恰当[9]。迄今仍没有一个可以接受的定义或标准来诊断“亚临床饮食失调”[36],而且,对于月经失调如黄体功能不全(Luteal Phase Defects,LPD)的多变性也缺乏判断标准[6]。
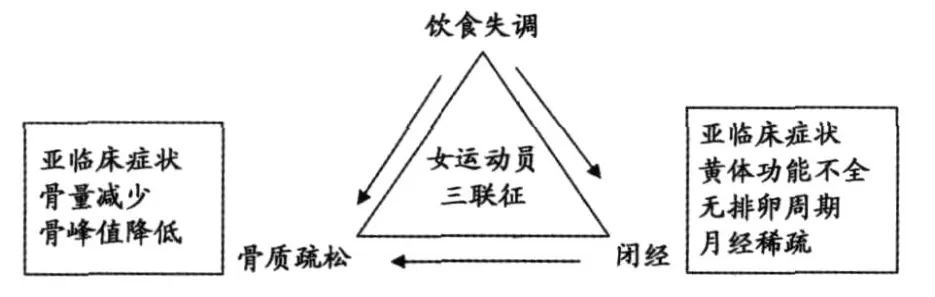
图1 三联征三要素的相互关系示意图
1.2 三联征检测的困难
从1997年三联征的研究开始,大量的研究逐渐浮出水面,检测地点也不再仅限于医院。但如果需要排除其他原因引起闭经的因素则需要检测激素。其他的方法如唾液和尿液实时检测也能筛选、检测月经紊乱和能量缺乏状况[52]。与此类似,BMD的检测能够使用便携式测量仪器,但其精确性和准确性有待于提高。传统的BMD测试采用双能X线吸收法,由于价格较昂贵,故仅作为研究使用的很少。饮食失调的自我检查一般采用直接问卷方法的调查量表,如饮食失调清单或饮食态度量表,这些都显示可能导致低估或不真实现象,因此,有研究开始使用间接提问方法的调查问卷和访谈[38]。
除测试仪器外,人为因素也会对三联征的检测造成一定困难。运动员的负责人是教练员,想要接近运动员的研究者常必须在研究实施前就要说服教练员让其到运动队对运动员进行科学研究。另外,运动医学服务者缺乏三联征体征的知识和由于许多运动队、高校在运动方案实施中缺乏运动医学专业人士,故通过运动医学服务者提供三联征的识别是有困难的[40]。从运动员方面来说,很多因素致使其或否认或缺乏对三联征的识别。首先,运动员由于缺乏三联征体征及其相互关联的知识,常出现控制体重的致病行为;另外,如果一个较低的体重能够提高运动能力,则引起三联征的各种行为常被忽视[42]。
1.3 三联征三因素都出现的研究现状
迄今为止,仅5项研究按同时出现三因素作为判定标准,这几项研究分别是以运动员、军人和大鼠为研究对象。而其他大部分研究主要评价三联征两因素的组合,如月经紊乱和骨骼健康或者是月经失调和饮食失调。
Cobb等的研究评价了竞技跑步运动员三联征的所有组成部分,发现运动员不管是饮食失调或者是月经稀疏或者闭经都存在低BMD[11]。按照WHO的标准,6%的月经稀疏或者闭经运动员患有骨质疏松,另外48%的出现骨量减少。Cobb等同样证明,那些即使月经周期正常但出现饮食失调者也会出现低BMD分数。实际上,26%的BMD T评分显示出现骨量减少现象。
Lauder等调查年龄范围是17~53岁423名现役女军人三联征的患病率,结果发现,423名军人中,33.6%被确认为有患三联征的风险,其中,26%检测时有饮食失调者被转入临床检测,从而确立饮食失调症的诊断。他们发现,仅有6人的腰椎BMD测试满足WHO骨质减少的标准[30]。值得注意的是,Lauder等研究中,有100名受试对象(423中的24%)有月经失调,但仅有0.4%的军人有运动史。该研究中,大部分受试对象来自于军医部门(29%),且没有提供运动资料,故推测受试对象每天运动量是有难度的。该研究同样与前面 Cobb的研究相反, Cobb研究的最初筛选标准是≥40里/周。另外,该研究中饮食失调的最初筛选标准仅是自我检测,而且,受试对象包括很多非裔美国人和其他少数民族(43%)。有研究发现,这些人群对于体型关注较少,而且该研究中非裔美国人本身就有较高的BMD[15]。
Torstveit等采用流行病学调查发现,挪威女运动员与其年龄一致的对照组三联征的患病率没有统计学差异[41,59]。然而,该研究却出现高估对照组的患病率和低估运动员的患病率。如对饮食失调的调查中,他们仅调查能量摄入的减少,却没有考虑到营养摄入正常而运动导致消耗增多的情况;对月经周期紊乱的调查仅采用问卷形式,且只考虑到周期长短的变化,并没有考虑到无排卵周期和LPD的情况。最后,经有关学者进行分层统计发现,与去脂体重相关的运动项目运动员和对照组相比,这些项目运动员三联征的患病率为非运动员的100倍[45]。
Dimarco等对大鼠进行12周的限食加自由转轮跑训练,结果发现,限食组雌激素和瘦素水平均下降,卵巢重量降低,双股骨和胫骨骨密度降低均较对照组有统计学差异,从而成功建立三联征的动物模型[39]。这是在世界范围内第一次成功建立类似女运动员三联征的动物模型。由于方法学和其他因素的限制不可能在人类实施该试验研究,但该模型为女运动员三联征的研究提供了非常好的平台,故该研究得到极高的评价。Loucks写了一篇题为“新的动物模型为女运动员三联征的研究提供新的机会”的文章,文中提到,该模型能够研究三联征的生理学特性和神经内分泌机制和形态学方面的变化,解决了不能在人类试验的困扰,也解决了短期时间内不能看到三联征最终结果的局限[31]。
2 饮食失调
饮食失调(diso rdered eating)常指饮食摄入与机体能量消耗不平衡引起的能量短缺,该因素是产生三联征的基石。但是,许多研究常将其与饮食失调症(eating disordered)相混淆,饮食失调症是指影响患者身心健康的轻型精神病,包括神经性厌食症及神经性暴食症两种症状。虽然,该病在运动员中时有发生,但是,在非竞技人群中的发病率更高[33]。对于运动员来说,她们出现的饮食失调和对体重的控制仅仅是通往饮食失调症的一种途径,而且,一般不会出现饮食失调症的精神病病理学因素,因此,在调查和研究中需要注意。
在三联征的研究中,很多学者采用自我报告和问卷方式调查运动员的饮食摄入状况,常用量表有DSM-IV(Diagnostic and Manual of Mental Disorders-IV)、EAT-26[14]、DEBQ(The Dutch Eating Behavior Questionnaire)[8]、TFEQ (The Three-Factor Eating Questionnaire)[16]等,这些都从能量摄入和饮食行为、态度等方面研究受试者的能量摄入情况,适合大样本调查,但应用的时候必须要小心与饮食失调症相区别。值得注意的是,运动员很多时候能量摄入与普通人没有区别,甚至高于普通人群,但是,运动员能量消耗可能要比普通人群高好几倍,导致能量摄入不能满足机体运动消耗而引起能量负平衡[68]。故有学者提出,用可利用能量代替能量摄入变化。可利用能量是能量摄入减去能量消耗后的差值,它综合考虑到能量摄入和能量消耗的情况[19],对运动员群体来说更加适用。可利用能量的检测需要直接测量运动员每天的能量摄入和运动所消耗的能量,结果较准确,但工作量大,仅适用于小样本量研究。
运动员为什么不通过增加能量摄入满足要求呢?英国的研究人员已经提出:“没有很强的生物学命令来匹配能量摄入满足能量的消耗”,食物缺乏会导致饥饿,但是,由运动能量消耗产生的能量缺乏却不会引起这种效果[47]。而且,大强度运动后,运动员采用由高碳水化合物饮食比高脂肪饮食更容易造成无意的能量缺乏[49],其确切机制尚有待进一步研究。总之,对于运动员来说,食欲并不是能量需求值得信赖的信号。因此,运动员必须学会按训练情况饮食,而不是按食欲饮食。
3 运动性月经失调
运动性月经失调(Exercise-Associated Menstrual Disturbances,EAMD)包括运动性闭经(Athletic Amenorrhoea,AA)、月经初潮延迟、月经稀疏、无排卵周期和LPD等,按严重程度划分为闭经>月经稀疏>无排卵周期>LPD[54]。由于对运动和饮食摄入的自我调节,女运动员和运动女性也会出现月经周期紊乱并伴有生殖紊乱的持续发生,从微小的变化如LPD和无排卵周期到闭经。EAMD的程度不同,其临床症状、内分泌描述和患病率也有一定的差异。
3.1 EAMD的定义、临床症状和患病率
3.1.1 运动性闭经
运动性闭经患者会缺乏雌二醇(E2),并随着严重程度减小,E2缺乏的状况也减少。闭经也会出现严重的临床症状。运动性闭经是下丘脑型的,并伴随着循环系统中促性腺激素和卵巢激素的低下和慢性抑制[53]。文献中关于闭经的定义很多,比较保守的定义是至少3个月没有出现月经。关于运动性闭经患病率从1%~66%都有报道[1],远远超过久坐女性(2%~5%)。研究发现,强调低体重的运动项目如花样溜冰、芭蕾、长距离跑和体操等女运动员闭经的患病率最高。除这些项目外,研究发现,月经周期失调在许多其他运动项目中都存在。
3.1.2 月经初潮延迟
初潮延迟或原发性闭经指到16岁仍未出现月经周期者。报道发现,许多项目运动员都会出现这种状况,特别是芭蕾舞演员和体操运动员最多。青春期女运动员初潮延迟的原因常仅被归于规律性运动训练,并未考虑其他推迟青春期成熟的因素[61]。Malina认为,在能量充足的青春期女性,月经初潮年龄依赖于遗传因素,但是,月经初潮同样也受社会或自然环境变化的影响,包括参加体育运动的自我选择,如体操和芭蕾,而这些特殊选择常和性成熟推迟有关[35]。
3.1.3 月经稀疏
月经稀疏指不规律月经周期持续时间的长度从36~90天不等,由于其周期的不一致性,很难进行研究[17]。除经常报道运动员异常周期的长度外,月经稀疏的患病率没有其他确切的数据。而且,在许多研究中,月经稀疏常和闭经归为一类[12]。由于每天的激素检测不可行和费用高,调查者常采用的区分标准是1年少于或仅有4个月经周期则被划分为月经稀疏。月经稀疏运动员卵巢方面的表现是当优势卵泡竞争性完成支配功能时,E2处于不稳定、不可预测和难于推测的低浓度。月经稀疏周期可能是排卵性或无排卵性的,因为,其限定性因素子宫内膜的脱落仅对 E2升高有反应,而与是否排卵无关[11]。文献中描述月经稀疏特点的研究较少。有研究者以月经周期正常但通过有氧运动和减少摄食引起月经稀疏的女性为受试对象,收集了几个周期尿代谢物,结果发现,在月经稀疏周期中,E2浓度较低[39]。
3.1.4 无排卵
无排卵是指促黄体生成素(LH)和促卵泡激素(FSH)分泌低下导致 E2水平降低和黄体素缺乏而引起的无排卵。无排卵周期长度是不一致的,故无排卵周期常和月经稀疏联系在一起[18]。虽然,无排卵周期的特点是在整个周期中E2和孕酮(P)的水平降低,但关于确定无排卵的特殊标准的争议在临床讨论中仍在继续。有研究发现,业余运动员水平的女性(每周跑不超过12~15里)虽有正常的月经周期,但是,无排卵周期的患病率是16%[34]。Mcconnell等对许多项目的一级运动员进行研究发现,虽然,运动员都自认为有正常月经周期,但经检测发现,32%是无排卵周期[37]。通过检测同一时段无排卵周期运动员和AA连续30天卵巢激素 E2的代谢产物发现,无排卵周期运动员的E2较闭经患者高。
3.1.5 LPD
许多研究发现,无论是参加大强度训练的运动员还是业余运动爱好者常出现LPD。由于,卵泡移植需要足够的LH,故LPD女性卵巢系统能够满足排卵,却无力支持卵泡移植。LPD特点是在黄体期P水平降低,由于P减少导致子宫内膜的稳定性降低[55]。LPD也可能在正常的月经周期发生,故P的降低可能是浓度的降低也可能是持续时间的降低。正常月经周期排卵时间在月经周期中期,一般是第12~14天,患有运动性LPD的女性也会出现排卵,但其排卵时间可能在第20天或20天以后。黄体期≤10天时P可能不足,也可能在正常范围。从临床角度来说, LPD伴随P不足导致随后周期卵泡不同步生长,卵母细胞成熟不够和子宫内膜分化功能异常,这些因素将导致无排卵和自发性流产。除黄体期长度和 P浓度的变化外,有LPD的运动女性也可能出现卵泡期延长,卵泡期第2~12天和黄体期每天尿 E2代谢物降低[22]。
LPD在久坐女性的患病率是有争议的,可能有2%~5%的患病率,3%~20%的是无排卵,但LPD在运动员中的患病率要远远高于久坐女性。有学者进行了为期3个月的调查发现,运动员LPD的发病率为48%、无排卵周期为79%,且运动女性不正常月经周期中(LPD和无排卵)一致的为33%,不一致的为46%。也就是说,出现间歇性的排卵、无排卵、LPD周期[56]。与此相反,在研究中连续观察几个月经周期发现久坐女性每个周期都有一致的长度。
3.1.6 EAMD间的转换
在EAMD的研究中,一项长期困扰的问题是月经周期紊乱是否伴随着可利用能量的持续性减少,从而导致个体月经周期的周期类型出现变化。在EAMD模型中,发现存在月经周期从正常排卵周期到LPD、无排卵和月经周期推迟的转变。William等对灵长类动物进行研究发现,在月经周期经历排卵周期向闭经过渡的阶段,不管是LPD还是无排卵周期出现都是毫无征兆的。在该实验中,保持猴的饮食处于恒定状态,但是,每天的运动量却不断增加到12.3 km/d,经过14.3个月的训练,闭经形成而体重变化没有统计学意义。在正常月经周期转化至闭经的过程中, P和LH的降低有统计学差异,这与观察到LPD和无排卵周期一致,却与运动训练女性的结果不一致,8只猴都有排卵且出现LPD,黄体期的长度有5只没有变化[62],但与运动员类似的是,在经历月经周期正常到闭经变化中卵泡期延长。
这些数据和Bullen、William对女运动员运动训练的研究一致。William的研究发现,久坐女性经过2个月的运动训练会出现LPD、无排卵和月经推迟。Bullen等将久坐女性分为维持体重组和体重降低组,通过突然增加每日跑的距离对她们进行为期2个月经周期的运动训练,到2个周期结束时每天跑距逐渐增至10里,结果发现,在运动过程中LPD的发生率增加,紊乱程度第2个周期较第1个周期严重[10]。在另外2个月的运动训练研究中,女性的体重维持稳定,William等在卵泡期或黄体期限制运动量,但是不管是限制哪个期的运动量都出现LPD的高发生率。该研究中,通过运动训练致使LPD出现的总的发病率为42%,这和Bullen等的研究发现LPD的发生率为38%类似。由此得出结论,突然增加久坐女性运动量会导致LPD。但是,由于William和Bullen研究的运动时间都没有超过2个月经周期,故运动女性是否会随着运动训练时间的延长而逐渐发展成闭经仍不清楚。综上所述,EAMD的形成可能经历症状较轻的紊乱,继而缓慢形成闭经。而对猴的研究发现,从一个不正常的周期到闭经的过渡是突然发生的。
3.2 EAMD的检测
3.2.1 检测方法
通过调查问卷和自我检查能够收集大量资料,可以了解运动员群体月经周期状况、长度和规律性。其他的评价月经周期状况的技术包括血液、尿液和唾液的激素检测。许多文献指出,回忆和自我报告有固有的难度和不准确。在评价周期规律与否中,依靠对月经周期长度的记忆,会出现显著失真现象。对大样本各年龄阶段女性的月经周期的分布和长度研究发现所谓的“典型的”和“规律性”差异较大,对于是否规律性并没有可接受的客观标准。最常见的月经周期长度为26~30天、24~32天和24~35天。对运动女性月经周期的研究中,最常见的是26~32天被认为是正常月经周期长度,且它作为正常的范围被许多非运动员群体健康女性的流行病学调查所采用,和文献报道的对女运动员的研究保持一致。如果自我报告周期长度数据的缺点能够被识别,则其能被有效利用,调查所得不规律的周期肯定是在被接受的范围之外[51]。
作为月经周期状态和生殖功能的反映,周期长度不像生殖激素内分泌实际的检测的内容丰富。即使是无排卵和LPD都会出现在短(<21天)或长的周期(>35天),而且,这些不正常还会出现在周期长度在所谓的正常范围内。
3.2.2 闭经和月经稀疏
对运动员原发性和继发性闭经的临床诊断需要内科医生的全面评价。一旦排除怀孕,其他与月经周期异常有关的内分泌疾病就需要继续检查,如 PRL(Prolactin)-分泌的垂体瘤、甲状腺疾病、多卵巢综合症和卵巢早衰,检查包括骨盆检查、体格检查、适当的实验室分析。从研究角度出发,为评价E2状况有必要检测全部生殖激素的浓度,这需要患者每天提供尿样,并测量 E2和 P代谢产物的浓度及LH。月经稀疏的运动员需要采用同样的方法检测。
3.2.3 LPD和无排卵
黄体期长度的持续时间是指从排卵到出现月经之间的那段时间,而排卵是LH出现峰值的时间,测量LH峰值的方法确定排卵比测量基础体温的方法准确。LPD的标准和文献报道的无排卵的周期是不一致的,LPD黄体期长度持续时间是9~11天。在LPD期也会出现低 P峰值和FSH降低,故有学者将黄体期<10天定义为LPD[23]。但需要注意的是LPD并不一定会有临床文献出现的无排卵,因此,不能将无排卵作为诊断LPD的敏感指标。
以科研为目的的研究中,单独使用或与黄体期长度结合,推荐至少检测一个周期每天 P浓度为确定LPD的金标准[50],但有人认为,最好是检测几个周期的 P浓度。其他的学者也注意到月经周期的变化较大,故推荐至少检测连续3个周期,从而对月经周期情况做一个精确判断。因为每天的取血样造成过度侵入性,每天测血指标限制较大。另外,因为P的分泌是节律性的分泌方式,研究发现,在LPD黄体中期的血样P的浓度范围在5~15 ng/ml间。较测血P浓度损害较小的策略是测尿样或唾液中 P的代谢产物。LPD的标准是多变的,但是 Kesner等和 Santoro等检测了尿 PdG(Preganediol 3-Glucuronide)的标准,在黄体期中PdG的标准浓度为5μg/mgCr,或者是4天的浓度>3 μg/mgCr被认为是黄体功能正常[25,50]。事实上,月经周期状况的研究者需要一致性地应用该标准。
检测排卵最精确的方法是使用超声波观察卵泡的生长和破裂,如果没有这个条件,则需要测量月经周期中期LH的浓度和黄体期性激素水平。因为超声波需要特殊的仪器、专家和价格昂贵,在一个完整周期中每天取血是不允许的,故许多研究者都采用尿LH、E2和P的代谢产物。如果检测E1G(Estrone Glucuronide)和 PdG优于LH,这可以减少采用LH峰值评估排卵时间的必需的样本量。如果研究者认为检测LH花费较多,可选择通过主观估算评定排卵时间,通过大样本检验普通女性有典型的激素变化模式的月经周期尿中E2和P代谢产物得出排卵时间的计算公式,经检验发现,采用该公式推算法是有效的,同样适用于运动员[5]。该方法能够减少通过视觉观察实验固有的偏倚和使数据得到一致性的处理。
3.3 运动员EAMD的病因学
机体出现慢性能量短缺时就会出现能量再分配,能量将从耗能较高的生殖系统移到细胞、运动和其他维持生命的代谢过程。有学者对运动的女性进行了具有说服力的短期试验,他们同时控制受试者的能量摄入和能量消耗,结果发现可利用能量和 GnRH脉冲发生器调整间高度相关[3]。另外,对低可利用能量和EAMD的关系研究发现在能量摄入和估计的能量消耗间存在400~700 k的能量差值,对24 h血液与代谢相关的激素的测试发现,长时间能量短缺导致能量出现适应性的再分配[7]。对AA月经周期轻微紊乱的研究发现,当月经周期紊乱时出现能量短缺的代谢信号,这为能量代谢状况与EAMD相关提供了有力证据。这种低能量代谢状况包括基础代谢率降低,T3、瘦素(leptin)、胰岛素、血糖、胰岛素样生长因子结合蛋白3 (IGFBP-3)降低[24],胰岛素样生长因子结合蛋白 1(IGFBP-1)、胃饥饿素(ghrelin)、生长激素和皮质醇(C)升高。表1表示运动员中月经周期正常者(EA),LPD和AA能量代谢和性激素的变化。
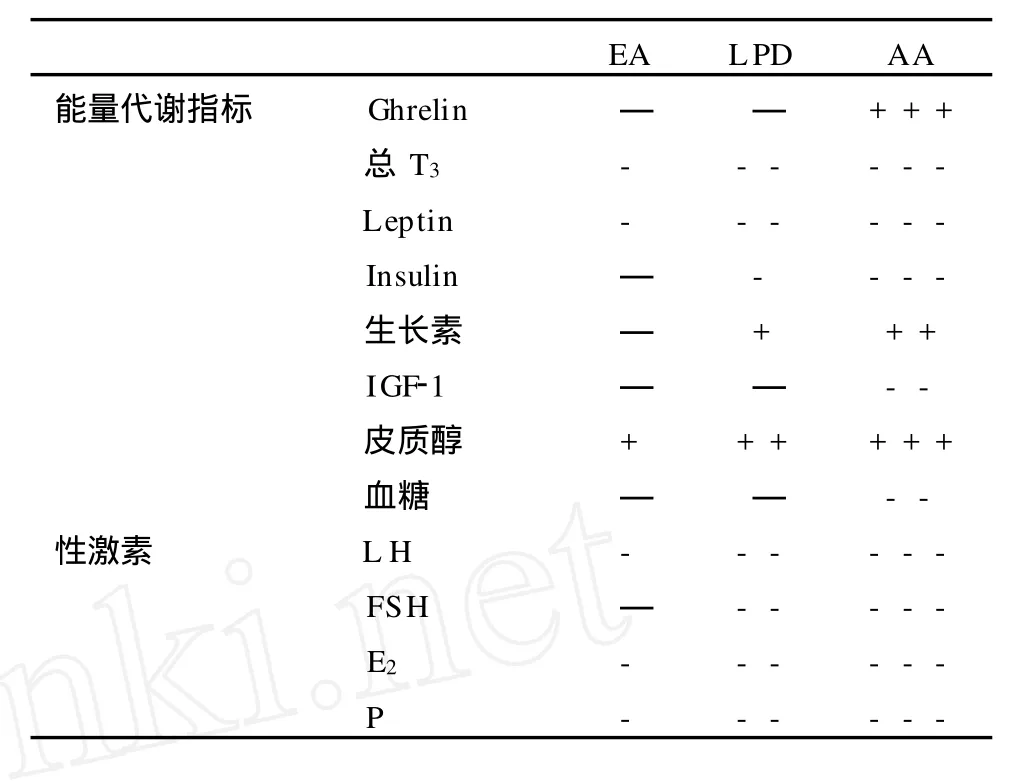
表1 月经周期正常、紊乱运动员能量代谢和性激素的变化一览表
Williams等对猴进行了一项实验,通过在保持训练不变的情况下增加能量摄入,运动性闭经的猴月经周期恢复,这对可利用能量和月经周期的关系提供了有力的证据[63]。闭经猴排卵功能的恢复和可利用能量之间形成一种量效关系,即排卵发生所需要的天数与能量提供高度相关,食物摄入多的猴恢复时间缩短。另外,在该研究中发现,循环系统中 T3的变化与闭经的形成和逆转密切相关,当运动增加能量消耗而体内不能提供足够能量时,会形成新的不平衡,机体将出现能量消耗减少的适应机制,这支持了生殖功能的抑制与能量消耗减少的适应机制密切相关的观点。
研究者对可利用能量降低在 EAMD病因学的重要作用的理解是发展的,可利用能量降到何种程度会直接对GnRH脉冲发生器产生影响需要进一步研究。早期的研究重点在于体重或体脂本身,而对人类和动物短期的研究发现,能量状况和生殖功能间的关系显示,禁食导致的LH脉冲节律降低先于体重的变化,具有代表性的研究发现,运动引起的闭经在个体间体重和体脂变化范围很大,但LH的变化与可利用能量密切相关。另外,在猴的 EAMD模型中发现,猴体重的变化在闭经形成过程中没有统计学差异。能量平衡中其他指标的变化如激素或底物的变化可能是GnRH神经元或其他神经递质系统调节 GnRH分泌关键信号的候选指标。事实上,许多研究发现,大量代谢因素直接或间接将外周能量代谢状况传递到大脑。Schneider的研究认为,瘦河马由于能量限制较胖河马更容易出现生殖系统抑制[51],但是Williams等发现对于运动猴来说,闭经形成的时间和原始体重间没有关系[62]。另外,这些因素和其他因素(如心理压力)有协同作用,是否能够共同抑制生殖功能,这有待于进一步研究。事实上,为了揭示能量代谢和生殖功能间复杂的交互作用,还有很长的路要走。
4 骨质疏松
目前,关于骨质疏松的诊断标准仍采用WHO推荐的标准:基于DXA的测定结果,骨密度值低于同性别、同种族健康成人的骨峰值不足一个标准差属正常;降低1~2.5个标准差之间为骨量减少;降低程度≥2.5个标准差为骨质疏松;骨密度降低程度符合骨质疏松诊断标准,同时伴有一处或多处骨折为严重骨质疏松。目前,通常用 T值表示,即 T≥-1.0个标准差为正常,-2.5个标准差<T< -1.0个标准差为骨量减少,T≤-2.5个标准差为骨质疏松。
对女性运动员骨量丢失的评定标准目前也采用临床T值标准,但它仅代表骨量减少或骨质疏松和年龄密切相关,并未考虑到其他的风险因素。对于运动员来说,骨量丢失常满足临床骨量减少标准而不是骨质疏松标准。骨量丢失使骨折的风险增加到100%,而且,需要长期关注这些个体的骨健康,而骨质疏松使出现骨折的风险更高。AA骨量丢失的患病率估计占运动员的1.4%~50%,而骨质疏松的患病率较骨量丢失的低[27]。但是,迄今仍未有女运动员骨量丢失患病率的资料出现,因此,无法判断骨质疏松对运动员的影响究竟有多大,或者较其他的运动性疾病危险程度有多高。
5 三因素的相互关系
5.1 闭经与骨量丢失
尽管运动对骨健康有促进作用,但是,许多文献都阐述了AA能够导致BMD减少,特别是腰椎骨,并且有研究发现,即使是月经稀疏的运动员其BMD也非常低。有一项对月经稀疏运动员的研究发现,受试者BMD仅为与之年龄一致月经周期正常女性的69%[11]。AA运动员的骨量丢失能导致在绝经前出现骨质疏松性骨折,包括压力性骨折、股骨和椎骨骨折。绝经期前和绝经期早期的BMD缺乏实际上是由无BMD高峰和/或在绝经期前骨量丢失太多造成的。其他的关键性研究发现,闭经持续时间与BMD成反比,而且在闭经早期骨质丢失最多。大量研究显示,BMD不仅与目前月经周期状态有关,而且还和EAMD史有关。在绝经期前出现骨量丢失被认为是没有达到骨峰值。骨峰值是绝经期骨量丢失率的预测指标,如果较低则会增加骨折风险[2]。因为,AA逆转使BMD恢复很少,且会导致年轻女运动员永久性失去获得峰值骨,故由AA引起的低BMD可能是无法恢复的。即使给予口服避孕药治疗或其他的激素替代疗法也不能明显提高AA的BMD[66]。
5.2 无排卵和LPD与骨量丢失
由于监测早期月经紊乱特性的方法学较困难,对月经周期轻微紊乱如LPD和无排卵出现骨量丢失可能性的研究困难较多。Prio r等在对中长跑运动员超过1年的研究发现,LPD和无排卵周期逐渐导致更多的椎骨骨量丢失(-4.2%);运动超过1年的女性,当黄体期<9.9天导致骨量丢失增加有统计学意义[46]。另外,在一个有代表性的研究中,De等报道了有LPD的运动女性较月经周期正常的久坐女性BMD降低有统计学差异[55]。Winters等发现,径赛运动员较常锻炼的对照组单位去脂体重钙质和腰椎骨BMD都降低[65]。在“女性生殖健康研究”中,Waller等发现,久坐有LPD的女性有类似结果。无论这些研究是否能够提供足够的证据来监测BMD微小变化,这都是有争议的。
5.3 EAMD、低雌激素和骨量丢失
众所周知,不管年龄怎么变化,长期低雌激素是导致女性骨量丢失的主要原因。E2在促进青少年和青年人骨质形成和维持成年女性骨质方面起着重要作用,有好几项研究支持 E2对骨生长的机械学作用[21]。AA中的低雌激素导致骨量减少的方式与绝经期女性骨量丢失的方式类似。可以从E2缺乏的神经性厌食女性患者得到可利用的支持数据,因为,E2、遗传和营养因素都能够影响骨峰值[48]。值得注意的是,运动引起的月经推迟可能导致骨峰值降低,EAMD轻度紊乱导致骨量丢失的机理常和低雌激素联系在一起。支持月经周期轻度紊乱与BMD降低有关的具有说服力的证据来自 Sower等的研究,他们发现,25~44岁E2亚临床症状降低的女性会出现BMD降低,而且,她们可能出现维持骨质的能力受损或完成骨峰值的能力受损,这与她们的年龄有关。Sowers等同时也发现, BMD较低的绝经期前女性黄体期性激素紊乱较多。关于运动女性无排卵和LPD每天尿代谢物E1C和PdG检测的文献报道发现E2降低现象[58]。De等虽然没有发现BMD减少,但是,他们通过对曲线下面积的评估发现,在LPD运动员中,E2水平在卵泡期的第2~12天显著降低,在黄体期E2也较低,甚至在该研究中排卵正常无LPD的女性E2水平在卵泡期第2~5天时也较低。由此可见,仅观察E2的变化在某些情况下是不合适的。如果以后的研究能够有更好地检测骨代谢的方法并提供 E2中度降低对骨代谢有负面影响,这将解释为什么月经周期正常的女性也可能存在骨量减少。但E2在对骨健康的影响方面是否存在阈值迄今仍未见报道。
5.4 EAMD、能量限制和骨量丢失
除需要考虑作为预测EAMD女性骨量丢失状况的低雌激素程度外,营养因素的影响,如微量元素的缺乏、能量限制和慢性能量缺乏等也被认为是导致BMD减少的潜在因素。能量对骨的限制效应可能间接通过能量缺乏导致E2降低,或直接通过微量营养素缺乏减少骨的营养因子如IGF-I和leptin。近期的研究发现,低leptin和骨量减少共存。因为,能量缺乏和EAMD存在高度相关性。许多文献报道,有EAMD女运动员的骨代谢关键内分泌指标下降,由此可以推测,能量限制对女运动员的骨健康有直接影响。迄今的研究结论认为,低 E2对骨量丢失有实质的影响,但也可能忽略能量限制对骨健康潜在的独立影响。支持该观点的证据是对神经性厌食和运动或其他原因引起的下丘脑型闭经患者给予口服避孕药治疗后骨量并未完全恢复[21]。类似的曾经出现过AA的运动员虽然月经周期完全恢复,但BMD却没有完全恢复。另外,在人类和动物中骨量丢失常和体重降低、能量限制和饮食受限联系在一起,当体重降低10%就能导致BMD减少1%~2%。
Zanke等通过生物标记法标记骨转化的信号来评定能量缺乏和运动对骨的影响,结果发现,AA骨形成的标记物被抑制,但是,骨吸收的信号没有变化[66]。因为骨形成指标是应对能量缺乏的反应物,而骨吸收指标则是 E2减少的标志,该项研究强有力地支持能量缺乏对AA骨量丢失的影响。Ihle等的研究证明运动女性能量缺乏的程度和骨转换指标间的关系,他们观察到,在骨指标、生殖及能量代谢指标间存在量效关系,故当能量中度限制时,骨形成指标被抑制,但在能量极度缺乏时才会出现骨量吸收增加[20]。只有当能量极度缺乏和血 E2降低超过18%时,才能观察到研究对象出现骨吸收加强;另一方面,在能量中度缺乏时会出现骨量形成指标降低。这些研究不难发现,骨转化发生变化可以不依靠 E2的变化,特别是骨形成的抑制进而使运动员BMD降低可以由长期能量缺乏引起。这些研究可以解释为什么无排卵周期和LPD患者虽然没有出现 E2严重降低却出现能量轻度缺乏,并出现代谢激素轻微变化,最终会形成BMD减少。
6 存在的问题
6.1 三联征各因素定义未标准化
迄今为止,三联征三因素的定义还未统一,亚临床症状有待于进一步区分,有必要为每种因素制定标准化的评定标准,为队医和医务工作者的检测提供可靠依据,从而提高三联征三因素的阳性检出率,为预防和治疗运动员三联征获得时间优势[44]。研究这些症状中每个症状和他们的交互作用的亚临床表现需要扩展三联征的定义,包括饮食失调的轻度形式,月经周期轻度紊乱和骨量丢失较小的程度。三联征也会出现在非运动员领域的业余体育爱好者中,故需要扩大监督范围,把年轻女性的大范围人群包括在内。
6.2 各个竞技项目三联征的患病率没有确切值
由于作者的能力有限,在所查的三联征人体试验的资料中,发现短期研究较多,但仅能找到数篇对其长期影响的研究,而且,在对于三联征的流行病学研究中,由于对概念的误解和标准的把握尺度问题,仅有的几篇中能用的数据也较少。因此,实际上,目前对每个竞技项目中是否都有三联征存在或者患病率是多少仍是一个未知数[45]。有必要对各个运动项目的女运动员进行队列研究,对运动员群体进行大样本流行病学调查,调查范围包括运动生涯、退役后的各个年龄阶段,从而能够了解三联征对运动员健康的影响、患病率的相对危险度和预后情况,为运动员的健康提供依据。
6.3 饮食失调的阈值仍是一个需要继续探讨的问题
在已有关于三联征的研究中,很多研究都涉及到能量失调的百分比,而且,每个研究得到的阈值都不一样。William最近对20~43岁久坐女性的一项研究发现,当中等强度的运动加上低于基本的能量需求的20%~35%时就能引起血 E2和尿 E1G降低[63];Loucks等通过对久坐女性在卵泡早期的5天每天进行70%˙VO2max的运动,发现当每天可利用能量低于30 kcal/kg瘦体重时,LH分泌节律出现变化[32];DiMarco等对大鼠的研究发现,当能量限制为对照组的70%时出现动情周期抑制[39]。尽管有这么多的阈值出现,基本都低于30%,但是,由于他们的实验都是按预先设定的某个值进行实验,因此,某个值之外的值并没有考虑,故有必要进行梯度试验,在一系列的取值中找出最小值,这样可以为运动员的饮食提供参考值。
7 小结与展望
女运动员和运动女性能量缺乏会引起低 E2增加,而且,与女运动员三联征密切相关,它是导致女运动员三联征的首要因素。因此,预防和治疗三联征的首要任务是调整饮食结构,保证运动员每日三大热能营养素的供能比,且按照其年龄阶段的能量需求进行能量补充,同时,要多补充钙和维生素D等微量元素。教练员和队医也需要密切注意运动员的营养状况,通过详细的饮食记录、基础代谢率以及甲状腺激素等的监测来加强对女运动员的日常监护,及时发现异常情况,及时调整饮食计划,减少三联征的发病率。
虽然,关于三联征的研究已经历了20年,但仍有许多问题需要进一步探讨,如判断三联征三要素的标准化,探讨不同年龄、不同体育项目三联征的发病率和出现三联征时可利用能量降低的阈值等。另外,能量因素和其他的一些因素(如心理压力)有协同作用,它们是否能够共同抑制生殖功能仍需进一步研究。同时,在不改变运动训练负荷的情况下,通过能量补充是否可以完全逆转三联征,以及其具体机理是什么,这都有待于进一步的研究。
[1]王杰龙,王人卫,方子龙.女运动员黄体功能不全和无排卵发生率研究[J].中国运动医学杂志,2009,28(2):142-146.
[2]王人卫,高勇,陆爱云.大强度运动训练对雌性大鼠性激素和骨密度的影响[J].中国运动医学杂志,2003,22(2):121-125. [3]ALEXANDER S KAUFFMAN,EM IL IE F RISSMAN.A critical role for the evolutionarily conserved gonadotropin-releasing hormone II:Mediation of energy status and female sexual behavior[J].Endocrinol,2004,145(8):3639-3646.
[4]AM ERICAN ACADEM YOF PEDIA TRICSCOMM ITTEEON SPORTS MEDICINE AND FITNESS.Medical concerns in the female athlete[J].Pediatrics,2000,106:610-613.
[5]AM IR KASSAM,JAMES W OVERSTREET,CHRISTINE SNOW-HARTER.Identification of anovulation and transient luteal function using a urinary PdG ratio algo rithm[J].Environmental Health Perspectives,1996,104(4):408-413.
[6]BEALS K A,MANORE MMB.Behavioral,psychological,and physical characteristics of female athleteswith subclinical eating disorders[J].Int J Sport Nutr Exe Metab,2000,(10):128-143.
[7]BELGARD T B F,H A,ROTHER E,ERNST M B.PDK1 deficiency in POMC-exp ressing cells reveals FOXO1-dependent andindependent pathways in control of energy homeostasis and stress response[J].Cell Metab,2008,(7):291-301.
[8]BLANDINE DE LAUZON,MON IQUE ROMON,VALÉRIE DESCHAMPS.The three-factor eating questionnaire-r18 is able to distinguish among different eating patterns in a general population[J].J Nutr,2004,134:2372-2380.
[9]BRUN ING J C GD,BURKSD J.Role of brain insulin receptor in control of body weight and rep roduction[J].Sci,2000,289: 2122-2125.
[10]BULLEN B A,SKRINAR GS,BEITINS IZ.Induction ofmenstrual disorders by strenuous exercise in untrained women[J]. N Engl J Med,1985,312:1349-1353.
[11]COBB K L,BACHRACH L K,GREENDALE G.Disordered eating,menstrual irregularity and bone mineral density in female athletes[J].Med Sci Sport Exe,2003,35:711-719.
[12]CSERM EL Y T,HALVAX L,SCHM IDT E.Occurrence of osteopenia among adolescent girlswith oligo/amenorrhea[J].Gynecol Endocrinol,2002,(2):99-105.
[13]DIPIETRO L,STACHENFELD N S.The female athlete triad [J].Med Sci Sports Exe,1997,12:1669-1671.
[14]D IPIETRO L,STACHENFELD N S.The myth of the female athlete triad[J].Br J Sports Med,2006,40:490-493.
[15]FINKELSTEIN J S,LEE M L,SOWERSM.Ethnic variation in bone density in p remenopausal and early perimenopasusal women:effectsof anthropometric and lifestyle factors[J].JClin Endocrinol Metab,2002,87:3057-3067.
[16]FRANCE BELL ISLE,ANNE-MARIE DAL IX.Cognitive restraint can be offset by distraction,leading to increased meal intake in women[J].Am J Clin Nutr,2001,74:197-200.
[17]GREM ION G,RIZZOL I R,SLOSMAN D.Oligoamenorrheic long-distance runnersmay lose more bone in spine than in femur[J].M ed Sci Spo rt Exe,2001,33:15-21.
[18]HAM IL TON-FA IRLY D,TA YLOR A.Anovulation[J].Br JMed,2003,327(7414):546-549.
[19]H IL TON L K,A B LOUCKS.Low energy availability,not exercise stress,supp resses the diurnal rhythm of lep tin in healthy young women[J].Am J Physiol Endocrinol Metab,2000,278: E43-E49.
[20]IHLE R,LOUCKS A B.Dose-response relationships between energy availability and bone turnover in young exercising women[J].JBone Min Res,2004,19(8):1231-1240.
[21]JARV INEN T L,KANNUS P,SIEVANEN H.Estrogen and bone-arep roductive and locomotive perspective[J].JBone Miner Res,2003,18:1921-1931.
[22]JEANNE F.N ICHOLS,M ITCHELL J RAUH,MANDRA J. Prevalenceof the Female A thlete Triad Syndrome Among High School A thletes[J].A rch Pediatr Adolesc Med,2006,160:137-142.
[23]JORDAN J,CRA IG K,CL IFTON D K.Luteal phase defect, the sensitivity and speci?city of diagnostic methods in clinical use[J].Fertil Steril,1994,62:54-62.
[24]KA IYING GUO,JONA THAN MOGEN,SAMUEL STRUZZI.Preadipocyte transplantation:an in vivo study of direct leptin signaling on adipocytemorphogenesis and cell size[J].Am J Physiol Regul Integr Comp Physio,2009,l296:R1339-R134.
[25]KAN ISJ A.Diagnosis of osteoporosis and assessment of fracture risk[J].Lancet,2002,359:1929-1936.
[26]KHAN KM,L IU-AMBROSE T,SRAN M M.New criteria for the female athlete triad syndrome[J].Br J Sports Med,2002, 36:10-13.
[27]KHAN A A,SYED Z.Bone densitometry in premenopausal women:synthesis and review[J].J Clin Densitom,2004,(7): 85-92.
[28]KOCH L W F,SEIBLER J,KONNER A C.Central insulin action regulates peripheral glucose and fat metabolism in mice [J].J Clin Invest,2008,118:2132-2147.
[29]KOPELA INEN R,ORAVA S,KARPA KKA J.Risk factors for recurrent stress fractures in athletes[J].Am J Sports Med, 2001,29:304-310.
[30]LAUDER T D,W ILLA IMS M V,CAMPBELL C S.The female athlete triad:p revalence in military women[J].M ilitary Med,1999,164:630-635.
[31]LOUCKSANNEB.New animalmodel opens opportunities for research on the female athlete triad[J].J Appl Physiol,2007, 103:1467-1468.
[32]LOUCKSANNEB.The responseof luteinizing hormone pulsatility to 5 daysof low energy availability disappears by 14 years of gynecological age[J].J Clin Endocrinol Metab,2006,91: 3158-3164.
[33]LOUCKSA B.Refutation of“the myth of the female athlete triad”[J].Br J Sports Med,2007,41:55-57.
[34]MALCOLM C E,CUMM ING D C.Does anovulation exist in eumenorrheic women[J].Obstet Gynecol,2003,102:317-318.
[35]MAL INA R M.Physical grow th and biological maturation of young athletes[J].Exe Spo rt Sci Rev,1994,22:389-433.
[36]MARY JANEDE SOUZA,NANCY IW ILL IAMS.Physiological aspects and clinical sequelae of energy deficiency and hypoestrogenism in exercising women[J].Human Rep roduction Update,2004,5:433-448.
[37]MCCONNELL H J,O’CONNOR K A,BRINDLE E.Validity of methods for analyzing urinary steroid data to detect ovulation in athletes[J].Med Sci Sport Exe,2002,34:1836-1844.
[38]MCNULTY K Y,ADAMS C H,ANDERSON J M.Development and validation of a screening tool to identify eating diso rders in female athletes[J].J Am Diet Assoc,2001,101:886-892.
[39]NANCY M DIMARCO,LYN DART,CHARLOTTE(BARNEY)SANBORN.Modified activity-stress paradigm in an animal model of the female athlete triad[J].J App l Physio,2007, l103:1469-1478.
[40]NA TIONAL A THLETIC TRA IN ING ASSOCIA TION REPORT.Recommendations and guidelines fo r app rop riate medical coverage of intercollegiate athletics[R].Revised May, 2003:1-22.
[41]N ISWENDER KD,M C,CLEGGDJ,OLSON R.Insulin activation of phosphatidylinositol 3-kinase in the hypothalamic arcuate nucleus:a key mediator of insulin-induced anorexia[J].Diabetes,2003,52:227-231
[42]OPPL IGER R A,U TTER A C,SCOTT J R.NCAA rule change imp roves weight loss among national championship w restlers[J].Med Sci Sports Exerc,2006,38:963-970.
[43]OTIS C L,DRINKWA TER B L,JOHNSON M.ACSM Position Stand on the female athlete triad[J].Med Sci Spo rts Exerc,2007,29:i-ix.
[44]PIETRO L D I,N STACHENFELD.Refutation of themyth of the female athlete triad[J].Br J Sports Med,2007,41:57-58. [45]PLUM L,B.B.,BRUN ING J C.Central insulin action in energy and glucose homeostasis[J].J Clin Invest,2006,116:1761-1766.
[46]PRIOR JC,V IGNA YM,BARR S I.Cyclicmedroxyprogesterone treatment increases bone density:controlled trial in active women w ithmenstrual cycle disturbances[J].Am JMed,1994, 96:521-530.
[47]RAYMOND C BOSTON,PETER J MOA TE,KELLY C ALL ISON.Modeling circadian rhythmsof food intake by meansof parametric deconvolution:results from studies of the night eating syndrome[J].Am J of Clinical Nutrition,2008,87(6):1672-1677.
[48]RIGGSB L,KHOSLA S,A TKINSON EJ.Evidence that type I osteoporosis results from enhanced responsiveness of bone to estrogen de?ciency[J].Osteoporos Int,2003,14:728-733.
[49]ROMON M,PLEBEL,C VELL Y.Lep tin response to carbohydrate o r fat meal and association w ith subsequent satiety and energy intake[J].Am J Physiol Endocrinol Metab,1999,277: E855-E861.
[50]SAN TORO N,BROWN J R,ADEL T.Characterization of rep roductive hormonal dynamics in the perimenopause[J].J Clin Endocrinol Metab,1992,81:1495-1501.
[51]SCHNEIDER M,B IJUR P,FISHER M.Menstrual irregularities in female military cadets:comparison of data utilizing dhort-term and long-term recall[J].J Pediatr Adolesc Gynecol, 2003,16:89-93.
[52]SH IRTCL IFF EA,REAV IS R,OVERMAN WH.Measurement of gonadal hormones in dried blood spots versus serum, veri?cation of menstrual cycle phase[J].Horm Behav,2001, 39:258-266.
[53]SOUZA DE MJ,VANHEEST JL,DEM ERS L.Luteal phase deficiency in recreational runners,evidence fo r a hypometabolic state[J].J Clin Endocrinol Metab,2003,88:37-346.
[54]SOUZA M J DE,N IW ILL IAMS,J L VANHEEST.Correction of misinterp retations and misrepresentations of the female triad[J].Br J Sports Med,2007,41:58-59.
[55]SOUZA DEMJ,O’DONNELL E,HONTSCHARU K R.Diagnosisof osteopeniamay indicate the presence of increased cardiovascular risk in female athletes[J].Proc Am Coll Sports. Med.Med Sci Spo rts Exe,2004b,36(5):1915-1922.
[56]SOUZA DE MJ,MCCONNELL HJ,O’DONNELL E.Fasting ghrelin levels in physically active women:relationship with menstrual disturbances and metabolic status[J].J Clin Endocrinol Metab,2004a,89:(7):1356-1464.
[57]SOUZA M JDE,R J TOOMBS,J L SCHEID.High p revalence of subtle and severe menstrual disturbances in exercising women:confirmation using daily hormone measures[J].Hum. Rep rod,2010,25:491-503.
[58]SOWERSM,RANDOLPH JF,CRU TCHFIELD M.U rinary ovarian and gonadotropin hormone levels in premenopausal women with low bone mass[J].J Bone M iner Res,1998,13: 1191-1202.
[59]TORSTVEIT M K,SUNDGOT-BORGEN J.The female athlete triad exits in both elite athletes and controls[J].Med Sci Sports Exerc,2005,37:1449-1459.
[60]THE ESHRECAPRIWORKSHOP GROUP.Nutrition and rep roduction in women[J].Human Rep roduct Update,2006,12 (3):193-207.
[61]WARREN M P,BROOKS-GUNN J,FOX RP.Persistent osteopenia in ballet dancersw ith amenorrhea and delayed menarche despite ho rmone therapy,a longitudinal study[J].Fertil Steril,2003,80:398-404.
[62]W ILL IAMSN I,CASTON-BALDERRAMA A,HELMREICH DL.Longitudinal changes in rep roductive ho rmones and menstrual cyclicity in cynomolgus monkeys during strenuous exercise training,abrup t transition to exercise induced amenorrhea [J].Endocrinol,2001a,142:2381-2389.
[63]W ILL IAMSN I,HELMREICH D L,PARFITT DB.Evidence for a casual role of low energy availability in the induction of menstrual cycle disturbances during strenuous exercise training[J].J Clin Endocrinol Metab,2001b,86:5184-5193.
[64]W ILL IAMSN I,J L REED,H J LEIDY.Estrogen and progesterone exposure is reduced in response to energy deficiency in women aged 25-40 years[J].Hum.Rep rod,2010,25(9):2328-2339.
[65]W INTERS KM,ADAMSWC,M EREDITH CN.Bone density and cyclic ovarian function in runners and active controls[J]. Med Sci Sport Exe,1996,28:776-785.
[66]ZANKER C L,COOKECB,TRUSCOTT J G.Annual changes of bone density over 12 years in an amenorrheic athlete[J]. Med Sci Spo rt Exe,2004,36:137-142.
[67]ZEN I-HOCH A,DEM PSEY R L,CARRERA G F.Is there an association between athletic amenorrhea and endothelial cell dysfunction[J].Med Sci Sport Exe,2003,35:377-383.
[68]ZIOM KIEW ICZ A,P T ELL ISON,S F L IPSON.Body fat,energy balance and estradiol levels:a study based on hormonal p rofiles from completemenstrual cycles[J].Human Rep roduction,2008,23(11):2555-2563.

