土壤多重抗生素抗性放线菌的筛选及其发酵产物的初步研究
王相晶,王晓舟,张 继,朱兆香,向文胜*,张匀华
(1.黑龙江省农业科学院博士后工作站,哈尔滨 150001;2.东北林业大学博士后流动站,哈尔滨 150086;3.东北农业大学生生命科学学院,哈尔滨 150030)
放线菌可产生具有结构多样性的代谢产物,在工农业生产和人类疾病防治中发挥重要的作用[1-3]。随着大量新抗生素筛选工作的开展,具有生物活性的菌株及其代谢产物被大量发现,利用传统分离放线菌的方法往往导致菌株的重复分离以及新化合物的发现几率降低等一系列问题[4]。而对微生物的基因组序列分析显示微生物的基因组中含有大量潜在的次级代谢合成基因簇,其数量远远超过已知的抗生素的种类[5]。仅在Streptomyces coelicolor、S.avermitilis和S.griseus的基因组中就分别发现20、25和34个参与次级代谢的基因簇,这些基因簇大都处于沉默状态,只有在特定的条件下才能表达[6-8]。目前通过激活放线菌的潜在的次级代谢合成途径而对已知的放线菌资源进行开发的新技术的研究正成为微生物天然产物的热点之一,而抗生素抗性筛选的方法由于具有操作简单,成本较低而备受关注[9-10]。据文献报道,土壤微生物经链霉素(Streptomycin)、庆大霉素(Gentamycin)和利福平(Rifampicin)筛选后能存活的菌株中,有50%的可产生抗生素,这一比例远高于普通微生物的筛选比率[11]。此外,该方法还被用于赋予放线菌抗生素抗性突变,以用于提高放线菌次级代谢物的产量[12-13]。
为了获得更多具有生物活性的化合物及其产生菌株,本研究利用多重抗生素抗性筛选的方法对不同地区土样中分离得到的放线菌进行链霉素、庆大霉素和利福平的三重抗性筛选,最终获得对三种抗生素均有较高抗性并具有抑菌活性的菌株,并对该菌株进行了分子生物学的鉴定以及发酵产物的初步研究。
1 材料与方法
1.1 材料
1.1.1 土壤样品
挑选了内蒙古呼伦贝尔市、福建省仙游县、江西省丰城市以及浙江省富阳市内的4个样区,采集15~20 cm深的土样,3~5点混合为一份,放入无菌纸袋中(见表1),-20℃长期保存。使用前将土样铺于无菌培养皿内,25~28℃自然干燥7~14 d后磨碎备用。

表1 采集土样的基本信息Table1 The essential information of soil samples
1.1.2 生物活性测定菌
枯草芽孢杆菌ATCC 6633(Bacillus subtilis)及藤黄微球菌 ATCC 9341(Micrococcus luteus)为本实验室保存菌。
1.1.3 培养基
①分离及抗性筛选培养基:高氏一号培养基[14]。
②种子培养基:黄豆饼粉1.0%,棉籽饼粉1.0%,玉米淀粉2.0%,葡萄糖0.5%,pH 7.2。
③发酵培养基:蔗糖4%,可溶性淀粉4%,CaCO30.3%,KNO30.1%,NaCl 0.05%,K2HPO4·3H2O 0.05%,MgSO4·7H2O 0.05%,FeSO4·7H2O 0.001%,pH 7.4~7.6。
④生物活性测定培养基:枯草芽孢杆菌ATCC 6633的培养基配方为:多聚蛋白胨1%,牛肉膏 0.15%,NaCl 0.5%,琼脂 1.3%,pH 7.8~8.0。藤黄微球菌ATCC 9341的培养基配方为:多聚蛋白胨0.6%,牛肉膏0.15%,酵母膏0.3%,水解酪蛋白0.4%,葡萄糖0.1%,琼脂1.3%,pH 7.8~8.0。
1.2 方法
1.2.1 放线菌分离
取上述5 g土样置于含15~20个小玻璃珠已灭菌的三角瓶中,加入45mL无菌水,即为土壤浸液。将土壤浸液于30℃摇振20 min,过滤后适当稀释分别涂布高氏一号培养基,其中加入终浓度为2μg·mL-1的青霉素和75μg·mL-1的重铬酸钾[15]。
1.2.2 原始放线菌抑菌活性测定
将分离得到的待测菌株接入发酵培养基,30 ℃,250 r·min-1培养6~8 d,直至发酵液颜色逐渐加深,菌丝体碎片逐渐增多,停止发酵。以枯草芽孢杆菌和藤黄微球菌为指示菌,用单层杯碟法测定发酵液的抑菌活性,每孔加发酵液100μL,37℃培养24 h,用游标卡尺测量抑菌圈直径[16]。
1.2.3 放线菌单孢子悬浮液的制备
待斜面培养基上的孢子成熟后,加入无菌水,用接种环刮下孢子并制成单孢子悬浮液,无菌滤纸过滤后调整孢子浓度为106cfu·mL-1[17]。
1.2.4 放线菌的三重抗性筛选
取200μL放线菌单孢子悬浮液分别涂布于含有2、5、10、20、40μg·mL-1链霉素的高氏一号平板培养基,30℃培养7~14 d后,挑取可在较高抗生素浓度下生长的菌株并用同样方法涂布于含有1、3、5、8、10μg·mL-1庆大霉素的高氏一号平板,长出成熟的孢子后,挑取可在较高抗生素浓度下生长的菌株涂布于含有10、50、100、150、200μg·mL-1利福平的高氏一号平板继续筛选,将最终获得的具有三重抗性的放线菌进行保存及扩大培养,比较抑菌效果后选择抗性及抑菌效果均较高的放线菌用于后续研究。并暂时将所获得的一株目的菌命名为1号放线菌。
1.2.5 1号放线菌的发酵培养
取浓度为106cfu·mL-1的孢子悬液200μL加入装有25mL种子培养基的250mL三角瓶中,30℃,250 r·min-1震荡培养至对数生长期后以8%接种量接种至发酵培养基中,30℃,250 r·min-1培养,每隔24 h做镜检观察,测定发酵液pH和生物量,并取发酵液上清以及沉淀浸提液用于生物活性测定等试验。
1.2.6 抑菌物质稳定性试验
取发酵液上清以及沉淀浸提液,调整pH为2、 4、 7、 9、 11,在 室 温 、 30、 40、 50、 60、70、80和90℃分别处理0.5、1及1.5 h,比较处理前后发酵液上清以及沉淀浸提液的抑菌活性。
1.2.7 1号放线菌的16S rDNA鉴定
基因组DNA提取及16S rDNA扩增参考文献[18-19]。PCR产物测序后将序列提交至NCBI数据库,应用Blast程序与数据库中已有的细菌16S rDNA序列进行相似性比较分析。
2 结果与分析
2.1 土壤放线菌分离结果
结果见图版Ⅰ。
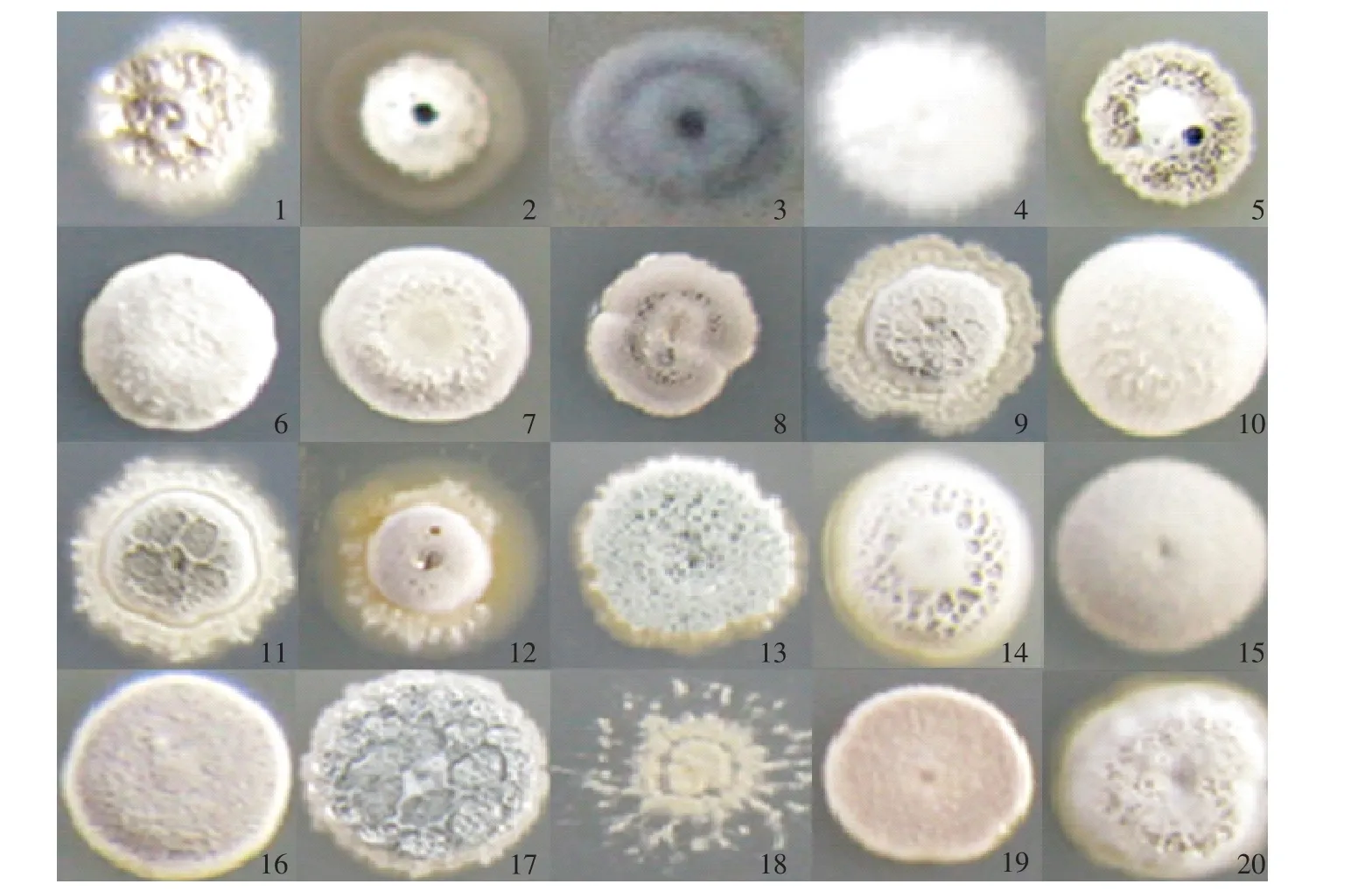
图版I 20种放线菌菌落形态Plate I Colony morphology of twenty actinomycetes
从上述4个地区的土样中共分离到20株天然无抗菌活性或抗菌活性微弱放线菌(抑菌圈<2 mm)。图版Ⅰ为所筛选到的20株放线菌的单菌落形态。其中1~5号菌由内蒙古呼伦贝尔市伊敏镇的土样中筛选得到;6~9号菌由福建省仙游县紫泽村的土样中筛选得到;10~16号菌由江西省丰城市圳头乡的土样中筛选得到;17~20号菌由浙江省富阳市胥口镇的土样中筛选得到。
2.2 放线菌的抗性筛选结果
放线菌的三重抗生素抗性筛选结果如表2所示。
在所分离得到的20株放线菌中,当培养基中含有10μg·mL-1链霉素时,只有1号和2号放线菌有菌落长出,当培养基中含有8μg·mL-1庆大霉素时,只有1、3和9号放线菌有菌落长出;当培养基中含有150μg·mL-1利福平时,只有1、4、5和20号放线菌有菌落长出。其中只有1号放线菌能在含有40μg·mL-1链霉素、10μg·mL-1庆大霉素以及150μg·mL-1利福平的平板上生长。抑菌活性测定结果显示,在20株放线菌中,有17株经过抗性筛选后产生了抑菌活性,其中1号放线菌对枯草芽孢杆菌及藤黄微球菌的抑菌圈直径分别为20.52和23.23 mm,均高于其他放线菌。故选用1号放线菌进行后续试验。
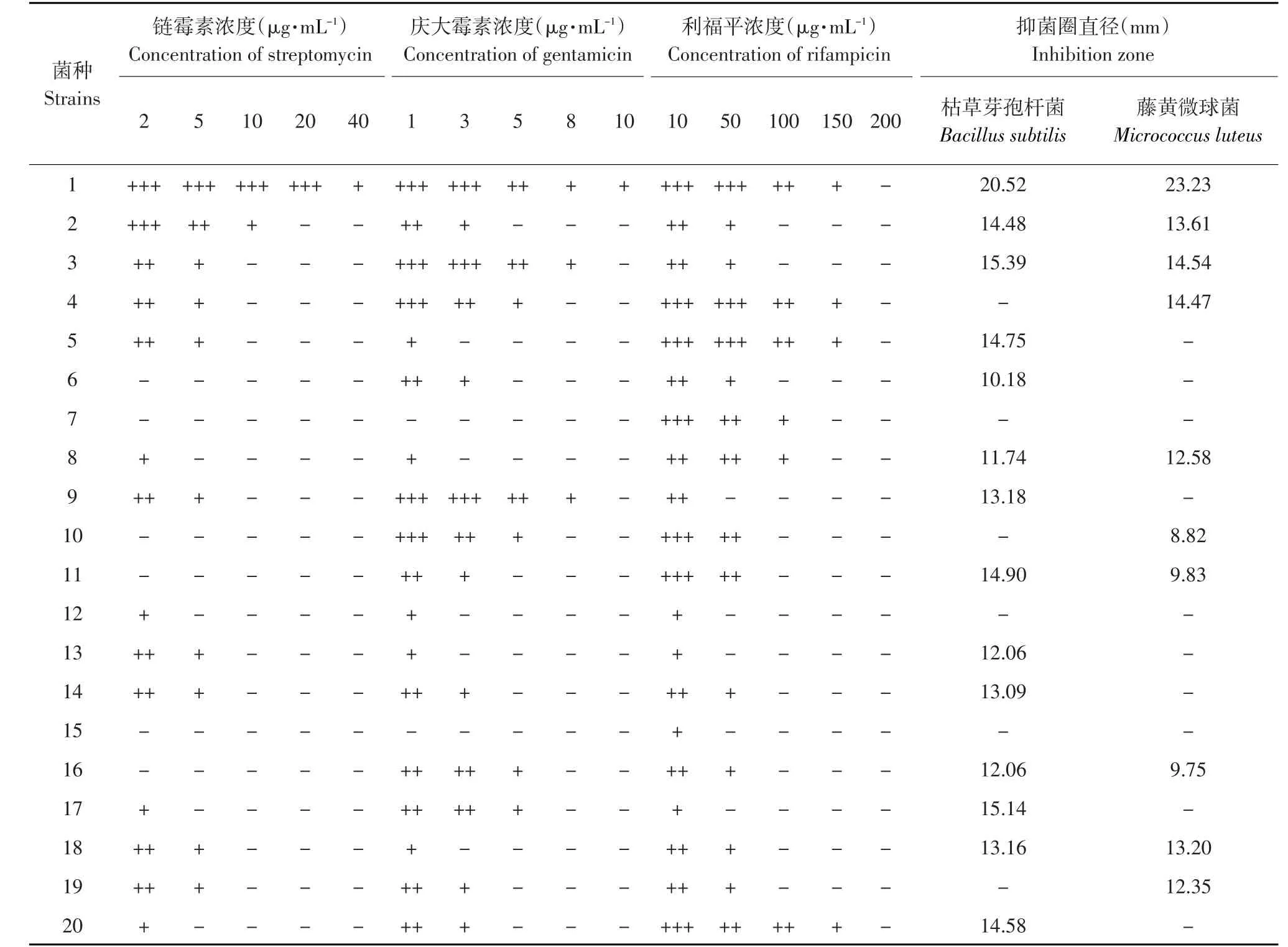
表2 链霉素、庆大霉素及利福平抗性筛选放线菌结果Table2 Results of resistance screening to streptomycin,gentamicin and rifampicin
2.3 发酵时间与发酵液pH、菌丝体生物量以及菌液生物活性之间的关系
将1号放线菌进行发酵培养,每隔24 h测定发酵液pH和菌体生物量。由图2可以看出,随着时间变化,发酵液pH经过了先升高后降低再升高的过程,生物量呈现先升高后降低的变化,于第10天达到最大浓度。镜下观察显示,第10天后,菌丝体开始断裂。

图2 1号放线菌发酵液pH和生物量随发酵时间的变化Fig.2 Correlations between fermentation time and pH or packed mycelium volume
菌液生物活性与发酵时间之间的关系如图3所示。由图3可知1号放线菌发酵液的抑菌活性呈先升高后降低的趋势,在第10天左右达到活性最大值。由此可以确定1号放线菌在该发酵条件下的最适发酵时间为10 d。
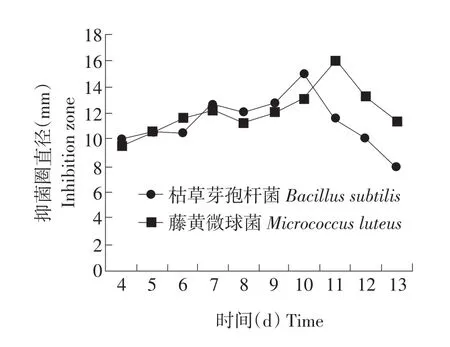
图3 发酵液对枯草芽孢杆菌及藤黄微球菌抑制活性Fig.3 Correlations between fermentation time and inhibitory activity on Bacillus subtilis and Micrococcus luteus
2.4 发酵液的生物活性测定结果
采用单层杯碟法测定发酵液上清及菌体浸提液抑菌活性的结果见表3。由表可见1号放线菌的发酵液上清及菌体浸提液对枯草芽孢杆菌和藤黄微球菌均有抑制活性,对藤黄微球菌的抑制活性略大于枯草芽孢杆菌,发酵液上清活性略大于菌体浸提液。

表3 发酵液上清及菌体浸提液对枯草芽孢杆菌和藤黄微球菌的抑制作用Table3 Inhibition of supernatant and mycelium extract on Bacillus subtilis and Micrococcus luteus (mm)
2.5 发酵液中抑菌物质稳定性试验
2.5.1 温度对1号放线菌发酵液上清以及菌体浸提液活性的影响
通过对1号放线菌发酵液上清和菌体浸提液在不同温度下处理不同时间后,其抑菌圈直径如表4~6所示。
由以上结果可知,在50℃水浴条件下处理发酵液上清1 h后,其抑菌活性基本丧失;而菌体浸提液经过90℃水浴处理1.5 h后活性稳定。
2.5.2 pH对1号放线菌发酵液上清以及菌体浸提液活性的影响
1号放线菌发酵液上清和菌体浸提液在不同pH下,其抑菌活性变化如表7所示。

表4 不同温度处理下1号放线菌发酵液上清对枯草芽孢杆菌及藤黄微球菌的生长抑制Table4 Inhibition of supernatant on Bacillus subtilis and Micrococcus luteus under different temperature (mm)
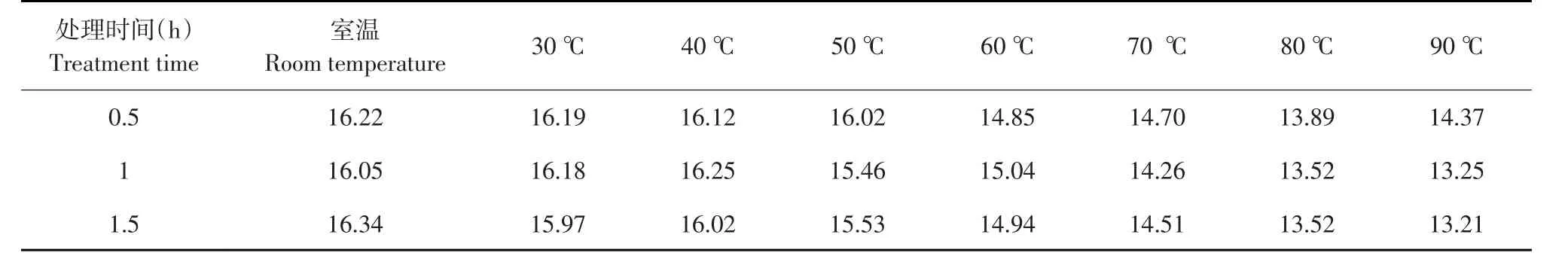
表5 不同温度处理下1号放线菌菌体浸提液对藤黄微球菌的生长抑制Table5 Inhibition of mycelium extract under on Micrococcus luteuss different temperature (mm)

表6 不同温度处理下1号放线菌菌体浸提液对枯草芽孢杆菌的生长抑制Table6 Inhibition of mycelium extract treatments on Bacillus subtilis under different temperature (mm)

表7 不同pH下1号放线菌发酵液上清以及菌体浸提液对枯草烟包杆菌及藤黄微球菌的生长抑制Table7 Inhibition of supernatant and mycelium extract on Bacillus subtilis and Micrococcus luteus under different pH (mm)
由此可知,发酵液上清活性受pH影响变化较大,pH达到4以下或者9以上都会使其失活。而菌体浸提液活性受pH影响变化较小,即使在pH达到2或11的条件下也能保持稳定的活性。
2.6 1号放线菌的16SrDNA鉴定
对1号放线菌的16S rDNA序列(1520bp)进行测序,并与GenBank中16S rDNA序列进行比对,其同链霉菌Streptomyces griseus的相似性达到99%。采用Clustalx 1.81软件,用N-J法建立系统发育树,如图4所示,对其进行分析,二者之间的进化距离相隔较近。结合对1号放线菌的形态观察,进一步确定1号放线菌属于链霉菌属拉丁文。

图4 1号放线菌的系统发育树Fig.4 16S rDNA phylogenetic tree of the No.1 actinomycete
3 讨论与结论
本研究以对链霉素、庆大霉素及利福平的抗性为指标,从不同地域采集的土样中分离得到1株对以上三种抗生素具有较高抗性的菌株(1号放线菌),其对链霉素、庆大霉素和利福平的抗性分别为40、10和150μg·mL-1。经三重抗生素筛选后,该放线菌对枯草芽孢杆菌和藤黄微球菌的抑菌活性得到了极大的提高。虽然多重抗生素抗性可增强放线菌的生物活性的机制不十分清楚,但据文献报道,放线菌对链霉素、庆大霉素和利福平抗性的产生与编码核糖体S12的基因rpsL和编码16S rRNA甲基转移酶的基因rsmG,以及编码RNA聚合酶β亚基的基因rpoB的突变有关[20-22]。这些基因的突变可增强微生物次级代谢基因簇的转录和翻译活性或激活沉默的基因簇,进而提高抗生素的产量和产生新的抗生素[9-13,20-22]。对于1号放线菌在经抗生素抗性筛选前后抗菌活性的变化是否由于rpsL、rsmG和rpoB的突变而引起,需要经进一步的PCR验证。对1号放线菌的发酵条件及活性物质进行了初步研究,结果显示具有抗菌活性的代谢产物主要集中于发酵液上清液中,且对酸碱和温度的敏感性较高,由此判断1号放线菌所产生的抗菌活性物质很可能是蛋白质或肽类抗生素[23-24]。目前已有多种具有生物活性的肽类或蛋白类抗生素从多种微生物(如枯草芽孢杆菌、乳酸菌、放线菌)中分离和鉴定,它们对植物病原真菌和一系列的革兰氏阳性菌及革兰氏阴性菌具有较好的抑制作用,并在人类的疾病防治方面显示出较好的潜力[25-27]。
本试验结果表明1号放线菌菌可产生具有抗菌活性的代谢产物,关于活性代谢物的分离鉴定还有待于进一步的研究。
综上所述,本研究证实利用三重抗生素抗性筛选可以通过激活微生物中沉默的基因而提高活性代谢产物的产量或产生新的活性代谢物,从而增强微生物的生物活性。该方法为高效利用放线菌资源以及开发放线菌产生活性物质的潜能提供了新的思路和途径。
[1]黄世文,高成伟,王玲,等.土壤中有益放线菌的高效分离、筛选和生物测定技术[J].植物保护,2008,34(1):138-141.
[2]许英俊,薛泉宏,邢胜利,等.3株放线菌对草莓的促生作用及对PPO活性的影响[J].西北农业学报,2008,17(1):129-136.
[3]高爱丽,王相晶,向文胜,等.吸水链霉菌新种的筛选和鉴定[J].东北农业大学学报,2007,38(3):361-364.
[4]Busti E,Monciardini P,Cavaletti L,et al.Antibiotic-producing ability by representatives of a newly discovered lineage of actinomycetes[J].Microbiology,2006,152:675-683.
[5]Li J W,Vederas J C.Drug discovery and natural products:End of an era or an endless frontier?[J]Science,2009,325(5937):161-165.
[6]Bentley S D,Chater K F,Cerdeño-Tárraga,A M,et al.Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2)[J].Nature,2002,417:141-147.
[7]Ikeda H,Ishikawa J,Hanamoto A,et al.Complete genome sequence and comparative analysis of the industrial microorganism Streptomyces avermitilis[J].Nat Biotechnol,2003,21:526-531.
[8]Ohnishi Y,Ishikawa J,Hara H,et al.Genome sequence of the streptomycin-producing microorganism Streptomyces griseus IFO 13350[J].J Bacteriol,2008,190:4050-4060.
[9]Wang X J,Wang X C,Xiang W S.Improvement of milbemycin-producing Streptomyces bingchenggensis by rational screening of ultraviolet and chemically induced mutants[J].World J Microbiol Biotechnol,2009,25:1051-1056.
[10]Beltramenti F,Rossi R,Selva E,et al.Antibiotic production improvement in the rare actinomycete Planobispora rosea by selection of mutants resistant to the aminoglycosides streptomycin and gentamycin and rifamycin[J].J Ind Microbiol Biotechnol,2006,33:283-288.
[11]Ochi K,Hu H,Hino M,et al.Method for increasing the production of a secondary metabolite in a microorganism by introducing mutations that confer antibiotic resistance[P].Patent:WO 02/079453,2002.
[12]沈玲,郭正彦,姬志勤,等.利用链霉素耐药性突变筛选抗菌活性放线菌[J].农药学学报,2008,10(1):61-67.
[13]Shima J,Hesketh A,Okamoto S,et al.Induction of actinorhodin production by rpsL(encoding ribosomal protein S12)mutations that confer streptomycin resistance in Streptomyces lividans and Streptomyces coelicolor A3(2)[J].J Bacteriol,1996,178:7276-7284.
[14]程丽娟,薛泉宏,来航线,等.微生物学实验技术[M].西安:世界图书出版公司,1988.
[15]司美茹,薛泉宏,来航线.放线菌分离培养基筛选及杂菌抑制方法研究[J].微生物学通报,2004,31(2):61-65.
[16]胡昌勤,刘炜.抗生素微生物检定法及其标准操作[M].北京:气象出版社,2004:2.
[17]卢文玉,闻建平,范晶华,等.激光诱变玫瑰孢链霉菌结合链霉素抗性筛选法选育达托霉素高产菌株[J].微生物学通报,2006,33(3):10-13.
[18]Xue S,Zhang H T,Wu P C,et al.Study on bioactivity of extracts frommarine sponges in Chinese Sea[J].J Expmar Biol Ecol,2004,298:71-78.
[19]曹广丽,陈立梅,徐文静,等.番茄叶霉病拮抗链霉菌BPS2的筛选及鉴定[J].东北农业大学学报,2007,38(3):343-347.
[20]Nishimura K,Hosaka T,Tokuyama S,et al.Mutations in rsmG,encoding a 16S rRNA methyltransferase,result in low-level streptomycin resistance and antibiotic overproduction in Streptomyces coelicolor A3(2)[J].J Bacteriol,2007,189(10):3876-3883.
[21]Tanaka Y,Komatsu M,Okamoto S,et al.Antibiotic overproduction by rpsL and rsmG mutants of various actinomycetes[J].Appl Environ Microbiol,2009,75(14):4919-4922.
[22]Tanaka Y,Tokuyama S,Ochi K.Activation of secondary metabolite-biosynthetic gene clusters by generating rsmG mutations in Streptomyces griseus[J].J Antibiot,2009,62(12):669-673.
[23]于婷,尚玉珂,李艳芳,等.短小芽孢杆菌BSH-4抗菌物质的提取及其特性[J].植物保护学报,2009,36(1):65-69.
[24]杜春梅,王葳,葛菁萍,等.生防菌BL-21的鉴定及活性产物[J].植物保护学报,2007,34(4):359-363.
[25]Motohashi K,Toda T,Sue M,et al.Isolation and structure elucidation of tumescenamides A and B,two peptides produced by Streptomyces tumescens YM23-260[J].J Antibiot,2010,63:549-552.
[26]Sawa N,Zendo T,Kiyofuji J,et al.,Identification and characterization of lactocyclicin Q,a novel cyclic bacteriocin produced by Lactococcus sp.strain QU 12[J].Appl Environ Microbiol,2009,75(6):1552-1558.
[27]Chen L,Wang N,Wang X,et al.Characterization of two antifungallipopeptides produced by Bacillusamyloliquefaciens SH-B10[J].Bioresour Technol,2010,101:8822-8827.

