VEGF及其受体Flt-1和Flk-1在人体黑色素瘤中的表达
李 静,孙保存,古 强,董学易,韩春荣,宗文康,赵 楠,刘艳荣,赵秀兰
(1.天津医科大学病理学教研室,天津300070;2.天津医科大学肿瘤医院病理科,天津300060)
恶性黑色素瘤是起源于神经嵴黑色素细胞的恶性肿瘤,其主要病变特点是发病年龄早、转移率高、血液供应丰富,具有多种血管生成模式[1]。目前在黑色素瘤中发现的微循环模式有内皮依赖性血管、马赛克血管和血管生成拟态(vasculogenic mimicry,VM),VM参与构筑肿瘤组织的功能性微循环,与肿瘤细胞增殖、侵袭、转移等生物学行为有关。线形程序性坏死(linearly patterned programmed cell necrosis,LPPCN)是黑色素瘤组织中存在的一种特殊形式的程序性死亡现象,本课题组前期研究工作表明LPPCN可能为VM、内皮依赖性血管形成提供一定的空间结构基础[2],而血管内皮生长因子(VEGF)对血管生长具有强诱导作用,是作用于血管内皮细胞的重要生长因子之一,并直接参与诱导肿瘤血管生成。因此,本实验对VEGF及其受体(Flt-1、Flk-1)是否参与LPPCN到VM的转变及其在病人预后中的作用进行初步探讨。
1 材料与方法
1.1 材料 收集天津医科大学肿瘤医院1996年7月~2007年11月间经手术切除、福尔马林固定、常规石蜡包埋并经两位病理医师诊断证实为黑色素瘤的石蜡标本,共70例。所有病例均诊断明确,临床资料及随访资料完整。
1.2 实验方法 石蜡标本常规切片,分别作HE染色、CD31与PAS双重染色以及免疫组织化学二步法进行VEGF、Flt-1、Flk-1染色。兔抗人CD31多克隆抗体(Ab28464)稀释度1∶50,购自Abcam公司,兔抗人VEGF多克隆抗体稀释度1∶100,购自北京中杉生物技术有限公司,兔抗人Flt-1多克隆抗体(RB-1527-P0)稀释度1∶100,购自Thermo公司,鼠抗人Flk-1单克隆抗体(sc-6251)稀释度1∶100,购自SANTA CRUZ公司。用已知阳性片和PBS代替一抗分别作阳性和阴性对照。
1.3 结果判断 VEGF免疫组化染色以细胞浆内和(或)细胞膜出现棕黄色颗粒者为阳性细胞。Flt-1和Flk-1表达定位于细胞浆内和肿瘤间质血管内皮细胞胞浆内,以出现棕黄色颗粒为阳性细胞。分别选取典型的5个LPPCN及VM区域,在400倍光镜下分别计数LPPCN及VM周围肿瘤细胞1~3层、4~6层及7~9层中的阳性率,取平均值。根据肿瘤细胞阳性率结合染色强度综合评价染色指数。染色强度:肿瘤细胞无着色为0,染成浅黄色为1,棕黄色为2,深黄色为3;阳性率的评定:0~19%阳性细胞转换数值为0,20%~39%阳性细胞转换数值为1,40% ~59%阳性细胞转换数值为2,>60%阳性细胞转换数值为3。染色指数为染色强度和染色阳性细胞率转换数值的总和,染色指数<1为阴性。
1.4 统计学处理 应用SPSS16.0for windows统计软件包和Excel 2003进行统计学分析。计量资料数据进行正态性检验和方差齐性检验,数据符合正态分布且方差齐性,采用ANOVA分析。采用Kaplan-Meier估计生存曲线法做出各组间的生存曲线,对数秩和检验(Log-rank test)法比较各组间的生存曲线的差别。计数资料采用四格表的确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 HE、CD31与PAS染色结果 显微镜下,HE染色的LPPCN细胞的胞核深染、细胞浆浓缩、细胞之间界限清楚。LPPCN呈线形、网状、分支状排列,穿插于周围肿瘤组织之间(图1)。随机选取10个高倍视野(×200),分别计数100个肿瘤细胞,LPPCN的平均细胞数少于5%者记为阴性,70例黑色素瘤组织标本中,LPPCN阳性者占54.29%(38/70)。CD31/ PAS双染切片出现CD31染色阴性,而由PAS阳性物质围成的管腔结构,管腔内存在红细胞,周围没有出血坏死和炎症细胞浸润,此为VM阳性(图2)。70例标本中VM阳性率为47.14%(33/70)。

图1 HE染色(×200)Fig 1 HE staining(×200)

图2 CD31/PAS双重染色(×400)Fig2CD31/PASdoublestaining(×400)
2.2 VEGF、Flt-1及Flk-1在LPPCN和VM周围肿瘤细胞中的表达 VEGF在LPPCN周围肿瘤细胞1~3层中的表达强于其外围肿瘤细胞(P<0.01),在外围4~6层与7~9层之间的表达差异无统计学意义(P>0.05)(图3)。Flk-1在LPPCN周围肿瘤细胞1~3层中的表达强于其外围肿瘤细胞(P<0.01),在外围4~6层与7~9层之间的表达差异无统计学意义(P>0.05)(图4)。而Flt-1在LPPCN周围肿瘤细胞1~3层、4~6层及7~9层之间的表达差异均无统计学意义(图5),VEGF、Flt-1、Flk-1在VM周围的表达差异均无统计学意义(P>0.05)(图6~8),见表1。

图3 VEGF免疫组化染色(×200)Fig 3 Immunohistochemical

图4 Flk-1免疫组化染色(×200)Fig 4 Immunohistochemical staining of Flk-1(×200)
2.3 LPPCN周边VEGF(+)组与VEGF(-)组的生存分析 在LPPCN周边,VEGF(+)组共27例,VEGF(-)组共11例(图9),LPPCN周边VEGF(+)组的生存时间比LPPCN周边VEGF(-)组短,其生存曲线的差异有统计学意义(χ2=4.083,P=0.037)。生存曲线图见图10。

图5 Flt-1免疫组化染色(×200)Fig 5 Immunohistochemical staining of Flt-1(×200)

图6 VEGF免疫组化染色(×400)Fig 6 Immunohistochemical stainingofVEGF(×400)
图7 Flt-1免疫组化染色(×400)Fig 7 Immunohistochemical staining of Flt-1(x400)
图8 Flk-1免疫组化染色(×400)Fig 8 Immunohistochemical staining of Flk-1(×400)

图9 VEGF免疫组化染色(×200)Fig 9 Immunohistochemical staining of VEGF(×200)

图10 生存曲线图Fig 10 Kaplan-Meier survive curves plot
2.4 LPPCN周边VEGF(+)组与VEGF(-)组中VM的情况 在27例LPPCN周边VEGF(+)组中,VM(+)组有23例,在11例LPPCN周边VEGF(-)组中,VM(+)组有5例,LPPCN周边VEGF(+)组中VM的阳性率高于LPPCN周边VEGF(-)组中VM的阳性率,差异有统计学意义(P=0.049),见表2。
表1 VEGF、Flt-1、Flk-1在黑色素瘤LPPCN及VM周围的表达(±s)Tab 1 Expression of VEGF,Flt-1and Flk-1surrounding LPPCN and VM in melanoma(±s)
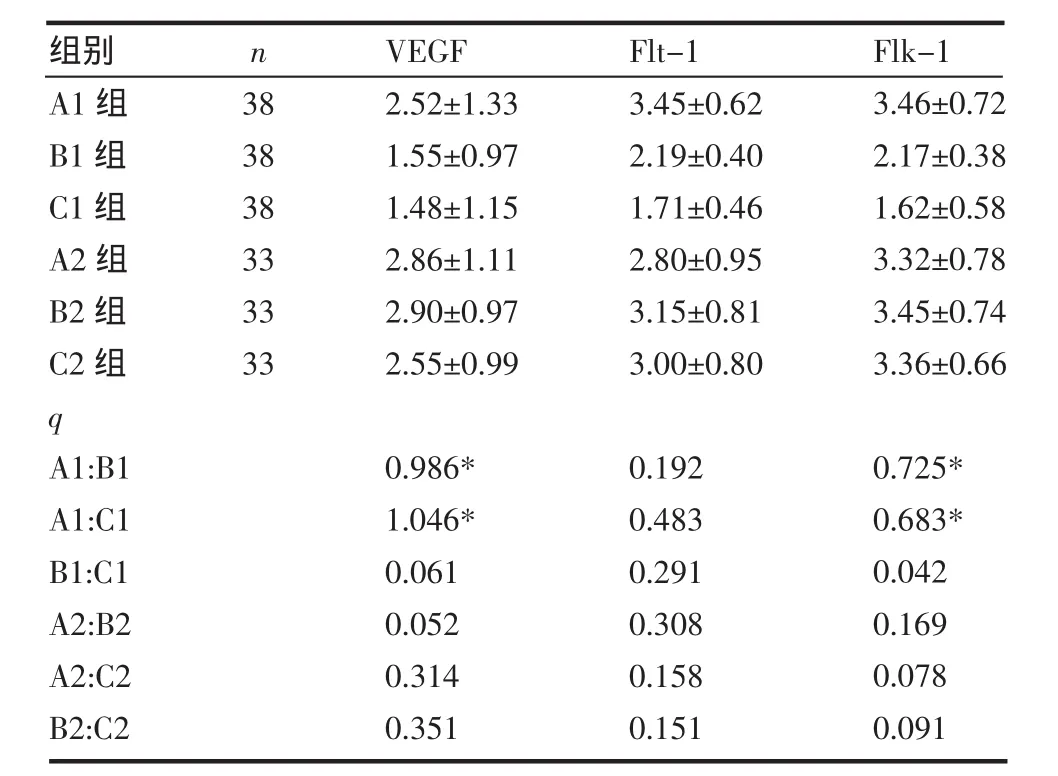
表1 VEGF、Flt-1、Flk-1在黑色素瘤LPPCN及VM周围的表达(±s)Tab 1 Expression of VEGF,Flt-1and Flk-1surrounding LPPCN and VM in melanoma(±s)
A1组:LPPCN周边第1~3层肿瘤细胞染色指数;B1组:LPPCN周边第4~6层肿瘤细胞染色指数;C1组:LPPCN周边第7~9层肿瘤细胞染色指数;A2组:VM周边第1~3层肿瘤细胞染色指数;B2组:VM周边第4~6层肿瘤细胞染色指数;C2组: VM周边第7~9层肿瘤细胞染色指数;*P<0.05
组别A1组B1组C1组A2组B2组C2组q A1:B1A1:C1B1:C1A2:B2A2:C2B2:C2n 383838333333VEGF 2.52±1.331.55±0.971.48±1.152.86±1.112.90±0.972.55±0.99Flt-13.45±0.622.19±0.401.71±0.462.80±0.953.15±0.813.00±0.80Flk-13.46±0.722.17±0.381.62±0.583.32±0.783.45±0.743.36±0.660.986* 1.046* 0.0610.0520.3140.3510.1920.4830.2910.3080.1580.1510.725* 0.683* 0.0420.1690.0780.091
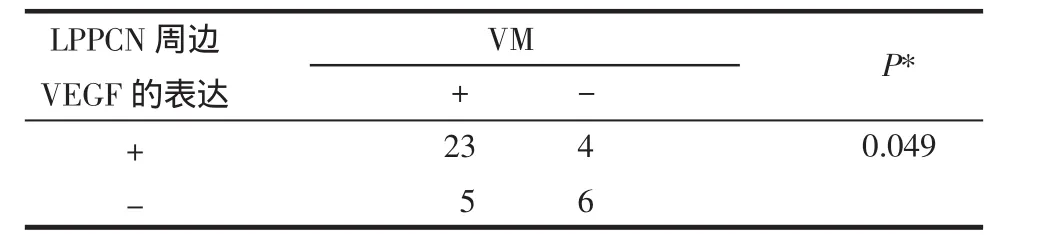
表2 LPPCN周边VEGF表达与VM阳性率(%)的关系Tab 2 Relationship between the expression of VEGF surrounding LPPCN and the VM positive rate(%)
3 讨论
1999年,Maniotis等[3]在研究高度恶性黑色素瘤时揭示了一种新的血管生成方式,即VM。VM是恶性黑色素瘤细胞通过自身变形和与细胞外基质相互作用,模拟血管壁结构形成的可输送血液的管道系统。其特点是血管壁的内侧全部由肿瘤细胞衬覆,而非内皮细胞,并且此通道中存在红细胞。研究表明,有多种细胞因子影响和参与了其形成过程。如同血管生成过程中,血管内皮细胞迁移、增殖,在肿瘤组织中出芽,最终形成管道网络[4]的过程一样,VM形成中也存在管道的空间构筑过程。那么,实体瘤组织中,细胞排列紧密,间质液体压力极高,肿瘤细胞是如何获得形成VM所需的空间呢?LPPCN现象也许能够在一定程度上解释这个谜团。
LPPCN是黑色素瘤组织中存在的一种特殊形式的程序性死亡现象,在HE染色切片中可观察到大片实体的肿瘤组织内出现条带样(线形分布)的一群胞核深染、胞浆浓缩且细胞间彼此分离的肿瘤细胞,此即是LPPCN。本课题组前期实验在人体黑色素瘤和小鼠黑色素瘤移植瘤中均观察到当肿瘤的血管生长无法满足肿瘤的快速生长时,在肿瘤的中央部缺少血管的区域,由于严重缺氧并在高压环境下肿瘤细胞便可能启动一系列机制形成LPPCN[5]。随后这些条带结构内的肿瘤细胞发生核碎裂、溶解,细胞解体,在肿瘤组织内出现了一些分布呈网络状的线形空间结构,并出现与内皮依赖性血管相通的现象,有时在一个内皮依赖性血管的周围可见数个呈网络状分布的线形结构。LPPCN和VM的空间分布呈网络状,类似于内皮依赖性血管的空间分布。因此,推测这些发生LPPCN的肿瘤细胞死亡后残留的空间可以作为VM形成的空间结构基础。而LPPCN周边的肿瘤细胞与VM形成之间有什么关系呢?针对这一问题,本实验研究了LPPCN周边肿瘤细胞VEGF及其受体的表达和VM形成的关系。
众所周知,缺氧是实体瘤物理微环境的基本特征之一。恶性黑色素瘤进展区域乏氧,导致转录因子HIF-1α的表达增高,而HIF-1α刺激肿瘤细胞和宿主细胞合成分泌多种促血管生成因子,尤其是具有重要作用的VEGF。HIF-1α的功能不仅使其下游因子VEGF的mRNA稳定性增加,而且能增加VEGF的转录活性[6]。本实验研究发现,在LPPCN周边的肿瘤细胞高表达VEGF,明显强于远离LPPCN的肿瘤细胞,这可能是由于在LPPCN周边的肿瘤细胞处于相对较严重的缺氧状态,而远离LPPCN的肿瘤细胞缺氧较轻,这种由重到轻的缺氧梯度导致了VEGF表达的高低不同。而且已有研究表明,只有VEGF表达高的细胞才有形成VM的潜能[7]。同时,本实验对于VEGFR2(Flk-1)的研究结果显示,在LPPCN周边的肿瘤细胞Flk-1的表达强于远离LPPCN的肿瘤细胞,这可能是VEGF发挥刺激内皮细胞的增殖、增加血管的通透性和新血管的生成作用主要是通过结合和激活Flk-1来实现的。可见低氧不仅可以促进肿瘤细胞VEGF的高表达,而且可以通过诱导VEGF受体表达上调来调节VEGF的功能。而对于VEGFR1(Flt-1),其与VEGF结合后所起的生理作用尚不明确,Flt-1可能是作为VEGF促血管生成的反向调节因子发挥作用[8]。在本实验中也观察到Flt-1在LPPCN周围的表达无差异。
相对于LPPCN周围肿瘤细胞VEGF、Flt-1及Flk-1的表达情况,在VM周围三者的表达没有差异,这可能是因为VM有助于肿瘤细胞获得足量的血液供应,氧气充足,刺激肿瘤细胞表达VEGF及其受体的主要诱因缺氧减弱,因此肿瘤细胞表达VEGF降低。Sun等[9]的研究也表明,没有缺氧的刺激,肿瘤细胞会下调对VEGF的表达。本实验结果提示,LPPCN与VM周围肿瘤细胞的促血管生成因子的表达差异或许可以间接地说明VEGF主要在VM形成的早期起作用,当VM形成后,有充足的血液供应使缺氧减轻就会使VEGF的表达下调。
进一步研究还发现,LPPCN周边VEGF阳性组的VM阳性率高于LPPCN周边VEGF阴性组的VM阳性率,且LPPCN周边VEGF阳性组患者生存时间比LPPCN周边VEGF阴性组患者短。推测在LPPCN残留的空间结构基础上,其周边高表达VEGF的肿瘤细胞有更多机会形成VM。由于VM无血管内皮细胞衬覆,肿瘤细胞直接与血液接触,更易发生转移,成为造成患者不良预后的一个影响因素。
综上所述,在黑色素瘤组织中VM形成早期,VEGF及其受体Flk-1可能起一定的作用,且其高表达是患者不良临床预后的一个影响因素,但不一定是独立的关键影响因素。VM可能是由LPPCN周边的肿瘤细胞通过一定的机制转变而形成的。但是,VEGF及其受体具体是通过何种途径影响VM的形成?它们与其他细胞因子在形成VM过程中的相互作用关系如何?通过抑制VEGF的表达是否能减少VM的形成,进而达到治疗黑色素瘤的目的?这些问题需要进一步研究VEGF及其受体在VM形成过程中发挥的具体作用及其详尽机制来解决。
[1] Seftor EA,Meltzer PS,Kirschmann DA,et al.Molecular determi nants of human uveal melanoma invasion and metastasis[J].Clin Exp Metastasis,2002,19(3):233
[2] Zhang S,Guo H,Zhang D,et al.Microcirculation patterns in different stages of melanoma growth[J].Oncol Rep,2006,15(1):15
[3] Maniotis AJ,Folberg R,Hess AR,et al.Vascular channel formation by human melanoma cells in vivo:vasculogenic mimicry[J].Am J Pathol,1999,155(3):739
[4] Carmeliet P.Mechanisms of angiogenesis and arteriogenesis[J].Nat Med,2000,6(4):389
[5] Zhang S,Li M,Zhang D,et al.Hypoxia influences linearly patterned programmed cell necrosis and tumor blood supply patterns formation in melanoma[J].Lab Invest,2009,89(5):575
[6] Van der Sehaft DW,Hillen F,Pauwels P,et a1.Tumor cell plasticity in Ewing sarcoma,an alternative circulatory system stimulated by hypoxia[J].Cancer Res,2005,65(24):11520
[7] 朱芳,李振宇,任精华,等.VEGF与肿瘤血管生成拟态关系的研究[J].临床肿瘤学杂志,2009,14(1):20
[8] Zachary I,Gliki G.Signaling transduction mechanisms mediating biologicalactionsofthevascular endothelial growth factor family[J].Cardiovasc Res,2001,49(3):568
[9] Sun B,Zhang S,Zhao X,et al.Pilot study of molecular mechanism on vasculogenic mimicry in bi-directional differentiated malignant tumors[J].Clin Oncol,2005,4(1):50

