糖尿病合并脑梗死血糖水平与梗死灶部位、体积的相关性分析
杨慧茹,张雪君,张淑萍,郭 丽,蔡建平
(1.天津医科大学医学影像学院,天津300203;2.天津市津南区咸水沽医院放射科,天津300350)
糖尿病(DM)作为脑梗死的一种独立危险因素,已得到大家的公认,临床研究显示,糖尿病患者合并脑梗死的危险性是非糖尿病患者的2~4倍[1],文献报道糖尿病并发脑梗死的发生率为16.4%~18.6%[2],且预后不良[3]。与非糖尿病性脑梗死相比,糖尿病性脑梗死在发病年龄、性别、既往一过性脑缺血缺氧发作(TIA)等方面无差别,而在梗死类型和部位上具有特点,对于梗死灶大小,以往的研究多关注梗死面积,即在一个层面上衡量梗死灶的前后径及左右径,而忽略了上下径对梗死体积的影响。本研究在探讨梗死面积的基础上,重点观察梗死灶的体积,旨在揭示糖尿病合并脑梗死血糖水平与梗死灶体积的关系。
1 资料与方法
1.1 对象与分组 脑梗死患者220例,均系天津市津南区咸水沽医院2009年10月~2010年6月的住院患者,发病<120h,符合第四届全国脑血管病会议制定的脑梗死诊断标准,均经头颅CT或MRI检查确诊为脑梗死。
分组情况:(1)糖尿病合并脑梗死(DACI)组:120例,男67例,女53例,年龄45~83岁,平均(63± 17)岁,发病前已确诊为糖尿病,均符合WHO1999年推荐的DM诊断标准。入院时血糖4.6~17.48mmol/L,平均(8.00±7.78)mmol/L。(2)非糖尿病脑梗死(NDACI)组:100例,为同期住院患者,男63例,女37例,年龄35~84岁,平均(71±25)岁,入院前无糖尿病史,如入院后空腹血糖<5.9mmol/L方可入选。入院时空腹血糖4.03~5.85mmol/L,平均(4.91±1.58)mmol/L。
DACI组患者根据入院时血糖水平分为:A组:38例,空腹血糖<8.0mmol/L;B组:45例,8.0mmol/ L≤空腹血糖≤10.0mmol/L;C组:37例,空腹血糖> 10.0mmol/L。DACI组与NDACI组在年龄等方面的构成无统计学差异,而血糖水平的构成存在统计学差异。
1.2 方法
1.2.1 血糖的测定 所有患者均于入院时急诊检测空腹血糖(静脉血浆血糖,氧化酶法,正常值3.9~5.9mmol/L,>5.9mmol/L为血糖升高),入院后24h内测定清晨空腹血糖、餐后2h血糖及糖化血红蛋白。1.2.2影像学检查 所有患者采用GE lightspeed ultra 8层螺旋CT扫描仪,行常规头颅平扫,范围自听眶线至颅顶,层厚10mm,层距10mm。检查时间为发病24h之内,未发现责任病灶者24h后复查头颅CT或MRI。图像分析采用24h后图像,以避免半暗带对梗死体积的影响。MRI检查采用GE Signa 0.2T磁共振扫描仪,行常规MR扫描,用标准头线圈,扫描参数:轴位T1WI,TR 1738ms,TE 33ms, FOV24cm×18cm,矩阵256×160;层厚8mm,层间距2mm。轴位T2WI,TR 4600ms,TE 87.5ms,FOV 24cm×18cm,矩阵256×192;层厚8mm,层间距2mm。轴位SE-EPI,TR 10000ms,TE 158ms,FOV 30cm×30cm,矩阵64×96;层厚10mm,层间距0。矢状位T1WI,TR 1743ms,TE 45ms,FOV 24cm× 24cm,矩阵256×160;层厚6mm,层间距2mm。冠状位T2WI,TR 4700ms,TE 98ms,FOV 24cm×18cm,矩阵256×192;层厚8mm,层间距2mm。
1.2.3 梗死灶体积测量 测量在相关的CT及MRI图像上进行,其中MRI各序列的图像中,由于SEEPI序列图像的变形和失真,不能作为理想的测量对象,因此,在本研究中,选择轴位T2WI序列作为研究的重点,其他序列作为参考。
由于手工测量具有一定的主观性,结果的可重复性较差,测量精度不高,为了更加准确地对治疗效果进行评价,本文利用交互式图像分割算法中的live wire算法对梗死部位的体积进行测量,对含有梗死区域的图像进行Live-Wire算法分割,在用户指定一个边界点后,动态规划将找到这个点到图像中其他点的最短路径。这样就分割出有效的梗死区域的边界,从而获得梗死区域的面积。
首先利用live wire算法对每个断面进行分割获得各个断层图像的边缘,计算当前截面的面积,利用层厚来获得梗死部分的体积,利用体积计算公式得到梗死灶体积:

根据头部CT或MRI检查脑梗死灶体积≤2000mm3为小梗死灶,>2000mm3为大梗死灶,累及两个脑叶以上的大梗死灶为大面(体)积脑梗死。
1.3 统计学处理 采用SPSS 11.5软件包,所有数据均采用±s表示,4组间的均数比较采用方差分析,率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 DACI组与NDACI组患者脑梗死部位的比较 DACI组前循环支配区梗死及后循环支配区梗死的发生率分别为42%(111/264)和58%(153/264),NDACI组前循环支配区梗死及后循环支配区梗死的发生率分别为63%(96/153)和37%(57/153),两组梗死部位的比较有统计学意义(χ2=5.88,P<0.05);DACI A、B、C 3组梗死部位的比较无统计学意义,(χ2=9.27,P>0.05),见表1。
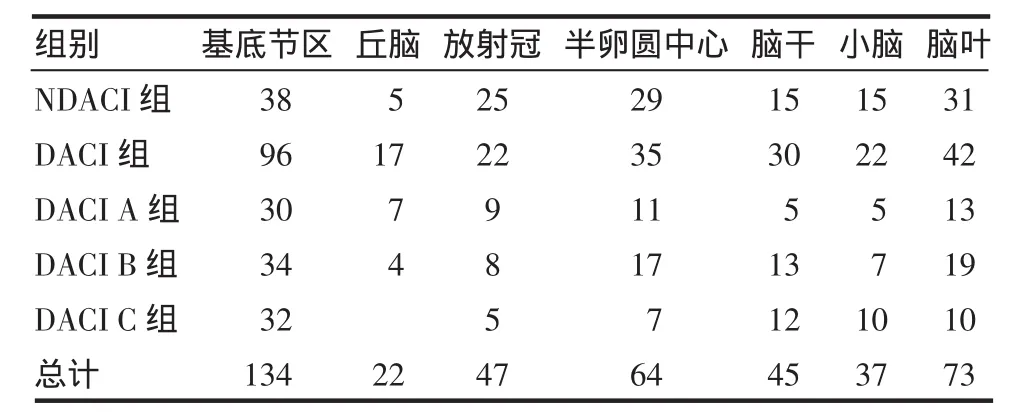
表1 DACI组与NDACI组患者脑梗死部位的比较Tab 1 Comparison of the location of infarctions among DACI group and NDACI groups
2.2 DACI组与NDACI组脑梗死体积的比较 DACI组共检出梗死灶264处,其中大梗死灶109处(41.9%),小梗死灶155(58.1%)处,大面(体)积脑梗死20(16.7%)处,平均体积(6786.30±2201.88)mm3[A组(4570.99±3971.51)mm3,B组(8120.77±5661.32)mm3,C组(26237.54±5111.59)mm3];NDACI组共检出梗死灶153处,大梗死灶38(24.8%)处,小梗死灶115(75.2%)处,大面(体)积脑梗死6(3.9%)处,平均体积(2095.67±1715.20)mm3,DACI组梗死灶体积大于NDACI组患者梗死灶体积,两组间存在显著性差异。且DACI组中大梗死发生率明显高于NDACI组,两组间存在显著性差异,P<0.05。NDACI组及DACI各组间梗死灶的体积均数有显著差异(F=4.32,P<0.05),血糖水平与梗死灶的体积成正相关(图1)。

图1 NDACI组及DACI各组梗死灶的体积Fig 1 Volume of the infarctions of DACI group and NDACI groups
3 讨论
3.1 梗死体积的测量 脑梗死CT及磁共振图像显示的梗死灶大多边界模糊不清,密度及信号不均,如何界定梗死灶的边缘成为困扰影像医师定量计算梗死灶大小的一个难题。图像分割是指把感兴趣的目标从背景中分离出来,是图像处理到图像分析过程中至关重要的一步。Mortensen等[4]在文献中对live wire算法作了详细的介绍。它的算法的基本思想如下:把图像当作一个连通图,图像中的像素当作图中的节点,相邻像素间的边当作连接节点的边。在边上定义一个代价函数,然后通过图搜索来找物体的边界,把用户指定的物体边界上的两点之间的最短路径当作物体的边界。一般用Dijkstra算法来找连通图中两点之间的最短路径。live wire算法可以兼顾良好的边界定位和弱边界检测等性能指标,因此分割的病灶边缘与影像医师所界定的梗死范围有着较高的一致性。以观察两组脑梗死之间梗死灶体积的差异。
由于图像的最短路径能准确地表示目标的边缘,显示强边缘特征的像素有较低的局部代价。本算法可以兼顾良好的边界定位和弱边界检测等性能指标,将梗死灶从图像中分割出来,利用断层图像求脑梗死区域体积的方法,并用病人数据进行了验证,与Pullitono[5]提出的脑梗死体积计算公式(脑梗死体积=长×宽×CT扫描层面数×层厚÷2)所得结果基本一致,与之相比,因为本方法测量每一层面病灶的具体面积,因此得出的体积更加精确,以揭示糖尿病合并脑梗死急性期血糖水平与梗死灶体积的关系。
3.2 糖尿病并发脑梗死的病理基础 糖尿病能导致动脉粥样硬化、微血管病变及血液高凝状态,是脑血管病的独立危险因素之一。糖尿病易合并脂质代谢紊乱及高血压,动脉粥样硬化是引起脑梗死的重要原因,文献报道糖尿病并发动脉粥样硬化的发生率为48%[6],糖尿病患者易合并脑梗死,与其糖代谢异常及血液流变学紊乱密切相关。血糖升高时,血管内皮细胞功能受损可增加血管活性物质如内皮素、前列腺素的释放,减少扩血管活性物质的释放[7],表达更多的粘附因子,而且此时糖易与体内某些蛋白发生非酶促反应,生成糖基化合物,增加局部血小板、白细胞在血管壁的附着,并合成花生四烯酸、血小板凝栓质2等活性物质,恶化局部区域的供血及供氧,形成血栓。另一方面,高血糖增加脑损伤的可能机制包括:细胞能量衰竭、乳酸酸中毒、谷氨酸盐的释放、细胞内钙的蓄积、脂质过氧化作用、一氧化氮的神经毒性、中性粒细胞浸润、炎症反应的作用、糖皮质激素的释放以及近年来提出的O-联糖基化的增加[8]、脑血管通透性基质金属蛋白酶(MMP)-9蛋白水平和总的MMP活性增加[9]等,这些因素的共同作用破坏了细胞的基本结构,导致细胞死亡,使血管通透性加剧,再灌注损伤明显,加重脑组织的损害,形成缺血半暗带。以上这些既是高血糖导致脑梗死的原因,又是高血糖促使脑组织神经损伤进展恶化的结果。与非糖尿病性脑梗死比较,糖尿病性脑梗死的梗死类型及影像学特点有着明显的不同。
3.3 糖尿病与脑梗死类型的相互关系 本组资料表明:DACI组以多发脑梗死为多,单一病灶较少。糖尿病不仅有大中小动脉粥样硬化,而且微血管有基底膜和退行性改变。2型糖尿病患者主要特征为出现胰岛素抵抗,胰岛素抵抗是引起脂代谢异常的原发因素,导致脑微血管内皮细胞受损,单核细胞和血小板粘附,并促进细胞内胆固醇合成,同时使低密度脂蛋白粘附在细胞壁上,血液高凝促进血栓形成,形成动脉因子的作用,致循环障碍,形成微小血栓,多条小血管出现梗死,导致多发性脑梗死的发生。
3.4 糖尿病与脑梗死部位的相互关系 本组资料表明:DACI组以多发脑梗死和后循环梗死为多,而NDACI组多发生完全前循环梗死或部分前循环梗死。后循环缺血是常见的缺血性脑血管病,约占缺血性脑卒中的20%;好发于双侧基底节区、脑干及丘脑等部位,椎基底动脉系统受累占39%,且因基底动脉系统的硬化程度高于颈内动脉系统,因此梗死部位以后循环梗死多见。
3.5 糖尿病与脑梗死体积的相互关系 本组病例显示糖尿病梗死组的大病灶多(41.9%),累及多个脑叶的大体积脑梗死DACI组明显多于NDACI组,达16.7%。与以往一些学者报道的糖尿病脑梗死以腔隙性和小片梗死为主不一致。这可能与糖尿病引起的大中动脉粥样硬化有关。以往学者研究大多认为血糖水平对梗死灶大小有一定影响,如Li等[10]学者的动物实验显示,糖尿病能增加大鼠脑梗死的体积。Bomont[11]用大鼠研究MCAO后48h STZ引起的糖尿病对梗死体积的影响,发现糖尿病使梗死体积增大68%。而Baird等[12]用皮下血糖感应器对脑梗死患者进行长达72h的连续监测,发现相同的组中高血糖患者梗死面积扩大更多,而且高血糖是和梗死体积的改变是独立相关的。这就表明高血糖不仅可以影响急性阶段梗死组织的初始体积,而且还是人类早期梗死进展的真正的决定因素之一。Zhu等[13]的实验证明:高血糖可以通过下调VEGF(血管内皮生长因子)的性质并且同时上调血管他汀的反向作用从而减弱新生血管的形成,故在缺血损伤后糖尿病组的血管发生明显不足。但也有研究显示糖尿病GK大鼠永久性MCAO后梗死体积减小[9]。
UKPDS[14]证实:新诊断的2型糖尿病患者在发病9年时,大血管病变与微血管病变发生率分别为20%和9%。大血管病变占所有糖尿病患者死亡原因的59%,因此,我们推测颈动脉粥样硬化附壁血栓形成脱落,动脉-动脉血栓栓塞可能是糖尿病合并大面积脑梗死的主要原因,王燕宏等[15]研究检测结果证实糖尿病患者容易出现颈动脉内-中膜厚度增厚,伴脑梗死和不伴脑梗死的糖尿病患者之间的颈动脉内-中膜厚度也有明显差异。本组病例也发现部分糖尿病病人中合并有房颤,因此心脏-动脉血栓栓塞也是糖尿病合并大面积脑梗死的另一个不可忽视的因素。
在小梗死灶中,腔隙性脑梗死是糖尿病患者的多见类型。这是因为供应大脑深部白质及脑干的深穿支小动脉为终末动脉缺少侧支循环,一旦发生血管病变或血栓,极易造成供血区的梗死,因此,腔隙性脑梗死多见,糖尿病患者发生于皮层下白质的腔隙性梗死多位于基底节区,本组病例DACI组基底节区梗死灶96处,占所有梗死灶的40%,结论与文献报道一致。
缺血性脑血管病的发病率逐年升高。本研究表明,脑梗死与血糖水平异常密切相关,提示我们在临床工作中应加强对急性脑梗死患者血糖的检测,早期干预,控制血糖、血压与血脂紊乱,积极治疗糖尿病,有利于降低缺血性脑卒中的发生率以及改善脑梗死患者的预后及生存质量。
[1] 任立权,王丹.急性脑血管病与血糖变化的相关性研究[J].现代诊断与治疗,2002,13(3):210
[2] 黄如训,苏镇培.脑卒中[M].北京:人民卫生出版社,2001:230-230
[3] Heuschmann PU,Kolominsky-Rabas PL,Misselwitz B,et al. Predictors of in-hospital mortality and attributable risks of death after ischemic stroke:the German Stroke Registers Study Group[J]. Arch Intern Med,2004,164(10):1761
[4] Mortensen N,Barrett A.Interactive segmentation with intelligent scissors[J].Graphical Models Image Processing,1998,60(5):349
[5] Pullitono P.Small deed infarcts diagnosed on compured tomograph [J].Nearology,1980,30(10):1890
[6] 史洪润,杨玉庆,孟昭水,等.高血糖时红细胞聚集与急性脑梗塞关系的研究[J].中风与神经疾病杂志,1999,16(3):159
[7] 赵任亮,王春霞.急性脑梗死患者血糖增高的机理探讨及临床意义[J].临床医学,1997,17(5):32
[8] Federici M,Menghini R,Mauriello A,et al.Insulin-dependent activation of endothelial nitric oxide synthase is impaired by O-linked glycosylation modification of signaling proteins in human coronary endothelial cells[J].Circulation,2002,106(6):466
[9] Li W,Prakash R,Kelly-Cobbs AI,et al.Adaptive cerebral neovascularization in a model of type 2diabetes:relevance to focal cerebral ischemia[J].Diabets,2010,59(1):228
[10]Li PA,Shuaib A,Miyashita H,et a1.Hyperglycemia enhances extracellular glutamate accumulation in rats SU bjected to forebrain eschemia[J].Stroke,2000,31(1):183
[11] Bomont L,Mackenzie ET.Neuroprotection after focal cerebral ischaemia in hyperglycaemic and diabetic rats[J].Neurosci Lett, 1995,197(1):53
[12]Baird TA,Parsons MW,Phanh T,et al.Persistent poststroke hyperglycemia is independently associated with infarct expansion and worse clinical outcome[J].Stroke,2003,34(12):2208
[13] Zhu M,Bi X,Jia Q.The possible mechanism for impaired angiogenesis after transient focal ischemia in type 2diabetic GK rats:Different expressions of angiostatin and vascular endothelial growth factor[J].Biomed Pharmacother,2010,64(3):208
[14]UKPDS Group.UK prospective diabetes study 17.A nine-year update of a randomized,controlled trial on the effect of improved metabolic control on complications in non-insulin-depengent diabetes mellitus[J].Ann Intern Med,1996,124(1):136
[15]王燕宏,魏利华,庞晋萍,等.2型糖尿病脑梗死患者颈动脉内-中膜厚度与高血压和血脂异常的关系[J].中国综合临床,2007,23(3)157

