茶树脱水素基因dhn2原核表达条件优化
房超,李叶云,常欣,丁菲,江昌俊
(安徽农业大学茶叶生物化学与生物技术教育部重点实验室,安徽合肥230036)
茶树脱水素基因dhn2原核表达条件优化
房超,李叶云,常欣,丁菲,江昌俊*
(安徽农业大学茶叶生物化学与生物技术教育部重点实验室,安徽合肥230036)
为了提高可溶性脱水素dhn2重组蛋白在大肠杆菌的表达量,研究了不同诱导条件对其表达的影响,包括诱导时间,诱导温度,IPTG浓度和初始诱导浓度。结果表明:重组表达载体pEASY-E1-dhn2在大肠杆菌中最佳诱导时间为4h,最佳诱导温度为30℃,最佳IPTG诱导浓度为0.8mmol/L,最佳诱导初始浓度为OD600=0.2。
茶树;脱水素;条件优化
脱水素最早发现于20世纪80年代,属于LEAD-Ⅱ家族,分子量从9到200kD不等[1]。脱水素富含甘氨酸和赖氨酸,具有很高的亲水性,能与膜脂结合阻止水分过多流失,以保护细胞免受干旱损伤[2-4]。另外,脱水素还具有蛋白保护能力,其K片段的双亲水α-螺旋结构可以稳定蛋白质结构,起到了类似于分子伴侣的作用[5]。柑橘[6]、桃树[7]和菠菜[8]等植物中发现脱水素能在低温下维持乳酸脱氢酶的活性。而茶树体内的脱水素蛋白的功能研究少见报道。
1 材料和方法
1.1.2 试剂胰蛋白胨,酵母浸出粉,氯霉素,氨苄青霉素购自索莱宝公司;异丙基-β-D-硫代半乳糖苷购自上海生工;分子质量蛋白Marker购自北京天根公司。
1.2.1 诱导时间优化
预培养菌液至OD600=0.5时,分装5mL菌液至灭菌的试管中,加入终浓度为0.1mmol/L的IPTG,37℃继续培养。在0h,2h,3h,4h,6h,8h时分别取菌液离心收集菌体,用bindingbuffer(50mmol/LPBSBuffer pH7.9,300mmol/LNacl,10mmol/L咪唑)悬浮菌体。冰水浴超声破碎(功率300W,破碎1s,间隙5s,每次循环数50,共5次)后,于4℃,8000r/min离心20min,保存上清。280nm下检测上清中蛋白总量,取含等量蛋白质的上清处理,参照分子克隆实验指南[9]方法进行SDS-PAGE电泳检测目的蛋白表达情况。
1.2.2 诱导温度优化
预培养菌液至OD600=0.5时,取5mL菌液至灭菌的试管中,加入终浓度为0.1mmol/L的IPTG后,分别转入16℃,25℃,30℃,37℃继续培养4h后,按1.2.1方法处理菌液,进行SDS-PAGE电泳检测目的蛋白表达情况。
1.2.3 IPTG浓度优化
预培养菌液至OD600=0.5时,取5mL菌液至灭菌的试管中,分别向各试管中加入终浓度为0.1mmol/L、0.2mmol/L、0.5mmol/L、0.8mmol/L、1mmol /L、2mmol/L的IPTG,37℃继续培养4h后,按1.2.1方法处理菌液,进行SDS-PAGE电泳检测目的蛋白表达情况。
1.2.4 初始菌液浓度优化
预培养菌液至OD600分别为0.2,0.3,0.5,0.9,1.0时取5mL菌液分装至试管中,加入终浓度为0.1mmol/L的IPTG,37℃继续培养4h后,按1.2.1方法处理菌液,进行SDS-PAGE电泳检测目的蛋白表达情况。
2 结果与分析
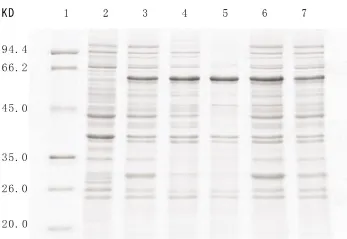
图1 不同诱导时间诱导的SDS-PAGE分析1:蛋白分子量标准;2:诱导前;3:2h;4:3h;5:4h;6:6h;7:8h

图2 不同诱导时间的生物量分析

SDS-PAGE检测发现随着诱导时间增加,重组蛋白的表达量不断升高,至4h达到最大,占上清中总蛋白的40.4%,之后表达量开始减少(图1,2)。为了使重组蛋白高效表达,选择4h为最佳的诱导时间。

SDS-PAGE检测结果如图3,随着诱导温度升高,可溶性蛋白含量增加,30℃时上清中的目的蛋白含量最高,占总蛋白的54.3%(图4),之后融合蛋白含量开始下降。所以选用30℃作为最佳诱导温度。

通过SDS-PAGE检测(图5),菌液的IPTG浓度值在0.1~0.8mmol/L时,诱导蛋白产量逐渐增大,0.8mmol/L时产量最大,占总蛋白的28%(图6),之后开始下降。确定0.8mmol/L为IPTG浓度的最适值。
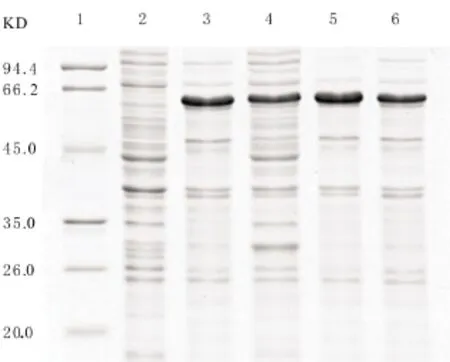
图3 不同温度诱导的SDS-PAGE分析1:蛋白分子量标准;2:诱导前;3:25℃;4:16℃;5:30℃;6:37℃
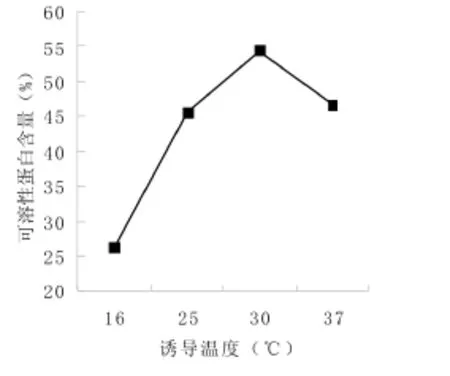
图4 不同温度诱导的生物量分析

图5 不同IPTG浓度诱导的SDS-PAGE分析1:蛋白分子量标准;2:诱导前;3:0.1mmol/L;4:0.2mmol/L;5:0.5mmol/L;6:0.8mmol/L;7:1.0mmol/L;8:2.0mmol/L

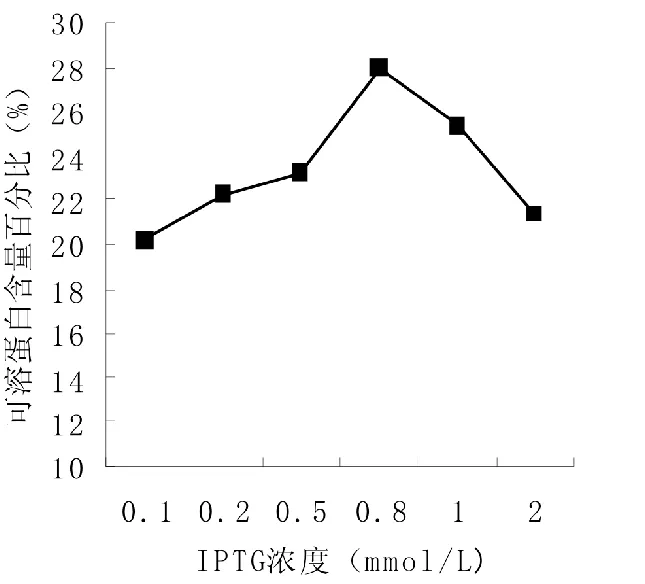
图6 不同IPTG浓度诱导的生物量分析
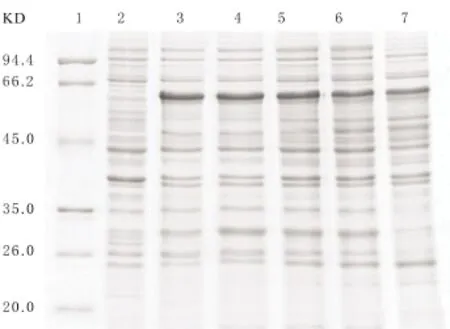
图7 不同初始菌液浓度诱导的SDS-PAGE分析1:蛋白分子量标准;2:诱导前;3:OD600=0.2;4:OD600=0.3;5:OD600=0.5;6:OD600=0.9;7:OD600=1
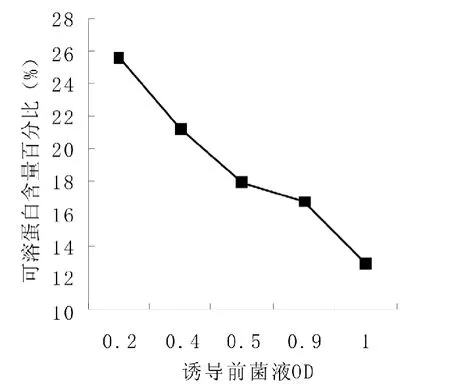
图8 不同初始菌液OD的生物量分析
如图7所示,菌液OD600=0.2时,可溶蛋白含量最高,占总蛋白的25.6%,随后菌液上清中的可溶蛋白量随着初始诱导浓度的增加而减少,到OD600=1.0时,可溶性蛋白只占总蛋白的12.9%(图8)。
3 讨论
本文研究结果表明诱导温度、时间、IPTG浓度和初始菌液浓度对可溶性脱水素dhn2重组蛋白的表达量影响很大,其中以诱导温度最为明显。可溶性脱水素融合蛋白的含量对之后的蛋白纯化影响很大。大量的可溶性蛋白可减少镍离子亲和层析时的非特异性吸附,因而蛋白纯化的效果显著提高。所以本文选用可溶性蛋白的含量百分数作为选择原核表达条件的主要参考标准。经过SDS-PAGE电泳和QuantityOne软件分析,发现表达工程菌中的可溶性脱水素蛋白含量在4h表达量最大,随后逐渐降低。可能是随着时间的延长,培养基中的营养物质逐渐减少,不能满足细菌的生长需求。诱导温度对可溶性融合蛋白的含量影响非常大,低温下菌体生长缓慢,表达的重组蛋白量降低。但温度过高,蛋白质可能会因非正常折叠而形成包涵体,致使可溶性蛋白含量相应减少。低浓度的IPTG对诱导效果影响不大,高浓度的IPTG对细胞的毒性作用使细菌生长缓慢。初始菌液浓度和可溶性脱水素蛋白含量百分比成反比,所以对高浓度的菌液进行诱导表达不利于可溶性蛋白的收集。
[1]Mundy J, Chua N H. 1988. Abscisic acid and water stress induce the expression of a novel rice gene [J]. EMBO, 1988, 7: 2279~2286..
[2]翟大勇,沈黎明.脱水蛋白研究进展[J].生物化学与生物物理进展,1998,25(2):119~122.
[3]AllagulovaCR,GimalovFR,ShakirovaFM&VakhitovVA.Theplant dehydrins:Structureandputativefunctions.Biochemistry(Moscow),2003,68 (9):945~951.
[4]CloseTJ.Dehydrins:ACommonaltyintheResponseofPlantstoDehydrationandLowTemperature[J].PhysiolPlant,1997,100:291~296.
[5]DavidsonWS,JonasA,ClaytonDF,GeorgeJM.Stabilizationofalpha-synucleinsecondarystructureuponbindingtosyntheticmembranes [J].BiolChem,1998,273:9443~9449.
[6WisniewskiME;WebbR;BalsamoR.Purification,immunolocalization, Cryoprotective,andantifreezeactivityofPCA60:Adehydrinfrompeach (Prunuspersica)[J].PhysiologiaPlantarum,1999,105(4):600~608.
[7]NevenLG,HaskellDW,HofigA,LiQB&GuyCL.Characterizationofa spinachgeneresponsivetolowtemperatureandwaterstress[J].Plant molecularbiology,1993,21(2):291~305.
[8]RinneP,KaikurantaP,VanderplasLDehydrinsincold-acclimated apicesofbirch(BetulapubescensEhrh.):production,localizationandpotentialroleinrescuingenzymefunctionduringdehydration[J].Planta,1999 ,209(4):377~388.
[9]JosephSambrook,DavidWRussell,JoeSambrook.MolecularCloning [M].ColdSpringHarborLaboratoryPress,2001.
Q344+.13
A
1006-5768(2011)04-0153-03
2011-05-23
房超(1985-),男,硕士,研究方向为茶树生物技术及种质资源。
江昌俊(1957-),男,教授,E-mail:jiangcj@ahau.edu.cn
国家自然科学基金项目(No.30871568)和安徽省自然科学基金项目(NO.090411014)。

