黄酮和黄酮醇诱导人食管鳞癌KYSE-510细胞分化和构效
王竹君,张 强,2,赵新淮,*
(1.东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;2.佳木斯大学公共卫生学院,黑龙江 佳木斯 154007)
黄酮和黄酮醇诱导人食管鳞癌KYSE-510细胞分化和构效
王竹君1,张 强1,2,赵新淮1,*
(1.东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;2.佳木斯大学公共卫生学院,黑龙江 佳木斯 154007)
在体外探讨两个黄酮和两个黄酮醇化合物对人食管鳞癌KYSE-510细胞的分化诱导作用及其构效关系。显微镜观察细胞分化形态,激光共聚焦显微镜和流式细胞仪分析分化标志物(角蛋白8)表达,RT-PCR定量端粒酶逆转录酶表达。结果表明:4个化合物均可诱导KYSE-510细胞分化,并且化合物分子中C环3′-羟基提高化合物的分化诱导活性,A环6′-羟基和B环4′-羟基可能削弱化合物的分化诱导活性。
黄酮;黄酮醇;人食管鳞癌;分化
类黄酮化合物是一类富含于植物性食物中的苯-γ-吡喃酮衍生物[1]。大量体外实验研究结果表明:类黄酮可通过多种途径发挥防癌、抑癌作用,如诱导凋亡、细胞周期停滞和分化等[2-3]。黄酮和黄酮醇是膳食中含量最高的类黄酮化合物[4-5],研究证实黄酮和黄酮醇可诱导多种癌细胞分化[6-8],但此作用的构效关系未得到系统的总结,并且黄酮和黄酮醇对食管癌细胞的分化诱导作用还未见报道。
基于目前黄酮和黄酮醇化合物抗癌活性研究现状,以及在食管癌方面的研究空白,本课题选择结构相似的两个黄酮(白杨素和黄芩黄素)和两个黄酮醇(高良姜素和山奈酚)(结构见图1),研究它们对人食管鳞癌KYSE-510细胞的分化诱导作用,揭示膳食黄酮和黄酮醇化合物对人食管癌的防治作用及分子结构-活性关系,为膳食结构的合理调整、食源性生物活性成分的定向改造提供参考。
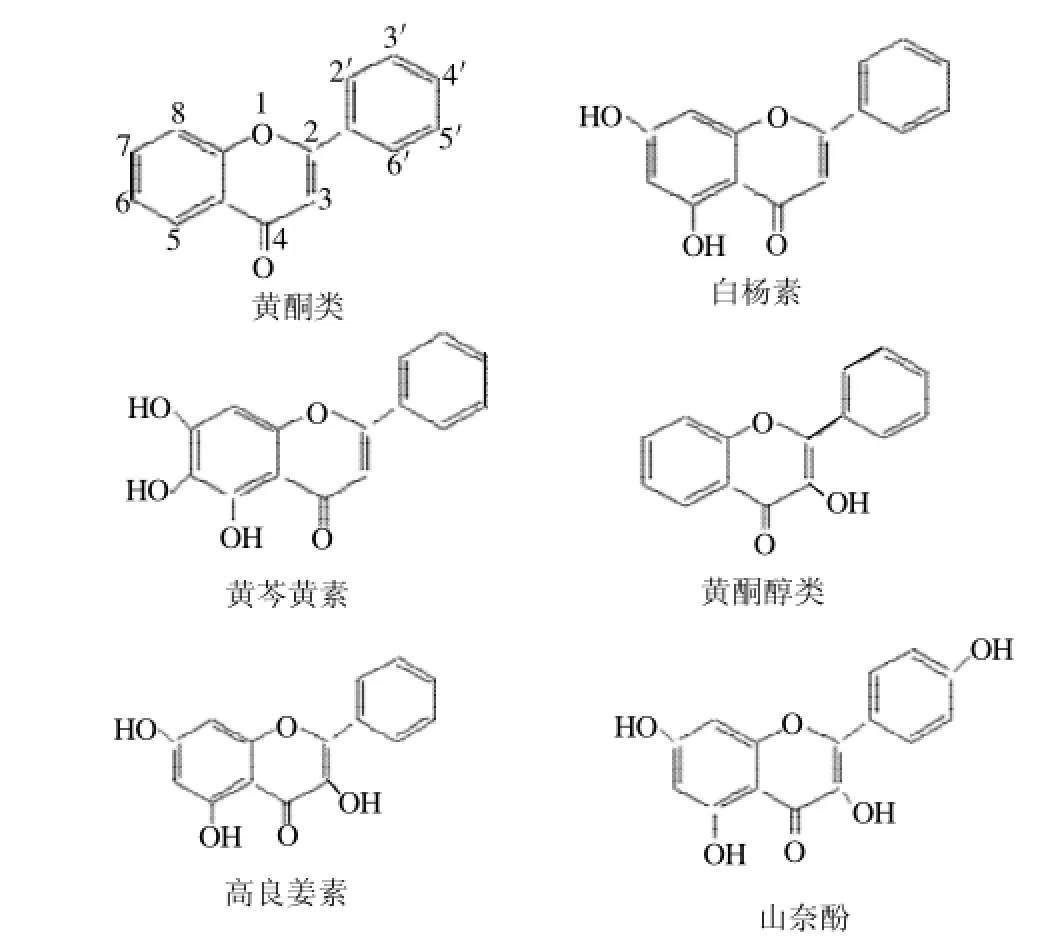
图1 两个黄酮和两个黄酮醇的化学结构Fig.1 Chemical structures of two flavones and two flavonols
1 材料与方法
1.1 材料、试剂与仪器
人食管鳞癌KYSE-510细胞购自天津市肿瘤医院。
白杨素(纯度>96%)、噻唑蓝(MTT) 美国Sigma公司;高良姜素(纯度>98%)、黄芩黄素(纯度>98%)上海友思生物技术有限公司;山奈酚(纯度>98%) 南京青泽医药科技发展有限公司;碘化丙锭(PI)、溴化乙锭(EB)、二甲基亚砜(DMSO)、牛血清白蛋白(BSA) 北京索莱宝生物科技有限公司;鼠抗人角蛋白8单克隆抗体 福州迈新生物技术开发有限公司;TRIzol试剂、RPMI1640培养液 美国Gibco公司;荧光定量PCR反应试剂盒(SYBR PrimeScriptTMRT-PCR) 大连宝生物工程有限公司;异硫氰酸荧光素(FITC)标记山羊抗小鼠IgG第二抗体 北京中杉金桥生物技术有限公司。
Heal Force/HF90 CO2培养箱 上海力申科学仪器有限公司;Mtic/AE31倒置显微镜 麦克奥迪实业集团有限公司;ABI/7500荧光定量PCR仪 美国Applied Biosystems公司;COULTER/ COULTER Epics XL流式细胞仪 美国Beckman公司;Bio-Rad/Trans-Biot SD Cell半干转印电泳槽、Bio-Rad/680酶标仪 美国Bio-Rad公司;LEICA/DFC280倒置荧光显微镜、TC SP2 AOBS激光共聚焦显微镜 德国Leica Microsystems公司。
1.2 细胞培养
人食管鳞癌KYSE-510细胞,于含10%胎牛血清、100U/mL青霉素、100mg/L链霉素的RPMI1640培养液中(37℃、5% CO2)培养。
1.3 细胞增殖抑制测定
将KYSE-510细胞接种于96孔细胞培养板中,培养24h后加入4个化合物的DMSO溶液。作用浓度分别为10、20、40、80μmol/L,作用时间分别为24、48、72h。0.1% DMSO细胞处理组设为阴性对照。作用后,每孔加入5mg/mL MTT溶液,继续培养4h,4℃、1800×g离心5min,弃上清液。每孔加入100μL DMSO,酶标仪测定A570nm值。
1.4 显微镜观察分化形态
(1)通风管道。口部的进风、排风管道穿过临空墙、密闭墙时应预埋通风穿墙短管,该处墙体开孔处的钢筋须进行加固处理;穿墙管与混凝土接触部分不得刷油漆。穿墙短管中间应设置密闭肋,密闭肋的厚度为5 mm、宽度为50 mm,该密闭肋与管材外侧应双面满焊,焊缝应严密。管道内部、外部除与混凝土接触部位外,均应刷两道防锈漆。密闭短管穿墙时,两端伸出墙面的长度应>100 mm。
接种于6孔细胞培养板中的细胞培养24h后,分别加入浓度为10、20、40、80μmol/L 4种化合物作用24h,倒置光学显微镜下观察药物作用后细胞形态学变化。
1.5 激光共聚焦显微镜观察分化标记物角蛋白8
接种于激光共聚焦专用细胞培养板中的细胞培养24h,分别加入浓度为80μmol/L的4个化合物作用24h。吸弃上清液,PBS洗涤两次,加入100μL鼠抗人角蛋白 8单克隆抗体工作液,冰上孵育30min,PBS溶液(含0.1%叠氮化钠和1% BSA)洗涤两次。加入100μL FITC标记山羊抗小鼠IgG第二抗体工作液(稀释比例为1:100),冰上孵育30min,PBS溶液(含0.1%叠氮化钠和1% BSA)洗涤两次,加入PI作用20min,激光共聚焦显微镜低温快速检测。
1.6 流式细胞术测定诱导分化率
接种于6孔细胞培养板中的细胞培养24h,分别加入浓度为10、20、40、80μmol/L的4个化合物,分别作用24、48h和72h。吸弃上清液,PBS洗涤两次,胰酶消化,终止,转入5mL EP管,4℃、1000×g离心两次,每次5min,弃上清液,加入100μL鼠抗人角蛋白 8单克隆抗体工作液,冰上孵育30min,PBS溶液(0.1%叠氮化钠,1% BSA)重悬细胞,1000×g离心两次,每次5min,加入100μL FITC标记山羊抗小鼠IgG第二抗体工作液(稀释比例为1:100),冰上孵育30min,PBS溶液(0.1%叠氮化钠、1% BSA)重悬细胞,1000×g离心两次,每次5min,弃上清液,1mL PBS溶液(0.1%叠氮化钠、1%BSA)重悬细胞,流式细胞仪分析。
1.7 荧光定量RT-PCR分析分化标志基因表达
接种于6孔细胞培养板中的细胞经4种化合物(80μmol/L)作用24h后,采用TRIzol试剂,按厂家说明提取细胞总RNA,存于-80℃。依照PCR反应试剂盒厂家说明,进行基因表达(mRNA)的荧光定量RT-PCR分析。内参基因为β-actin,基因引物序列见表1。

表1 RT-PCR分析时所使用的引物Table 1 Primers used in real-time RT-PCR
1.8 统计分析
2 结果与分析
2.1 黄酮和黄酮醇对食管癌细胞增殖的抑制作用
采用MTT法检测黄酮和黄酮醇化合物对KYSE-510细胞增殖的抑制作用,结果如图2A~D所示,所选的黄酮和黄酮醇化合物对细胞具有增殖抑制活性,并且抑制活性有剂量-活性依赖性和时间-活性依赖性。以高良姜素为例,作用时间一定(24h)时,10、20、40μmol/L和80μmol/L高良姜素各处理组的细胞数量,分别为对照组细胞数量的89.6%、68.7%、50.4%和29.5%;作用浓度一定(80μmol/L)时,高良姜素分别处理24、48h和72h,各处理组细胞数量分别为对照组细胞数量的29.5%、23.4%和10.7%。其他化合物的细胞增殖抑制活性也呈现类似规律。
所选择的黄酮和黄酮醇化合物对KYSE-510细胞增殖的抑制活性不同。图2E给出它们抑制细胞增殖的IC50值。比较看出,高良姜素的增殖抑制活性相对最强(50μmol/L),其他化合物的活性大小依次为白杨素(57μmol/L)、黄芩黄素(67μmol/L)、山奈酚(139μmol/L)。
2.2 黄酮和黄酮醇诱导细胞分化的光学显微镜观察
细胞形态学改变是细胞分化的表型特征,也是基本特征。从所选化合物诱导人食管癌KYSE-510细胞分化的光学显微镜观察图片(图3)中可看出,浓度为80μmol/L的黄酮和黄酮醇化合物对两株癌细胞均具有分化诱导作用。细胞出现扁平化,并呈现树枝状向外伸展、体积增大、细胞密度降低、核外形规整等与细胞分化相关的典型形态学特征。

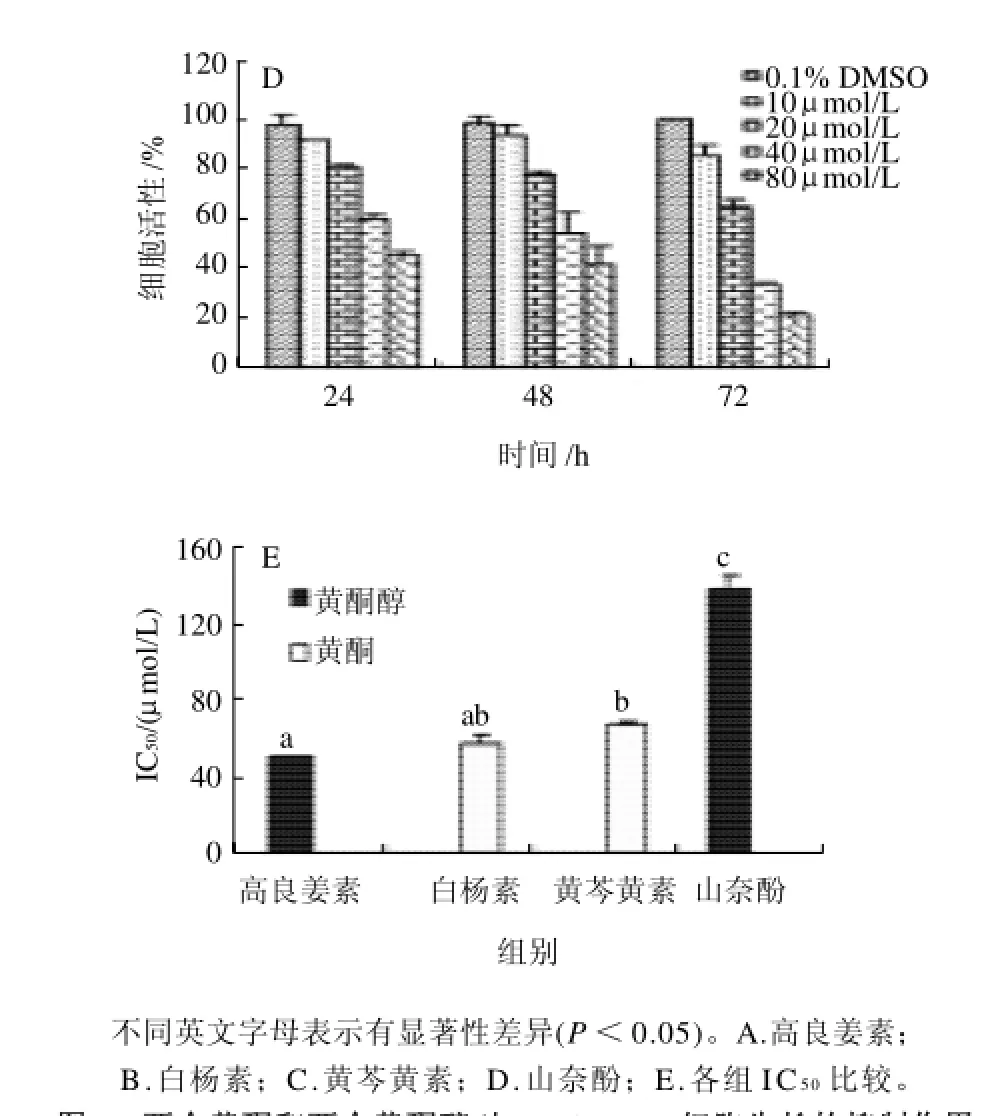
图2 两个黄酮和两个黄酮醇对KYSE-510细胞生长的抑制作用Fig.2 Inhibitory effects of two flavones and two flavonols on the proliferation of KYSE-510 cells

图3 两个黄酮和两个黄酮醇对KYSE-510细胞的分化诱导作用(×100)Fig.3 Induction effects of two flavones and two flavonols on the differentiation of KYSE-510 cells examined by phase-contrast microscopy (×100)
2.3 黄酮和黄酮醇诱导细胞分化的激光共聚焦分析结果
KYSE-510细胞经浓度为80μmol/L的黄酮或黄酮醇作用24h,角蛋白8抗体经FITC-二抗标记(经激发产生绿色荧光)和PI(标记细胞核,经激发产生红色荧光)标记后,激光共聚焦显微镜观察。与对照组(0.1% DMSO)相比,4个化合物均能诱导KYSE-510细胞的分化标记的表达(图4中箭头所指),进一步证明它们的分化诱导作用。同时,荧光强度相对大小的顺序为:高良姜素>白杨素>黄芩黄素>山奈酚。
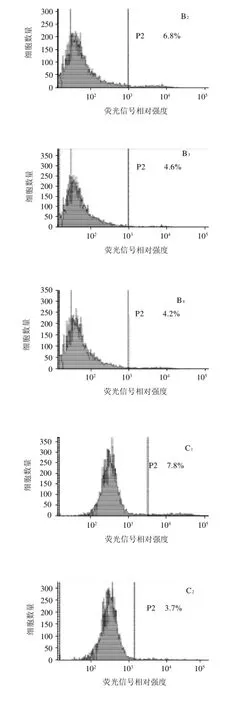

图4 激光共聚焦分析两个黄酮和两个黄酮醇对KYSE-510细胞的分化诱导作用Fig.4 Induction effects of two flavones and two flavonols on the differentiation in KYSE-510 cells examined by confocal laser scanning microscopy
2.4 黄酮和黄酮醇诱导细胞分化的流式细胞仪分析结果



图5 流式细胞术分析两个黄酮和两个黄酮醇对KYSE-510细胞的分化作用Fig.5 Differentiation of flavone and flavonoid-treated KYSE-510 cells analyzed by flow cytometry
图5显示80μmol/L黄酮和黄酮醇化合物作用KYSE-510细胞24h,分别经角蛋白8抗体和FITC-二抗作用后,流式细胞仪分析诱导细胞分化的结果。与对照组(0.1% DMSO)相比,所选择的化合物均能诱导细胞分化,并且诱导作用具有剂量-活性依赖性。以高良姜素为例(作用时间24h),对照组(0.1% DMSO)分化标记为3.5%,浓度为10、20、40μmol/L和80μmol/L高良姜素处理组,细胞的分化标记分别为4.2%、4.6%、6.8%和15.5%。其他的3个化合物的分化诱导活性也有类似规律性。80μmol/L高良姜素的分化诱导活性最强(15.5%),其他化合物的活性依次为:白杨素(7.8%)、黄芩黄素(7.5%)、山奈酚(7.0%)。
2.5 黄酮和黄酮醇诱导抑制端粒酶逆转录酶活性结果

表2 两个黄酮和两个黄酮醇对KYSE-510细胞端粒酶逆转录酶表达的影响Table 2 Effects of two flavones and two flavonols on the expression of hTERT in KYSE-510 cells analyzed by real-time RT-PCR
细胞分化过程中,端粒酶逆转录酶(hTERT)mRNA的表达将会下降[9-10]。如表2所示,黄酮和黄酮醇均能抑制KYSE-510细胞端粒酶逆转录酶的表达,其中高良姜素抑制活性最强,其他化合物的分化诱导活性由大到小依次为白杨素、黄芩黄素、山奈酚。
综上所述,所选的两个黄酮和两个黄酮醇对KYSE-510细胞具有分化诱导活性,并且活性大小顺序为高良姜素、白杨素、黄芩黄素、山奈酚,与其细胞增殖抑制活性基本一致,说明它们对癌细胞的分化诱导作用有可能是其发挥抗癌作用的重要机制之一。
2.6 黄酮和黄酮醇诱导KYSE-510细胞分化的构效关系初步分析
基于以上分化研究结果和化合物化学结构特征(图1),得出所选黄酮和黄酮醇诱导KYSE-510细胞分化的构效关系:1)化合物分子C环中有3'-羟基的高良姜素,对细胞的分化诱导作用大于C环无备3'-羟基的白杨素,表明3'-羟基对化合物的活性发挥具有促进作用;2) A环上具备6'-羟基的黄芩黄素对细胞的分化诱导活性弱于A环无6-羟基的白杨素,表明6'-羟基单独存在时可能削弱化合物的分化诱导活性;3)B环上有4′-羟基的山奈酚对细胞的分化诱导活性弱于B环无4′-羟基的白杨素,表明4′-羟基单独存在时也可能削弱化合物的分化诱导活性。
3 讨 论
癌症是危害人类健康的严重疾病,抑制癌细胞增殖是有效控制其发展的首要途径之一。MTT法分析结果表明,本研究所选的黄酮和黄酮醇化合物,能以剂量效应和时间效应依赖方式抑制食管癌KYSE-510细胞增殖。在有关其他类型癌细胞(如前髓细胞性白血病细胞、结肠癌细胞)的研究中,也发现黄酮和黄酮醇具有细胞增殖抑制活性[11-12]。这些均表明黄酮和黄酮醇所具有的抗癌活性。
黄酮和黄酮醇对人食管癌细胞的抑制作用,很可能通过多种作用机制实现,如诱导细胞周期停滞、细胞分化[1]。本研究的前期研究结果表明,6个类黄酮化合物可诱导癌细胞G2/M停滞[13-14]。类黄酮化合物不仅可诱导癌细胞周期停滞,还可以诱导癌细胞向正常细胞转变。研究表明,高良姜素可诱导人髓系白血病K562细胞分化[15]。槲皮素和山奈酚作用人白血病肥大细胞后,该细胞的分泌粒大量积累,表明细胞分化程度得到提高[16]。这些与本研究通过对比类黄酮化合物作用前后,KYSE-510细胞形态学的变化表现出分化现象一致。
大量研究表明角蛋白的表达与多种上皮细胞分化有关[17-18],为细胞分化标志物。其中,角蛋白8属Ⅱ型角蛋白,表达于正常食管上皮细胞,但在低分化食管鳞癌细胞中几乎不表达,因此被认为是食管鳞癌的分化标志物[19]。本研究采用FITC标记抗角蛋白8抗体,通过激光共聚焦显微镜观察类黄酮化合物对KYSE-510细胞表面角蛋白8表达影响,结果发现类黄酮化合物可促进KYSE-510细胞表达角蛋白8,从而进一步证实细胞形态学实验中得出的类黄酮化合物诱导KYSE-510细胞分化的观察结果。与本研究一致,Zi等[20]发现水飞蓟素作用人前列腺LNCaP细胞后,LNCaP细胞开始呈现单层、表面结合紧密等分化形态,并且细胞角蛋白8、角蛋白18和嗜铬粒蛋白A表达升高,表现出明显的细胞分化分子特征。此外,本研究采用流式细胞仪和荧光定量RT-PCR得到分析结果,再次证实了类黄酮化合物对KYSE-510细胞的分化诱导作用。
通过比较,本研究发现,4个所选类黄酮化合物对KYSE-510细胞的分化诱导活性存在差异,其中高良姜素的活性最强,其他3个化合物的活性依次为白杨素>黄芩黄素>山奈酚。这一结果表明,C环上3′-OH对分化诱导活性具有提高作用,相反A环的6′-OH、B环的4′-OH可能削弱化合物的分化诱导活性。Takahashi等[21]的研究表明,芹菜素、木犀草素以及槲皮素均能诱导急性骨髓性白血病HL-60细胞分化为粒性白细胞和单核细胞;结果显示,芹菜素及其对应的异黄酮化合物——染料木黄酮,具有相似的NBT还原能力(HL-60细胞分化标记),推测黄酮化合物分子C环中2′-OH、3′-OH不是诱导分化活性的主要作用基团,C2、C3之间的双键可能是诱导活性所必需,且C环为开环结构(如查耳酮)时,似乎降低分化诱导活性。这与本研究得出类黄酮化合物癌细胞分化诱导活性的构效关系结果不同,因此推测不同癌细胞可能对类黄酮化合物存在不同的敏感性,是造成两种构效关系差异的主要原因。今后,可针对这一问题进行深入研究。
4 结 论
本研究通过显微镜分化形态观察、分化标志物(角蛋白8)的激光共聚焦显微观察和流式细胞仪分析,以及端粒酶逆转录酶表达的检测,确认两个黄酮(白杨素和黄芩黄素)和两个黄酮醇(高良姜素和山奈酚)对人食管癌KYSE-510存在分化诱导作用,并且能以剂量效应依赖方式诱导KYSE-510细胞的分化。4个化合物的活性大小顺序为高良姜素、白杨素、黄芩黄素、山奈酚。同时,C环上3-羟基对分化诱导活性存在提高作用,而A环的6-羟基、B环的4′-羟基可能削弱化合物的分化诱导活性。本研究可以进一步确认植物中多酚类化合物的健康作用,并为类黄酮化合物有意识地改造或合成、提高其生物活性,提供一定的参考。
[1] LOPEZ-LAZARO M. Flavonoids as anticancer agents: structure-activity relationship study[J]. Curr Med Chem Anticancer Agents, 2002, 2 (6): 691-714.
[2] HOLLMAN P C, KATAN M B. Dietary flavonoids: intake, health effects and bioavailability[J]. Food Chem Toxicol, 1999, 37(9/10): 937-942.
[3] MIDDLETON E J, KANDASWAMI C, THEOHARIDES T C. The effects of plant flavonoids on mammalian cells: implications for inflammation, heart disease and cancer[J]. Pharmacol Rev, 2000, 52(4): 673-751.
[4] MANACH C, SCALBERT A, MORAND C, et al. Polyphenols: food sources and bioavailability[J]. Am J Clin Nutr, 2004, 79(5): 727-747.
[5] DAS S, ROSAZZA J P. Microbial and enzymatic transformations of flavonoids[J]. J Nat Prod, 2006, 69(3): 499-508.
[6] NAKAMURA Y, CHANG C C, MORI T, et al. Augmentation of differentiation and gap junction function by kaempferol in partially differentiated colon cancer cells[J]. Carcinogenesis, 2005, 26(3): 665-671.
[7] WENZEL U, KUNTZ S, BRENDEL M D, et al. Dietary flavone is a potent apoptosis inducer in human colon carcinoma cells[J]. Cancer Res, 2000, 60(14): 3823-3831.
[8] REN Wenying, QIAO Zhenhua, WANG Hongwei, et al. Flavonoids: promising anticancer agents[J]. Med Res Rev, 2003, 23(4): 519-534.
[9] BESTILNY L J, BROWN C B, MIURA Y, et al. Selective inhibition of telomerase activity during terminal differentiation of immortal cell lines[J]. Cancer Res, 1996, 56(16): 3796-3802.
[10] XU D, GRUBER A, BJORKHOLM M, et al. Suppression of telomerase reverse transcriptase (hTERT) expression in differentiated HL-60 cells: regulatory mechanisms[J]. Br J Cancer, 1999, 80(8): 1156-1161.
[11] KUNTZ S, WENZEL U, DANIEL H. Comparative analysis of the effects of flavonoids on proliferation, cytotoxicity, and apoptosis in human colon cancer cell lines[J]. Eur J Nutr, 1999, 38(3): 133-142.
[12] MATSUI J, KIYOKAWA N, TAKENOUCHI H, et al. Dietary bioflavonoids induce apoptosis in human leukemia cells[J]. Leuk Res, 2005, 29(5): 573-581.
[13] ZHANG Qiang, ZHAO Xinhuai, WANG Zhujun. Flavones and flavonols exert cytotoxic effects on a human oesophageal adenocarcinoma cell line (OE33) by causing G2/M arrest and inducing apoptosis[J]. Food Chem Toxicol, 2008, 46(6): 2042-2053.
[14] ZHANG Qiang, ZHAO Xinhuai, WANG Zhujun. Cytotoxicity of flavones and flavonols to a human esophageal squamous cell carcinoma cell line (KYSE-510) by induction of G2/M arrest and apoptosis[J]. Toxicology in Vitro, 2009, 23(5): 797-807.
[15] TOLOMEO M, GRIMAUDO S, DI CRISTINA A, et al. Galangin increases the cytotoxic activity of imatinib mesylate in imatinib-sensitive and imatinib-resistant Bcr-Abl expressing leukemia cells[J]. Cancer Lett, 2008, 265(2): 289-297.
[16] ALEXANDRAKIS M, SINGH L, BOUCHER W, et al. Differential effects of flavonoids on inhibition of secretion and on accumulation of secretory granules in rat basophilic leukemia cells[J]. Immunopharmacol, 1999, 21(6): 379-390.
[17] SAWAF M H, OUHAYOUM J P, SHABANA A H, et al. Cytokeratin expression in human tongue epithelium[J]. Am J Anat, 1990, 189(2): 155-166.
[18] MOLL R. Cytokeratins as markers of differentiation. Expression profiles in epithelia and epithelial tumors[J]. Veroff Pathol, 1993, 142(1): 1-197.
[19] GRACE M P, KIM K H, TRUE L D, et al. Keratin expression in normal esophageal epithelium and squamous cell carcinoma of the esophagus[J]. Cancer Res, 1985, 45(2): 841-846.
[20] ZI X, AGARWAL R. Silibinin decreases prostate-specific antigen with cell growth inhibition via G1 arrest, leading to differentiation of prostate carcinoma cells: implications for prostate cancer intervention[J]. Proc Natl Acad Sci USA, 1999, 96(13): 7490-7495.
[21] TAKAHASHI T, KOBORI M, SHINMOTO H, et al. Structure-activity relationships of flavonoids and the induction of granulocytic- or monocytic-differentiation in HL60 human myeloid leukemia cells[J]. Biosci Biotechnol Biochem, 1998, 62(11): 2199-2204.
Flavones and Flavonols-induced Differentiation of Human Esophageal Squamous Cell Carcinoma Cell Line (KYSE-510) and Possible Structure-Activity Relationship
WANG Zhu-jun1, ZHANG Qiang1,2, ZHAO Xin-huai1,*
(1. Key Laboratory of Dairy Science, Ministry of Education, Northeast Agricultural University, Harbin 150030, China;2. School of Public Health, Jiamusi University, Jiamusi 154007, China)
Induction effects of two flavones (chrysin and baicalein) and two flavonols (galangin and kaempferol) on the differentiation of human esophageal squamous cell carcinoma cell line (KYSE-510) were studied in vitro in this paper. The possible structure-activity relationships of these compounds for the induction of differentiation of KYSE-510 cells were explored. The differentiation-specific morphological change of the cells was examined by using phase-contrast microscopy, the augmentation of differentiation marker (cytokeratin 8) was evaluated by confocal laser scanning microscopy, and differentiation marker and the expression of human telomerase reverse transcriptase were quantified by flow cytometry and real-time RT-PCR, respectively. Results revealed that OH at C3′ in the ring C of these compounds might enhance the differentiation-inducing activity, while OH at C6′ in the ring A or at C4′ in ring B might decrease the differentiation-inducing activity.
flavone;flavonol;human esophageal squamous carcinoma;differentiation
Q946.83
A
1002-6630(2011)07-0305-07
2010-08-11
高等学校博士学科点专项科研基金项目(200802240002);黑龙江省教育厅科学技术研究重点项目计划(11551z018)
王竹君(1983—),女,硕士研究生,主要从事食品化学研究。E-mail:dabao8691572@163.com
*通信作者:赵新淮(1963—),男,教授,博士,主要从事食品科学研究。E-mail:zhaoxh@mail.neau.edu.cn

