聚亚甲基蓝碳纳米管修饰电极测定肝素钠
李晓霞,李延清,苗 苗,苗力孝
(延安大学a.化学与化工学院;b.生命科学学院,陕西延安716000)
0 前言
肝素钠(Hep)为葡萄胺聚糖,是蛋白多糖的一种,由葡萄糖胺磺酸、葡萄糖磺酸、艾杜糖醛等通过糖苷键连接而成的重复二糖单元组成的线性链状分子[1]。Hep是心血管和血栓病人的首选抗凝血药,对不同的疾病,Hep有不同的最适剂量,临床上需要进行监控。因此,研究Hep有一定的现实意义。目前Hep的检测方法主要分为生物方法[2]和化学方法两大类。化学方法有分光光度法[3]、荧光法[4]、光散射法[5]、高效液相色谱法[6]、毛细管电泳法[7]等。这些方法或存在灵敏度低、操作繁琐或仪器设备昂贵等缺点。电化学分析法具有灵敏度高、线性范围宽、仪器价格便宜等优点,是一种简单、快速、有效的分析方法。由于Hep是一种生物多糖,其本身没有电化学活性,因此,利用电化学分析方法研究Hep的相关研究报道相对较少[8-10]。
利用纳米粒子聚合物复合膜修饰电极测定Hep的还未见报道。文献[11]发现将亚甲基蓝(MB)电聚合在CNTs侧壁上,不仅能增加吸附强度,还能使电荷传递速率加快。因此,将MB通过电聚合的方法非共价固定在多壁碳纳米管(MWNT)修饰电极表面,制备了聚亚甲基蓝-碳纳米管修饰玻碳电极(PMB-MWNT/GCE)。实验利用电极上的PMB与溶液中Hep通过静电作用形成复合物,导致PMB的峰电流值降低,据此对Hep进行分析测定。
1 实验部分
1.1 试剂与仪器
肝素钠(Hep,150 IU/mg,上海国药集团生物化学试剂有限公司)。肝素钠注射液(12 500 IU/2 mL,1 mg=160 IU,江苏万邦制药公司)。多壁碳纳米管(MWNT,i.d 10~20 nm,纯度>95%,深圳市纳米港有限责任公司)。亚甲基蓝(MB)(上海试剂三厂)。肝素钠标准溶液(1.0 mg/mL):准确称取0.100 g Hep,加水溶解后,定容于100 mL棕色容量瓶中,存储于4℃ 冰箱内,使用时用二次蒸馏水逐级稀释。伯瑞坦-罗比森缓冲溶液 (B-R)以磷酸、乙酸、硼酸配制。实验用水均为二次蒸馏水。
电化学测量使用BAS(Epsilon)电化学工作站(美国)。超声波清洗机KQ5200B(昆山市超声仪器有限公司)。以玻碳电极(GCE,φ=2 mm)、碳纳米管修饰玻碳电极(MWNT/GCE)、聚亚甲基蓝修饰玻碳电极(PMB/GCE)或聚亚甲基蓝/碳纳米管修饰玻碳电极(PMB-MWNT/GCE)为工作电极,对电极为铂丝电极,参比电极为饱和甘汞电极(SCE Sat.KCl)。
1.2 实验方法
1.2.1 修饰电极的制备
GCE电极的预处理、MWNT的酸化处理及MWNT/GCE的制备参考文献[12]。取5μL MWNT悬浮液滴涂在处理好的GCE表面,待溶剂挥发后即MWNT/GCE。将制备好的MWNT/GCE或GCE进行电聚合[11]即获得PMB-MWNT/GCE或PMB/GCE电极。用二次蒸馏水淋洗干净,室温下保存。
1.2.2 实验过程
电化学测量使用BAS(Epsilon)电化学工作站三电极系统。采用微分脉冲伏安法(DPV)对Hep进行定量分析。DPV的条件:电位范围-0.5~0.1 V,脉冲宽度50 ms,振幅50 mV,采样宽度为200 ms,富集时间55 s。除非特别说明,所有电化学实验均在pH 4.5的B-R缓冲溶液中,室温下进行实验,以SCE参比电极电位为标准。其中空白溶液中PMB氧化电流信号为Ipo,加入Hep后PMB氧化电流信号为Ipi,计算PMB氧化峰电流差值△Ip=Ipo-Ipi。以△Ip与CHep作标准工作曲线。
2 结果与讨论
2.1 循环伏安法研究PMB与Hep相互作用
图1为PMB-MWNT/GCE在pH 4.5的B-R缓冲液及与不同浓度的Hep作用后的CV图。曲线1为PMB-MWNT/ GCE在B-R缓冲液中的CV图,在pH 4.5的B-R缓冲液中,在-0.167 V和-0.218 V出现一对氧化还原峰,为PMB的氧化还原峰。曲线2、曲线3和曲线4为PMB-MWNT/GCE与不同浓度的Hep作用后的CV图,可以看出在该扫描电位范围内,并没有出现新的氧化还原峰。PMB的氧化还原峰电流明显降低,氧化还原峰电位稍有变化。说明PMB与Hep之间存在相互作用。它们结合形成的复合物不具有电化学活性,致使电极上自由的PMB浓度减小,最终导致了氧化还原峰电流的降低。原因是Hep在水溶液中由于其酸性基团的离解而成为带多个负电荷的大阴离子,而PMB是阳离子染料,两者可以通过静电作用发生结合反应,导致了PMB峰电流降低,利用峰电流的降低可以建立电化学检测Hep的分析新方法。
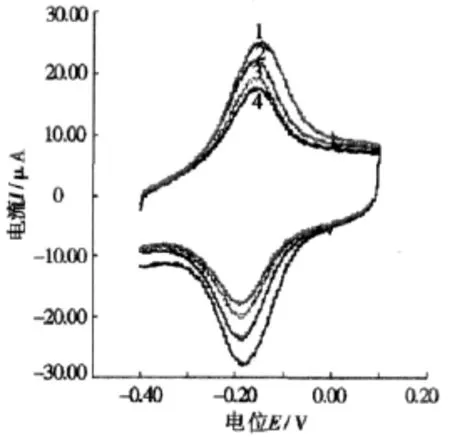
图1 PMB-MWNT/GCE在不同浓度Hep溶液中的循环伏安图
研究了不同扫描速度对PMB的电化学行为的影响,结果见图2a。从图2b可以看出:PMB的氧化峰电流(Ipa)、还原峰电流(Ipc)与扫描速度(v)在10~500 mV/s之间存在良好的线性关系,相关系数r分别为0.998 7、0.999 1。表明PMB-MWNT/GCE电极上PMB的电化学氧化反应过程是受吸附控制的电极反应过程。图2c研究了扫描速率与峰电位的关系,发现在低扫描速度时,电位不随扫速的变化而变化;随着扫速的继续增加,氧化峰电位向正方向移动,还原峰电位向负方向移动。根据Laviron方程式
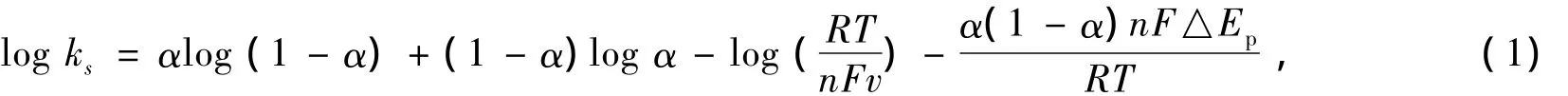
式中,α为电子转移系数,其值可由高扫描速度下Ep~log v线性关系的斜率求得[13]。求出α后,代入式(1)可求出非均相电子转移常数ks。从图2c的内图可以看出:在高扫描速度范围内,△Ep与log v呈线性关系(△Ep=0.472 log v-0.819,r=0.993 3),据此可以计算出α和ks分别为0.85和3.92 s-1。
2.2 实验条件的选择
(1)底液的选择:分别以NaAc-HAc溶液、HClO4、PBS溶液、B-R溶液为支持电解质,进行CV扫描。实验表明:PMB在B-R溶液中的峰形最好,稳定且灵敏度高,因此,以B-R缓冲液为Hep测定的底液。

图2 不同扫速下PMB的循环伏安图;扫速与峰电流、峰电位的关系
(2)pH的选择:实验中利用CV考察了在pH 2.5~8.5范围内的Hep-B-R缓冲液中PMB-MWNT/ GCE的电化学行为。结果发现:PMB的氧化峰电位Epa随着pH增大向正方向移动、还原峰电位Epc随着底液pH增大向负方向移动。峰电位与pH呈良好的线性关系,线性方程分别为Epa(V)=-0.039 6pH +0.037 8,r=0.991 6,Epc(V)=-0.039 4pH-0.008 4,r=0.992 0。表明有质子参与PMB的电化学氧化还原反应。在pH 2.5~8.5范围内,峰电流差△Ip随pH增大发生变化,pH=4.5时△Ip达到最大。因此,选择pH 4.5进行分析测定。
(3)MB聚合圈数的选择:实验中考察了聚合圈数10~30时,对Hep测定的影响。当聚合圈数从10圈开始,随着聚合圈数的增加,△Ip逐渐增大,聚合圈数为20圈时△Ip达到最大,20圈后随着圈数的增加△Ip降低。可能是因为当聚合到一定程度后,膜会变得越来越致密,阻碍了电流的传输。因此,实验中选择聚合圈数为20圈。
(4)富集时间的选择:研究了富集时间对复合物电化学行为的影响。采用开路富集,在30~150 s范围内考察富集时间对PMB氧化峰电流的影响,实验发现,富集时间为30~55 s时,峰电流差△Ip流随着富集时间的增加而增大,大于55 s后峰电流开始缓慢降低,因此,选择富集时间为55 s。
2.3 线性范围、精密度和检出限
在最佳实验条件下,利用PMB-MWNT/GCE对Hep进行测定。图3为PMB-MWNT/GCE在不同浓度Hep的DPV曲线及其线性关系。PMB峰电流的降低值△Ip与Hep的浓度在0.33~17.13μg/mL范围内呈良好的线性关系,线性方程为△Ip(μA)=1.6c+11.2(μg/mL),相关系数为0.994 6。检出限为0.09μg/mL。用同一支修饰电极对5.74μg/mL的Hep进行11次平行测定,RSD为0.40%,将电极平行修饰6次,对5.74μg/mL的Hep进行7次平行测定,RSD为1.83%,表明制备的PMB-MWNT/GCE有良好的重复性和再现性。与文献[8]报道结果相比(线性范围为0.2~4.0μg/mL,检出限为0.072 mg/L),本法测定Hep的线性范围更宽。而且本法使用修饰电极克服了使用滴汞电极造成的污染。

图3 不同浓度的Hep中PMB的微分脉冲伏安曲线及其Hep的线性关系图
2.4 共存物质的影响
对常见的葡萄糖、淀粉、麦芽糖、蔗糖及表面活性剂(SDBS和CTAB)等共存物质对该体系的干扰进行了实验。结果表明:相同浓度的葡萄糖、淀粉、麦芽糖、蔗糖对Hep测定的影响不大,分别为3.61%、-3.31%、-4.86%和2.38%。而表面活性剂SDBS和CTAB对反应有影响。离子型表面活性剂的加入会极大地干扰体系的测定,可能是由于Hep与PMB的结合主要是通过静电引力的作用,阴阳离子型表面活性剂加入后会在溶液中发生解离并同PMB发生结合反应,从而影响PMB与Hep的结合[8]。
2.5 样品分析
精确移取Hep注射液1 mL(江苏万邦生化医药股份有限公司,产品批号:0706121,标示效价12 500 IU/2 mL,1 mg=160 IU)于100 mL容量瓶中,用二次蒸馏水稀释至刻度,摇匀;吸取上述稀释液3 mL于10 mL比色管中,在优化条件下按实验方法1.2进行测定。对所分析样品进行标准加入回收实验,结果见表1。从表1可以看出:回收率分别在97%~102%之间。实验结果表明:本方法可以成功用于Hep注射液的测定,结果令人满意。
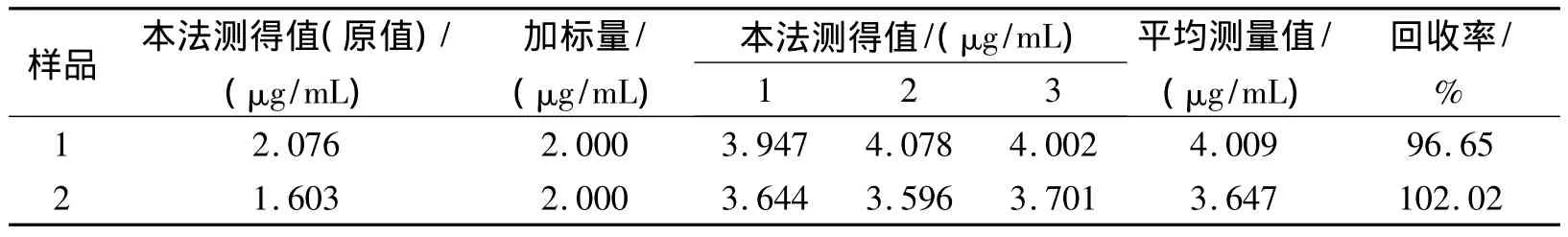
表1 肝素钠注射液样品测定的回收率实验
3 结论
本文以聚合的PMB为电化学探针,利用在酸性条件下PMB能与Hep发生相互作用而导致PMB电化学信号降低,建立了测定Hep的微分脉冲伏安分析新方法。本文建立的方法与其他电化学方法[8-10]比较,具有稳定、响应时间短、灵敏、无污染等优点。本方法有望用于其他生物多糖分子的分析测定。
[1] 何庆,焦庆才.生物药物分析[M].北京:化学工业出版社,2003:258.
[2] 中华人民共和国卫生部药典委员会.中华人民共和国药典:二部[M].北京:化学工业出版社,2005:271.
[3] 刘秀英,张超灿,徐卫林.甲苯胺蓝分光光度法测定肝素钠的研究[J].化学试剂,2009,31(4):271-274.
[4] 刘保生,王晶,薛春丽,等.曙红-中性红荧光能量转移抑制法测定肝素[J].分析试验室,2009,28(9):9-11.
[5] 郭小群.甲基红共振瑞利散射法测定肝素钠[J].化学研究与应用,2006,18(10):1242-1244.
[6] 毛平,黄晓兰,李翠贞,等.高效液相色谱法测定肝素含量[J].中华医学检验杂志,1995,18(6):358-360.
[7] 丁侃,方积年.多糖类药物的毛细管电泳分析方法及其应用[J].色谱,1999,17(4):346-350.
[8] 孙伟,焦奎,丁雅勤.甲基紫与肝素钠结合反应的电化学研究及分析应用[J].化学学报,2006,64(5):397.
[9] 孙伟,丁雅勤,韩军英,等.结晶紫线性扫描伏安法测定肝素钠的研究[J].药物分析杂志,2005,25(12):1495.
[10] 杜美菊,黄华伟.Nafion修饰分散铋电极线性扫描伏安法测定肝素钠含量[J].化学试剂,2007,29(9):535-536.
[11] 田玲,王宗花,张旭麟,等.聚亚甲基蓝/碳纳米管修饰电极阳极溶出伏安法测定痕量锡[J].应用化工,2008,37 (3):236-239.
[12] 李晓霞,申丽华,王姝,等.多壁碳纳米管修饰电极上阿替洛尔电化学行为的研究及其测定[J].分析试验室,2008,27(6):1-4.
[13] Laviron E,Roullier L.General Expression of the Linear Potential Sweep Voltammogram for a Surface Redox Reaction with Interactions Between the Adsorbed Molecules:Applications to Modified Electrodes[J].JElectroanal Chem,1980,115:65-74.
[14] 殷勇,李欣,易军鹏,等.用神经网络-方波溶出伏安法同时检测微量元素[J].河南科技大学学报:自然科学版,2005,26(4):92-94.

