吸附共沉淀法分离钼酸铵中的钨
冷明锋
(洛阳栾川钼业股份有限公司,洛阳栾川 471500)
0 前言
众所周知,钨钼同属于第六副族元素,都是稀有高熔点金属,由于镧系收缩的影响,导致钨钼的离子半径非常接近,原子结构及化学性质相似。在原生矿中,钨钼常为伴生元素,特别是以类质同象形式存在的钨钼,通过机械破磨等选矿方法根本无法分离,因此,钨钼的深度分离是当前钼冶金中无法回避的现实。
在目前开展的钼酸铵溶液分离少量钨的研究方法中,萃取和离子交换都存在工序繁多,原则流程长的缺点,无论洗涤或是再生都会导致钼的损失,而且废水处理也存在一定的难度。碱石灰选择性沉淀分离法操作简单,但深度除钨效果不是太理想,原因在于很难避免局部过饱和现象。吸附共沉淀法不但操作简单,而且可以完全避免局部过饱和现象的发生,如果直接加入 Fe(NO3)3·9H2O不能达到预期目的,那么可以用 Fe(NO3)3·9H2O配制新生态Fe(OH)3,然后再加入。
本文主要研究了在钼酸铵溶液中加入新生态Fe(OH)3和直接加入 Fe(NO3)3·9H2O在不同 pH条件下的吸附效果,用量及陈化时间对钨钼分离的影响。对于温度而言,由于新生态 Fe(OH)3对W的吸附属于典型的表面吸附,要求载体沉淀剂颗粒细小,表面积大,升高温度 Fe(OH)3迅速团聚,明显不利于吸附,同时沉淀迅速生成时,表面吸附的钼来不及和构成吸附沉淀的钨进行交换而被迅速生成的沉淀包围起来,导致钼的损失和对钨的吸附能力降低。因此,实验选择在室温条件下进行。
1 实验部分
1.1 实验原料
钨酸铵溶液:用光谱纯三氧化钨配制而成钼酸铵溶液:用钼焙砂通过一次氨浸获取
实验原料:用上述 2种料液混合而成,钼含量206.32 g/L,钨含量 10 g/L。
1.2 设备
pH-3酸度计;772S型可见光分光光度计;电磁搅拌器;802W二米平面光栅摄谱仪;电子天平等。
1.3 分析方法
无干扰物质时,钨钼的分析均采用硫氰酸盐 -分光光度法,钼酸铵及产品中钨的分析方法采用四苯砷氯盐酸盐 -硫氰酸盐分光光度法,钼酸铵产品中其他元素的分析采用 802 W二米平面光栅摄谱仪。
2 实验结果与讨论
2.1 不同 pH值条件下的吸附效果
分别取 200 mL实验料液于烧杯中,用 HNO3调整溶液的 pH值,然后加入相当于 5 g Fe3+的新生态Fe(OH)3或缓慢加入相当于 5 g Fe3+的Fe(NO3)3·9H2O,搅拌、静置各 1 h后过滤,滤渣经洗涤和低温烘干后测定每克 Fe3+吸附W、Mo的毫克数(单位简写为 g/mg),其中新生态 Fe(OH)3对钨的吸附编为 A组,新生态 Fe(OH)3对钼的吸附编为B组,直接加入 Fe(NO3)3·9H2O对钨的吸附编为 C组,直接加入 Fe(NO3)3·9H2O对钼的吸附编为D组,测定结果见表 1。
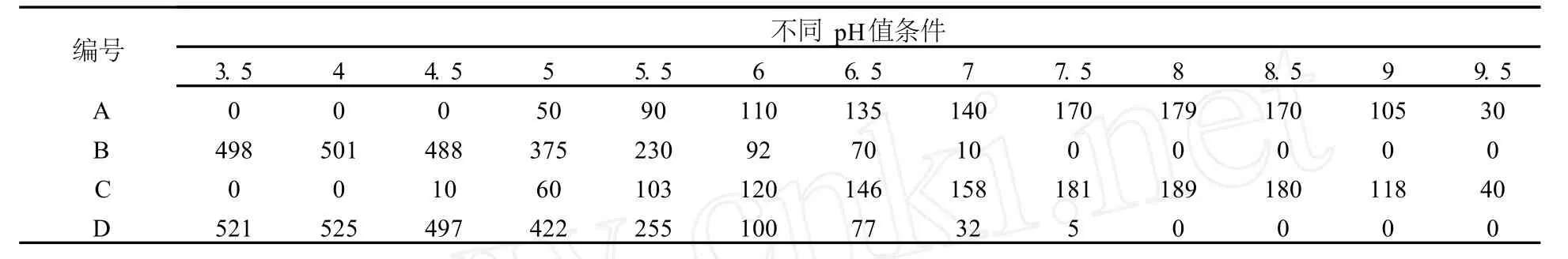
表1 不同pH值条件下Fe(OH)3对钨钼的吸附量 g/mg
由表 1可以看出,无论是用新生态 Fe(OH)3或直接加入 Fe(NO3)3·9H2O对钨钼分离的效果都非常明显,在 pH值 3.5~4.5之间,载体 Fe(OH)3只能吸附共沉淀钼而不吸附钨,同时对钼的吸附达到最大值。随着碱性的增强,对钼的吸附量迅速降低,对钨的吸附量逐惭增大,在 pH值 7.5~8.5之间达到最大值,此刻对钼的吸附几乎为零,可忽略不计,当 pH值进一步增大时,对钨的吸附也迅速降低,证明钨钼分离的最佳 pH值范围应在 7.5~8.5之间。根据新生态 Fe(OH)3和直接加入Fe(NO3)3·9H2O的实验结果进行对比,证明直接加入 Fe(NO3)3· 9H2O的吸附效果明显优于新生态 Fe(OH)3,因此后续实验将控制 pH在 8左右直接加入 Fe(NO3)3·9H2O进行。
2.2 Fe3+用量及陈化时间的影响
根据表 1的实验结果,最大吸附时的 Fe3+/W为 5.29,考虑到陈化时间对吸附共沉淀 Fe3+用量的影响,分别取 200 ml实验料液于烧杯中,按 Fe3+与W质量分数比 4.5、5、5.5和 6这 4种比例进行陈化实验,陈化时间分别取 5 h、8 h、12 h和 24 h,经过滤后取滤液化验其中的钨,换算钨的去除率,测定结果见表2。
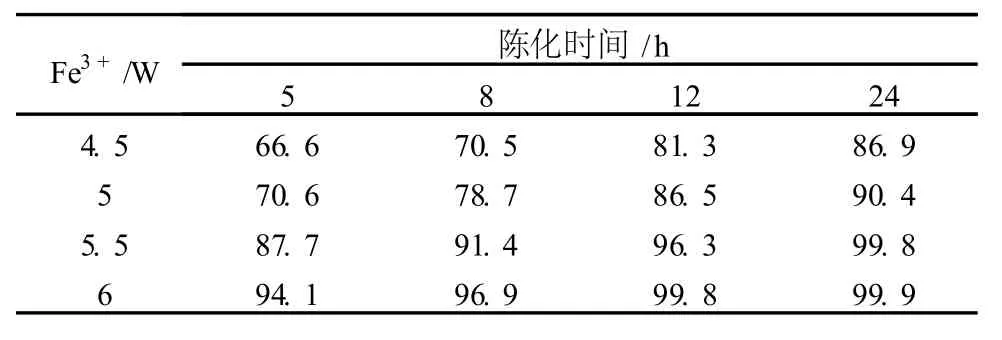
表 2 Fe3+的用量及陈化时间对钨去除率的影响%
由表 2可以看出,无论是增大 Fe3+的用量或是增加陈化时间都能有效提高钨的去除率,但与表 1中最大吸附时的 Fe3+/W相比,表 2的实验结果明显偏低,说明 Fe3+对钼酸铵溶液中钨的吸附不是成定量关系,而是随着钼酸铵溶液中W含量的降低Fe3+的吸附能力随之降低,因此,在工业生产中应根据钼酸铵溶液实际钨含量来确定 Fe3+的用量。
为了进一步确定陈化效果,分别取 Fe3+/W= 5.5,陈化时间 12 h和 24 h,Fe3+/W=6,陈化时间8 h、12 h和 24 h各 100 mL滤液,依次编为 1、2、3、4、5号样,通过蒸发结晶得到七钼酸铵,送样分析,分析结果见表3。

表3 陈化效果 mg/kg
从表 3可以看出,陈化时间应控制在 12 h以上,否则会导致产品中 Fe元素超标,这说明Fe(OH)3沉淀之初是以无定形胶体形态存在,需要12 h以上的陈化时间使其转换为晶形沉淀。结合表2的实验结果,晶型转换的过程同时也是其表面吸附的钼和构成吸附沉淀的钨进行钨钼交换的过程, 2、4、5号样都符合新国标零级品的标准。
3 结论
(1)吸附共沉淀法分离钼酸铵中的钨与萃取法、离子交换法和碱石灰分离法相比,具有明显的优势,不但操作简单,产品符合新国标零级品的标准,而且成本极低,不会引入新的杂质。
(2)吸附共沉淀法分离钼酸铵中的钨应控制pH=8左右,只要控制好加入速度,可直接加入含Fe3+的铁盐。
(3)Fe3+对钼酸铵溶液中钨的吸附不是成定量关系,而是随着钼酸铵溶液中W含量的降低 Fe3+的吸附能力随之降低,因此,在工业生产中应根据钼酸铵溶液实际钨含量来确定 Fe3+的用量。
(4)陈化时间对吸附效果的影响极大,使Fe(OH)3由沉淀之初的无定形胶体形态转换为晶形沉淀的关键因素,晶型转换的过程同时也是其表面吸附的钼和构成吸附沉淀的钨进行钨钼交换的过程。
[1] 刘能生,朱薇,肖连生.从钼酸盐溶液中分离微量钨的研究进展[J].中国钼业,2008,32(2):20-24.
[2] 向铁根.钼冶金[M].长沙:中南大学出版社,2009.
[3] 湿法冶金手册编委会.湿法冶金手册[M].北京:冶金工业出版社,2005.
[4] 有色金属提取冶金手册编委会.稀有高熔点金属[M].北京:冶金工业出版社,1999.

