黄芩茎叶黄酮对大鼠缺血性记忆障碍的改善作用及对胆碱乙酰转移酶和一氧化氮合酶蛋白表达的影响
王玉梅 曹 凯 刘永平 秦博文 商亚珍
(河北省重要研究与开发重点实验室/承德医学院中药研究所,承德 067000)
慢性脑缺血是指各种原因引起长期的脑灌流不足,伴发于多种临床神经系统性疾病,如动脉粥样硬化、血管性痴呆及阿尔茨海默病等。而这些疾病的发生涉及胆碱能系统、一氧化氮、兴奋性氨基酸、线粒体损伤及氧化自由基系统等多方面[1-2]。其中胆碱能系统和一氧化氮及其合成酶的异常变化与脑缺血损伤引起的神经功能障碍密切相关,已经得到研究人员的高度重视。
目前,在临床上采用一系列方法治疗脑缺血引起的神经损伤,而中药复方或其提取活性成分在防治缺血性脑损伤方面已显示出良好的效果,并已成为研究的热点。黄芩茎叶黄酮(flavonoids from stem and leaf of scutellaria baicalensis georgi,SSF)是从中药黄芩地上部分提取分离的黄酮类化合物,本实验室先前利用多种体内外模型已经确定了SSF具有抗炎、抗氧化、抗缺氧和改善记忆障碍等作用[3-6]。本研究采用大鼠双侧颈总动脉结扎建立慢性脑缺血模型,利用大鼠Morris水迷宫行为实验和免疫组织化学的方法,进一步探讨SSF对脑缺血性记忆障碍的改善作用,并通过测定脑内胆碱乙酰转移酶(chloine acetyltransferase,ChAT)和一氧化氮合酶(nitric oxide synthase,NOS)蛋白表达揭示其作用机制。
1 材料和方法
1.1 实验动物和试剂
健康雌性SD大鼠300~320 g,购买于河北医科大学实验动物中心(合格证编号:90912);SSF(承德医学院中药研究所提供);抗ChAT、神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)抗体、免疫组化试剂盒(武汉博士德生物工程有限公司)。
1.2 大鼠慢性脑缺血模型制备及分组给药
60只雌性SD大鼠,术前禁食12 h,禁水4 h。称体质量后使用10%水合氯醛腹腔注射麻醉(mL/kg)。取仰卧位将大鼠固定在手术台上,去毛剪颈内部去毛、强力碘消毒后沿颈正中切开,分离双侧颈总动脉,并套以“0”号线,待动物清醒后结扎双侧颈总动脉。假手术组大鼠(8只)做同样手术但不结扎双侧颈总动脉。手术期间确保大鼠能自主呼吸且肛温保持在31.5℃~37.5℃。术后每只动物腹腔注射8万单位的青霉素钠预防细菌感染,并送至温度为22℃±1℃的动物房饲养,观察。术后30 d进行水迷宫筛选,成模率为75%。将造模成功的大鼠按数字表法完全随机设计分为 4 组:模型组,17.5、35.0 和 70.0 mg/kg SSF 3个剂量给药组,各8只。在手术第35天开始灌胃给药,给药30 d后进行水迷宫测试。连续给药38 d直至取材,假手术组和模型组灌胃等体积0.9%氯化钠注射液。
1.3 大鼠学习记忆能力的测试
1.3.1 Morris水迷宫
水迷宫是一直径为120 cm,高50 cm的不锈钢圆形水池。迷宫上方装有摄像头,并与安装有处理软件的电脑相连。人为将水池等分成4个象限,将一个直径10 cm,高30 cm的平台放在任意一个象限正中。实验时加入足量碳素墨水并使水面高于平台1.5 cm,水温控制在23℃ ±1℃。具体测试方法参照文献[7]。水迷宫共测试6 d。
1.3.2 定位航行测试
定位航行实验2 d:第1天和第2天(即术后第65天和第66天),各组大鼠在术后第65天即给药30 d以后,进行定位航行实验,每日2次测试找到平台的游泳路程的平均值作为当天大鼠的学习成绩,测试期间继续给药。
1.3.3 空间搜索测试
空间搜索实验用于检测大鼠的记忆保持能力,测试第3天,即大鼠在术后第67天(定位航行实验结束后),将水迷宫中平台撤去,任选一个入水点(近端或者远端)将大鼠面向池壁放入水中,记录各组大鼠60 s内在目标象限的游泳路程和4个象限总的游泳路程,以2者的比值(即目标象限游泳路程百分比)作为当天的学习成绩,测试期间继续给药。
1.3.4 再学习能力测试
再学习能力测试3 d:第4天、第5天和第6天,术后第68天将迷宫中的平台移至目标象限的对面,记录各组大鼠找到平台的游泳路程,每日2次测试找到平台的游泳路程的平均值作为当天的学习成绩。测试期间继续给药。
1.4 ChAT和一氧化氮合酶蛋白表达的检测
采用免疫组织化学的方法检测大鼠海马细胞中ChAT、nNOS、iNOS和eNOS蛋白的表达。各组大鼠在术后第72天,末次灌胃给药60 min后,大鼠乙醚麻醉,断头冰上取脑,将右脑用4%甲醛固定24 h,石蜡包埋,常规石蜡切片,片厚5 μm。免疫组化标记采用(streptomycin avidin-biotin-peroxidase complex,SABC)法测定海马细胞中ChAT、nNOS、iNOS和 eNOS蛋白的表达情况,以细胞质出现棕黄色颗粒为阳性表达,每组大鼠选6张切片,每张切片按数字表法随机采集6个视野,应用MiVnt图像分析系统进行图像分析,以阳性细胞面积与视场面积比值的平均值来表示各组阳性表达信号的强弱。
1.5 统计学方法
采用统计软件SPSS 11.5进行统计学分析,实验数据以均数±标准差()表示,水迷宫数据采用two-way ANOVA进行处理,其他数据组间多样本均数间比较采用one-way ANOVA分析,以P<0.05为差异有统计学意义。
2 结果
2.1 SSF对慢性脑缺血大鼠Morris操作的影响
2.1.1 SSF对慢性脑缺血大鼠定位航行实验的影响
定位航行实验发现,与假手术组相比,模型组大鼠2 d找到平台的游泳路程分别延长100.28%(P=0.001)和115.46%(P=0.001),差异具有统计学意义。SSF 17.5、35.0 和 70.0 mg/kg 治疗组与模型组相比均可显著缩短,大鼠找到平台的游泳路程差异具有统计学意义(图1)。
2.1.2 SSF对慢性脑缺血大鼠空间探索实验的影响

图1 SSF对慢性脑缺血大鼠在Morris水迷宫操作中定向航行实验和再学习能力的影响Fig.1 Effects of SSF on directional sailing and relearning ability in chronic cerebral ischemia rats with Morris water maze task
空间探索实验发现,与假手术组相比,模型组大鼠在60 s内目标象限游泳路程的百分比显著减少了49.40%(P=0.001);而 SSF 17.5、35.0 和 70.0 mg/kg灌胃给药30 d能使慢性脑缺血大鼠在目标象限游泳路程的百分比分别增加了21.44%(P=0.043)、52.23%(P=0.001)和 62.43%(P=0.001)。而且从游泳轨迹上可以看出,SSF17.5、35.0 和 70.0 mg/kg灌胃给药30 d后能明显增加慢性脑缺血大鼠在目标象限的游泳路程和穿越平台的次数(图2)。
2.1.3 SSF对慢性脑缺血大鼠再学习能力的影响
在3 d的再学习能力实验中发现,与假手术相比,模型组大鼠找到平台的游泳路程显著延长,分别延长了73.30%(P=0.001)、125.49%(P=0.001)和129.30%(P=0.001),差异具有统计学意义。SSF 17.5、35.0 和70.0 mg/kg灌胃给药 30 d 均可明显缩短大鼠找到平台的游泳路程且差异具有统计学意义(图1)。
2.2 SSF对慢性脑缺血大鼠海马细胞中ChAT蛋白表达的影响
免疫组织化学检测大鼠海马细胞中ChAT蛋白表达的结果发现,与假手术组相比,模型组大鼠海马中ChAT免疫反应阳性神经元数量减少了162.56%(P=0.001);而 17.5、35.0 和 70.0 mg/kg SSF 治疗38 d能不同程度的增加模型组大鼠海马细胞中ChAT蛋白的表达,细胞胞质和胞膜均着黄褐色。3个剂量的药物使海马细胞中ChAT免疫阳性细胞表达分别增加了46.25%(17.5 mg/kg SSF,P=0.028)、70.60%(35 mg/kg SSF,P=0.002)和 124.67%(70 mg/kg SSF,P=0.001)(图3,表1)。
2.3 SSF对慢性脑缺血大鼠海马细胞中nNOS、iNOS和eNOS蛋白表达的影响
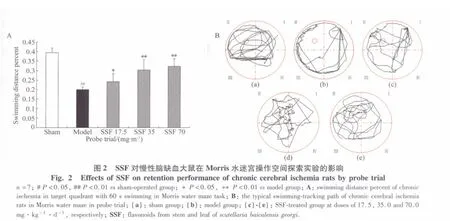

表1 SSF对慢性脑缺血大鼠海马细胞中ChAT、nNOS、iNOS和eNOS蛋白表达的影响Tab.1 Effects of SSF on ChAT,nNOS,iNOS,eNOS expression of hippocampus in chronic cerebral ischemia rats()(n=6)
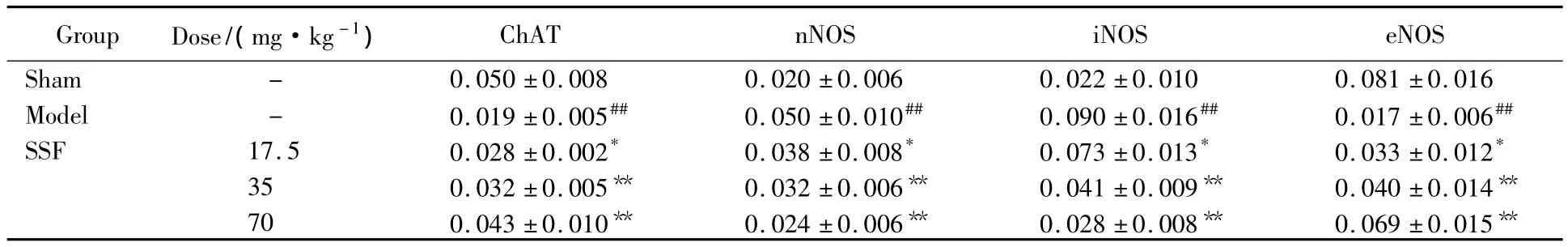
表1 SSF对慢性脑缺血大鼠海马细胞中ChAT、nNOS、iNOS和eNOS蛋白表达的影响Tab.1 Effects of SSF on ChAT,nNOS,iNOS,eNOS expression of hippocampus in chronic cerebral ischemia rats()(n=6)
#P <0.05,##P <0.01 vs sham-operated group;* P <0.05,** P <0.01 vs model group;SSF:flavonoids from stem and leaf of scutellaria baicalensis georgi;ChAT:choline acetyltransferase;nNOS:neuronal nitric oxide synthase;iNOS:inducible nitric oxide synthase;eNOS:endothelial nitric oxide synthase.
ChAT nNOS iNOS eNOS Sham - 0.050 ±0.008 0.020 ±0.006 0.022 ±0.010 0 Group Dose/(mg·kg-1).081 ±0.016 Model - 0.019 ±0.005## 0.050 ±0.010## 0.090 ±0.016## 0.017 ±0.006##SSF 17.5 0.028 ±0.002* 0.038 ±0.008* 0.073 ±0.013* 0.033 ±0.012*35 0.032 ±0.005** 0.032 ±0.006** 0.041 ±0.009** 0.040 ±0.014**70 0.043 ±0.010** 0.024 ±0.006** 0.028 ±0.008** 0.069 ±0.015**
免疫组化检测大鼠海马细胞中nNOS、iNOS和eNOS蛋白表达的结果发现,与假手术组相比,模型组大鼠海马细胞中nNOS和iNOS免疫阳性表达明显增加,细胞胞体棕色颗粒较多;eNOS免疫阳性细胞明显减少。而17.5、35.0 和70.0 mg/kg SSF 治疗38 d 能不同程度的降低模型组大鼠海马细胞中nNOS和iNOS蛋白的表达,增加模型组大鼠海马细胞中eNOS蛋白的表达,3个剂量的药物使海马细胞中nNOS和iNOS免疫阳性细胞表达分别减少了22.69%,19.45%(17.5 mg/kg SSF)、35.75%,54.90%(35 mg/kg SSF)和52.03%,68.85%(70 mg/kg SSF);eNOS 免疫阳性细胞表达分别增加了 92.47%(17.5 mg/kg SSF)、136.91%(35 mg/kg SSF)和 305.59%(70 mg/kg SSF)(图4~6,表1)。

图4 SSF对慢性脑缺血大鼠海马CA1区nNOS蛋白表达的影响Fig.4 Photomicrograph of nNOS immunostainning of hippocampus in chronic cerebral ischemia rats(DAB stain 400×)
3 讨论
慢性脑缺血是神经系统的一种常见病理状态,临床上主要表现为学习、记忆及空间辨别能力明显下降。利用双侧颈总动脉永久性结扎模型,模拟慢性脑低灌注状态,可以部分复制临床慢性脑缺血,是目前普遍认同的用于慢性脑低灌注研究的动物模型[8]。陈涛等[9]用 Morris水迷宫检测发现,慢性脑缺血8周后,与假手术组相比,缺血组大鼠空间学习记忆能力有损害,逃避潜伏期显著延长,定位能力欠佳,穿越目标平台的次数减少,差异显著。学习和记忆功能包括3个基本过程,记忆获得、记忆巩固和记忆保持。本实验利用Morris水迷宫,主要通过定位航行实验检测动物的空间记忆获得的能力、空间探索实验评价记忆保持能力以及再学习能力测试检测各组大鼠的再学习能力,全面地评价了大鼠的认知功能。检测结果显示,与假手术组相比,模型组大鼠找到平台的游泳路程显著延长,而 17.5、35.0 和70.0 mg/kg SSF 治疗组大鼠在这6 d的测试中找到平台的游泳路程与模型组相比均明显缩短,并且在探索实验中SSF高、中、低3个剂量均能明显增加慢性脑缺血大鼠在目标象限的游泳路程百分比和穿越平台的次数。表明SSF能够提高脑缺血动物的学习记忆能力,明显改善慢性脑缺血造成的大鼠学习记忆功能下降。


胆碱能系统与记忆的形成和贮存密切相关。ChAT免疫组织化学[10]表明海马CA1区ChAT免疫反应阳性神经元和纤维数量明显减少,与大鼠的学习记忆障碍程度呈正相关。大鼠缺血再灌后脑内乙酰胆碱浓度下降,同时给予拟胆碱能药物能改善学习记忆功能[11]。因此,血管性痴呆的记忆功能障碍与中枢胆碱能系统有着必然的联系。已有证据[12]表明,海马是参与学习和记忆功能的重要部位,且与海马胆碱能系统直接相关。本实验结果显示,双侧颈总动脉结扎2个月后,模型组大鼠海马细胞中胆碱乙酰转移酶ChAT免疫反应阳性神经元数量明显减少,而17.5、35.0 和70.0 mg/kg SSF 治疗38 d能不同程度的增加大鼠海马细胞中ChAT蛋白的表达,细胞胞质和胞膜均着黄褐色。综上所述,海马细胞中ChAT蛋白表达下降参与了脑缺血的损伤过程,SSF通过提高海马细胞中ChAT蛋白的表达,改善了脑缺血大鼠的胆碱能系统功能,进而改善了其学习记忆能力。
目前认为脑缺血后大量一氧化氮(nitric oxide,NO)产生,能破坏胆碱能神经元,使额叶、海马等脑区神经元受损,最终出现学习记忆障碍和痴呆等病症。在脑缺血的各个阶段NO的产生均有所增加,过多NO与过氧化物反应生成过硝酸盐,造成蛋白质、核酸和脂质膜损伤,产生神经毒性。在正常情况下,NO在中枢神经系统中主要有调节脑血流量、抗血小板和白细胞聚集黏附和参与神经突触的信息传递等生物学作用。但是在病理情况下,过量NO则表现出毒性作用[13]。NOS是NO合成最关键的限速酶,其含量及活性的变化直接影响NO的生成量。目前已确定的NOS有3种亚型:神经元型NOS(nNOS)、诱导型NOS(iNOS)和内皮型NOS(eNOS)。eNOS和nNOS合称为结构型NOS(cNOS)。cNOS在中枢神经系统中是基本表达形式,而 iNOS是病理状况下非正常表达[14]。nNOS主要在神经元中表达,调节突触可塑性,介导神经系统内信号转导,参与脑缺血后的神经毒性作用。eNOS主要分布在脑血管组织,也分布于支气管内皮、小静脉、毛细血管以及心脏微血管内皮中,eNOS是细胞的正常成分。iNOS主要表达于小胶质细胞、星形胶质细胞、中性白细胞和巨噬细胞。脑缺血后,缺血区中性粒细胞、巨噬细胞等炎性反应细胞浸润,这些炎性反应细胞及受损细胞产生的细胞因子能够诱导产生大量的iNOS,造成NO的大量持续的释放,参与缺血后的神经毒性作用,加重脑损伤[15]。本实验就SSF对慢性脑缺血后不同类型的NOS蛋白的表达情况进行了研究。实验结果显示脑缺血模型组大鼠海马细胞中nNOS和iNOS免疫阳性表达明显增加;eNOS免疫阳性细胞明显减少,17.5和70.0 mg/kg SSF治疗38 d能不同程度的改善模型组大鼠海马细胞中NOS蛋白表达紊乱的现象。
综上所述,SSF可以显著缩短脑缺血模型组大鼠找到平台的游泳路程;增加脑组织中ChAT蛋白的表达,提高胆碱能神经元活性,改善记忆障碍;减少nNOS和iNOS蛋白的表达,增加eNOS蛋白的表达,减轻NO氧化带来的损伤,从而对慢性脑缺血学习记忆障碍起到改善作用。
[1]张岗,王发渭.血管性痴呆的基础实验研究进展[J].军医进修学院学报,2010,31(7):734-736.
[2]崔海月,王庆国.缺血性脑血管病发病机制的新进展[J].长春中医药大学学报,2009,25(2):291-292.
[3]李素婷,石艳华,杨鹤梅,等.黄芩茎叶总黄酮对肝脏MDA生成的影响[J].中国中医药信息杂志,2001,8(6):23-24.
[4]商亚珍,孟艳彬,缪红,等.SSF抗小鼠脑缺氧作用[J].中国中医药信息杂志,2002,9(6):24-25.
[5]Shang Y Z,Gong M Y,Zhou X X,et al.Improving effects of SSF on memory deficits and pathological changes of neural and immunological systems in senescent mice[J].Acta Pharmacol Sin,2001,22(12):1078-1083.
[6]商亚珍,苏丙凡,王永利.黄芩根及其茎叶成分的药理学研究进展[J].承德医学院学报,2005,2(22):153-155.
[7]Yu J,Liu C,Zhang X,et al.Acupuncture improved cognitive impairment caused by multi-infarct dementia in rats[J].Physiol Behav,2005,86(4):434-441.
[8]Sarti C,Pantoni L,Bartolini L,et al.Cognitive impairment and chronic cerebral hypoperfusion:what can be learned from experimental models[J].J Neurol Sci,2002,203-204:263-266.
[9]陈涛,章军建,余芬,等.促红细胞生成素对慢性脑缺血大鼠空间学习记忆能力的影响[J].武汉大学学报(医学版),2006,27(2):225-228.
[10]范文辉,刘之荣,李露斯.血管性痴呆的动物模型及其胆碱能机制研究[J].第三军医大学学报,2000,22(4):314.
[11]Scremin O U,Jenden D J.Time-dependent changes in cerebral choline and acetylcholine induced by transient global ischemia in rats[J].Stroke,1991,22(5):643-647.
[12]苗建亭,游国雄,王者晋.血管性痴呆大鼠记忆障碍与海马胆碱能神经元关系的研究[J].中华老年医学杂志,1997,16(6):327-330.
[13]张洪,慕容慎行.一氧化氮与神经系统疾病[J].临床神经病学杂志,2000,13(2):124-126.
[14]de Leeuw F E,de Groot J C,Achten E,et al.Prevalence of cerebral white matter lesions in elderly people:a population based magnetic resonance imaging study.The Rotterdam Scan study[J].J Neurosurg Psychiatry,2001,70(1):9-14.
[15]赵洪芹,潘旭东.一氧化氮合酶与脑缺血关系的研究进展[J].青岛大学医学院学报,2000,36(2):153-154.

