代森锰锌对PC-12细胞凋亡的影响
张劲松,栾春业,王 强,徐 艳,张 晶,环 飞,程 洁,肖 杭
(1.南京医科大学第一附属医院急诊中心,江苏南京 210029;2.滨州医学院附属医院急诊科,山东滨州 256603;3.南京医科大学公共卫生学院神经毒理研究室,江苏南京 210029)
代森锰锌(mancozeb)属含锰的乙烯基二硫代氨基甲酸盐类杀菌剂,主要成分为代森锰,属于环境内分泌干扰物[1],通过干扰体内正常激素的作用,影响诸多系统和器官的功能。研究显示,长期暴露于代森锰锌可能与帕金森等神经退化性疾病相关[2],体外培养中脑脑片暴露于代森锰锌10~50 μmol·L-1能浓度依赖性地降低多巴胺能神经元以及GABA神经元的活力[3],动物实验也观察到代森锰锌染毒大鼠多巴胺能神经元凋亡[4],但具体机制尚不清楚。本实验应用PC-12细胞作为多巴胺能神经元体外模型,观察代森锰锌对PC-12细胞凋亡的影响,探讨代森锰锌诱发神经元凋亡的机制。
1 材料与方法
1.1 试剂和仪器
PC-12细胞购自中国科学院上海生命科学研究院细胞所;代森锰锌购自美国Sigma公司;各种规格培养皿为 Corning Costar产品;Cell Counting Kit-8(CCK-8)购自日本同仁公司;流式细胞术FITC-AnnexinⅤ/PI试剂盒购自南京联科公司;DMEM购自Gibco公司;胎牛血清为杭州四季青产品;兔抗鼠p-ERK1/2一抗为 CST产品;Bcl-2和Bax购自南京凯基公司;其余试剂为国产分析纯。BX50-FLA荧光显微镜为日本Tokyo公司产品。
1.2 细胞培养及WST-8法检测细胞增殖和毒性分析
PC-12细胞1×105接种于96孔培养板,5%CO2,37℃恒温条件下,培养于含10%灭活胎牛血清和青霉素 100 kU·L-1及链霉素 100 mg·L-1高糖DMEM培养基中,显微镜下观察细胞达到对数生长期时用于实验。代森锰锌用DMSO溶解,初浓度为2 mmol·L-1,使用时用不含血清的 DMEM 培养基稀释到终浓度为 1,10,30,60,120 μmol·L-1,加入含有PC-12细胞的培养板中并标记,设立对照组(二甲亚砜)和只含培养基的空白组,每组设3组复孔,继续培养24 h后,按照CCK-8试剂盒说明书的步骤加入试剂,37℃孵育 1 h,多功能酶标仪(TECON)检测吸光度值(absorbance,A),细胞抑制率 =1-〔(A实验-A空白)/(A对照-A空白)〕×100%,重复实验3次。
1.3 Hoechst33258染色观察细胞形态学
应用Hoechst33258核染色结合荧光照相技术检测细胞核形态改变,取对数生长期PC12细胞,加入代森锰锌50 μmol·L-1再培养24 h 后,PBS 洗2 次,加入固定液,然后加入 Hoechst33258(终浓度为 10 mg·L-1),37℃避光染色 15 min,PBS 洗3 次,用荧光显微镜观察,正常细胞核表现为弥漫均匀的低强度荧光,凋亡细胞核呈浓染致密固缩状态或颗粒状荧光,随机选取视野在荧光显微镜下摄片。
1.4 流式细胞术检测PC-12细胞凋亡
按凋亡检测试剂盒说明操作,培养细胞经消化处理,离心收集细胞,沉淀并加结合缓冲液后再加入FITC-AnnexinⅤ/PI,避光孵育30 min后流式细胞仪检测10 000个细胞,凋亡分析软件计算PC-12细胞早期凋亡率和晚期凋亡率,每一时相点重复检测3次,重复实验3次。
1.5 Western印迹法检测蛋白表达
收集经代森锰锌 0,1,30 和 120 μmol·L-1染毒处理24 h后细胞沉淀,PBS洗2遍,加入裂解液,4℃摇床反应30 min,10 625×g离心15 min后取上清,BCA法测定总蛋白含量。Western印迹检测凋亡相关蛋白Bax、Bcl-2以及p-ERK1/2蛋白表达,每孔上样50 μg,15%体积分数SDS-PAGE分离样品。转膜、封闭,将PVDF膜与溶于TBST中的一抗4℃过夜孵育,洗涤5 min×3次,将膜浸入1∶1000体积比的二抗稀释液,室温孵育1 h,洗涤30 min,ECL法显影,拍摄图片,结果在Gel-pro Analyzer图像分析系统中进行积分吸光度(integrated absorbance,IA)值分析。
1.6 统计学分析
2 结果
2.1 代森锰锌对PC-12细胞增殖和凋亡的影响
图1结果显示,代森锰锌对PC-12细胞具有毒性作用,且具有浓度依赖性,随着代森锰锌浓度增加,PC12细胞的抑制率升高,其中代森锰锌120 μmol·L-1组细胞抑制率为高达(90±4)%。经 Hill方程曲线拟合,IC50为49.95 μmol·L-1,h 系数为5.57。
2.2 代森锰锌对PC-12细胞凋亡率的影响
表1结果显示,代森锰锌作用24 h能够浓度依赖性地诱导PC-12细胞凋亡。与正常对照组比较,代森锰锌 30 μmol·L-1使 PC-12 细胞的早期凋亡率升高到(9.5 ±1.0)%(P <0.05),代森锰锌 1,30和120 μmol·L-1使PC-12细胞晚期凋亡率均明显升高(P <0.05)。代森锰锌 120 μmol·L-1晚期凋亡率最高达(94.2±3.9)%,与细胞增殖和毒性实验结果相符。

图1 代森锰锌对PC-12细胞增殖和凋亡的影响.对数生长期PC-12 细胞,用代森锰锌0,1,10,30,60 和120 μmol·L-1培养24 h,按说明书要求加入CCK-8试剂,多功能酶标仪检测吸光度A值.细胞抑制率=1-〔(A实验 -A空白)/(A对照 -A空白)〕×100%.±s,n=3.Fig.1 Effect of mancozeb on PC-12 cells proliferation.
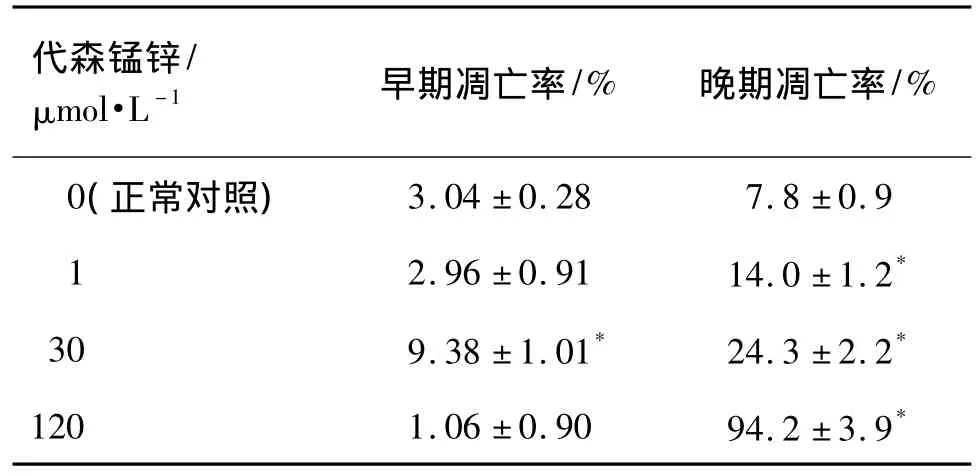
表1 代森锰锌对PC-12细胞凋亡率的影响Tab.1 Effect of mancozeb on apoptosis of PC-12 cells
2.3 代森锰锌对PC-12细胞形态学的影响
正常对照组PC-12细胞表现为弥漫均匀的低强度荧光(图2A 和 C),代森锰锌50 μmol·L-1处理组细胞数量减少,荧光显微镜下可见细胞核浓染的凋亡细胞,呈致密固缩或颗粒状荧光高倍镜下可见胞核变形、膨大及核固缩、核小体形成(图2B和D)。
2.4 代森锰锌对 PC12细胞 Bcl-2,Bax和p-ERK1/2表达的影响
图3结果显示,代森锰锌使PC-12细胞Bcl-2表达下降,Bax表达升高(图3A);代森锰锌诱导PC-12细胞凋亡过程中p-ERK1/2表达增高,代森锰锌 120 μmol·L-1组 IA 分 别 为 128.0 ± 2.5 和178.4 ±4.0(图3B)。

图2 代森锰锌对PC-12细胞核形态的影响(Hoechst33258).A,C:正常对照组;B,D:代森锰锌 50μmol·L-1组.A,B:×100;C,D:×1000.对数生长期PC-12细胞代森锰锌处理24 h后,采用Hoechst33258染色后,倒置荧光显微镜随机选取视野摄片,正常细胞核表现为弥漫均匀的低强度荧光,凋亡细胞核呈浓染致密固缩状态或颗粒状荧光。箭头示胞核变形、膨大及核固缩、核小体形成。Fig.2 Effect of mancozeb on morphological changes of nucleus of PC-12 cells.
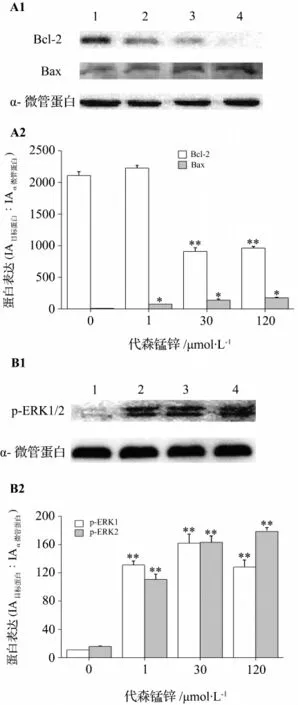
图3 代森锰锌对PC-12细胞Bcl-2,Bax(A)和p-ERK1/2(B)表达的影响.PC-12细胞经代森锰锌处理24 h后.条带1~4分别为正常对照组,代森锰锌1,30和120 μmol·L-1组.±s,n=3.*P <0.05,**P <0.01,与相应的对照组相比.Fig.3 Effect of mancozeb on the expression of Bcl-2,Bax,and p-ERK1/2 in PC-12 cells.
3 讨论
细胞凋亡是机体在内外环境刺激下,启动自身机制,由基因调控的细胞死亡过程,伴随基因转录和蛋白质合成。形态学特点是细胞核染色质固缩,细胞膜发泡,细胞器紧缩,凋亡小体形成与呈现“DNA阶梯”电泳图谱。常用的检测细胞凋亡的方法有很多[5],主要包括形态学观察,荧光素标记结合流式细胞术,DNA断裂检测法,凋亡相关蛋白的检测法以及线粒体内跨膜电位和膜渗透性变化的检测等。
Bcl-2家族是研究最早的与凋亡有关的基因,也是目前最受重视的调控细胞凋亡的基因家族。线粒体功能异常致凋亡途径与Bcl-2家族蛋有着密切关系。Bcl-2家族成员中的促凋亡蛋白Bax和抑凋亡蛋白Bcl-2,以异二聚体的形式存在于线粒体内膜和内质网上,通过控制线粒体膜的通透性来调节凋亡激活物,如细胞色素c的释放来影响细胞的状态。Bcl-2水平的升高和Bax的降低表明细胞对凋亡的抵抗性增强,反之则对凋亡的抵抗性减弱。本研究结果显示,代森锰锌诱导PC-12细胞凋亡过程中,可浓度依赖性地降低Bcl-2表达水平,增加Bax表达水平,Bcl-2和Bax的比值降低,说明Bcl-2和Bax等蛋白参与了代森锰锌诱导的PC-12细胞凋亡。FITC-AnnexinⅤ/PI双染结合流式细胞术结果显示,早期凋亡和晚期凋亡率均增高,代森锰锌120 μmol·L-1时以晚期凋亡为主,早期凋亡细胞较对照组减少,可能与高剂量促使更多的早期凋亡细胞发展为晚期凋亡有关;Hoechst33258染色观察PC-12细胞核形态学改变,可见核膨大、固缩,以及染色质边集浓染、核小体形成等凋亡形态学特征。
ERK包括ERK1和ERK2,是将信号从表面受体传导至细胞核的关键。磷酸化激活的ERKl/2由胞质转位到核内,进而介导转录活化,参与细胞增殖与分化、细胞形态维持、细胞骨架的构建、细胞凋亡等多种生物学反应。早期实验认为ERK是一种存活因子,当生长因子丧失和应用细胞毒性物质时,ERK1/2活化,抑制凋亡。但这种对凋亡前期的保护作用依赖细胞类型、药物种类以及其他信号转导途径的状态。最近的研究发现ERK也是一种凋亡因子,ERK1/2激活伴随 Bax的表达增加[5],直接调控凋亡蛋白胱天蛋白酶3活化并诱发凋亡[6]。在去甲斑蝥素诱导的细胞凋亡中ERK活化是其凋亡的下游信号[7],同时ERK被认为参与了神经元的退化[8],持续缓慢地激活ERK并在神经细胞凋亡中发挥作用[9],与帕金森等慢性神经系统疾病相关。
代森锰锌诱导神经元凋亡中的作用机制具有复杂性和多样性。已发现金属锰能穿过血脑屏障发挥神经毒性作用,但含锰的乙烯基二硫代氨基甲酸盐类杀菌细胞毒性实验结果显示,起主要作用的是乙烯基二硫代氨基甲酸盐而不是锰[3]。Calviello等[10]发现代森锰锌能引起细胞氧化应激导致DNA损伤,双向凝胶电泳发现各种氧化应激相关蛋白及转录因子的表达发生变化[10]。而 Dias等[11]在观察酵母菌对代森锰锌的耐受性实验时,发现代森锰锌并不是直接的氧化自由基或者氧化诱导物,可能是通过其他途径发挥作用。其他实验发现代森锰锌能干扰线粒体氧化呼吸,抑制线粒体的解偶联过程,降低ATP含量,对多巴胺能神经元以及GABA神经元都具有损伤作用[12]。本研究发现ERK信号通路可能参与代森锰锌导致PC-12细胞的凋亡过程,ERK作为从胞膜到胞核间重要的信号蛋白,其高表达会引起下游信号蛋白的表达改变,破坏了细胞间促调亡和促存活因素间的平衡,导致细胞最终不同的结局。另外可能还有其他机制参与代森锰锌诱导神经元凋亡过程,因此需要对相关信号通路介导细胞凋亡作用做更全面深入的研究,明确其作用的具体分子机制,才能更好地为临床预防和治疗长期暴露于代森锰锌所导致的帕金森病等神经退行性疾病提供依据。
[1] Cecconi S,Paro R,Rossi G,Macchiarelli G.The effects of the endocrine disruptors dithiocarbamates on the mammalian ovary with particular regard to mancozeb[J].Curr Pharm Des,2007,13(29):2989-3004.
[2] Debbarh I,Rambelomanana S,Penouil F,Castaigne F,Poisot D,Moore N.Human neurotoxicity of ethylenebis-dithiocarbamates(EBDC)[J].Rev Neurol(Paris),2002,158(12 Pt 1):1175-1180.
[3] Soleo L,Defazio G,Scarselli R,Zefferino R,Livrea P,Foà V.Toxicity of fungicides containing ethylene-bis-dithiocarbamate in serumless dissociated mesencephalicstriatal primary coculture[J].Arch Toxicol,1996,70(10):678-682.
[4] Thiruchelvam M,Richfield EK,Baggs RB,Tank AW,Cory-Slechta DA.The nigrostriatal dopaminergic system as a preferential target of repeated exposures to combined paraquat and maneb:implications for Parkinson's disease[J].J Neurosci,2000,20(24):9207-9214.
[5] Kim YK,Kim HJ,Kwon CH,Kim JH,Woo JS,Jung JS,et al.Role of ERK activation in cisplatin-induced apoptosis in OK renal epithelial cells[J].J Appl Toxicol,2005,25(5):374-382.
[6] Nowak G.Protein kinase C-alpha and ERK1/2 mediate mitochondrial dysfunction,decreases in active Na+transport,and cisplatin-induced apoptosis in renal cells[J].J Biol Chem,2002,277(45):43377-43388.
[7] McGrew DM,Irwin I,Langston JW.Ethylenebisdithiocarbamate enhances MPTP-induced striatal dopamine depletion in mice[J].Neurotoxicology,2000,21(3):309-312.
[8] Noshita N,Sugawara T,Hayashi T,Lewén A,Omar G,Chan PH.Copper/zinc superoxide dismutase attenuates neuronal cell death by preventing extracellular signal-regulated kinase activation after transient focal cerebral ischemia in mice[J].J Neurosci,2002,22(18):7923-7930.
[9] Colucci-D'Amato L, Perrone-Capano C, di Porzio U.Chronic activation of ERK and neurodegenerative diseases[J].Bioessays,2003,25(11):1085-1095.
[10] Calviello G, Piccioni E, Boninsegna A, Tedesco B,Maggiano N,Serini S,et al.DNA damage and apoptosis induction by the pesticide mancozeb in rat cells:involvement of the oxidative mechanism[J].Toxicol Appl Pharmacol,2006,211(2):87-96.
[11] Dias PJ,Teixeira MC,Telo JP,Sá-Correia I.Insights into the mechanisms of toxicity and tolerance to the agricultural fungicide mancozeb in yeast,as suggested by a chemogenomic approach[J].OMICS,2010,14(2):211-227.
[12] Domico LM, Zeevalk GD, Bernard LP, Cooper KR.Acute neurotoxic effects of mancozeb and maneb in mesencephalic neuronal cultures are associated with mitochondrial dysfunction[J].Neurotoxicology,2006,27(5):816-825.

