新型铂类化合物LLC-0601与舒铂对SD大鼠的肝毒性
王振宇,梅 茸,宋京风,刘伟平,陆 瑛
(1.昆明医学院云南省天然药物药理重点实验室,云南昆明 650500;2.昆明医学院附属昆华医院,云南昆明 650032;3.昆明贵金属研究所,云南昆明 650221)
自20世纪60年代新型铂类无机抗癌药物因其独特的抗癌机制及较好的疗效,一直是抗肿瘤药物研究的热点。目前已相继成功开发了顺铂、卡铂、奈达铂、奥沙利铂、洛铂、舒铂等用于临床治疗癌症[1]。但该类药物严重的毒性作用一直是限制其临床应用的一大缺陷[2]。舒铂,化学名为cis-[(4R,5R)-4,5-双(氨甲基)-2 异丙基-1,3-二氧环戊烷]丙二酸根合铂(Ⅱ),分子式C11H20N2O6Pt,相对分子质量为471,是由韩国SK公司开发的第三代铂类抗肿瘤药物,并于1999年首次在韩国批准上市。其对亚洲国家发病率较高的胃癌有显著疗效,同时也能用于治疗结直肠癌和小细胞肺癌,甚至对耐受顺铂、卡铂的肿瘤有一定疗效[3-5]。然而舒铂在临床应用中仍存在血液、肝、肾及胃肠道等毒性作用[6],且在理化性质上也不太理想。
昆明贵金属研究所在长期的研究中发现,以4,5-双(氨甲基)-1,3-二氧环戊烷为载体的铂配合物有广阔的抗癌前景,因此合成了数个以该基团为载体的新化合物,并从中筛选出LLC-0601,化学名为cis-[(4R,5R)-4,5-双(氨甲基)-2 异丙基-1,3-二氧环戊烷]3-羟基-1,1-环丁烷二羧酸根合铂(Ⅱ),分子式C14H24N2O7Pt,相对分子质量526,其理化性质和前期体内外抗肿瘤活性均优于舒铂。本实验旨在对LLC-0601与已上市且结构相似的舒铂进行肝毒性比较研究,为LLC-0601的临床研究和开发提供实验依据。
1 材料与方法
1.1 动物
SPF级SD大鼠,雄性,50只,体质量200~250 g。来源于昆明医学院实验动物中心,动物许可证号:SCXK(滇)2005-0008。动物使用许可证号:SYXK(滇)2005-0009,大鼠饲养于SPF级屏障环境,实验前适应性饲养3 d。
1.2 药物与试剂
LLC-0601(批号080620);舒铂(批号080321)二者均为白色粉末,由昆明贵金属研究所提供。顺铂(批号080401)淡黄色液体,规格:10 mg,由云南个旧生物药业有限公司生产。5%葡萄糖注射液(批号C070301b),规格:100 ml,由昆明南疆制药有限公司提供。谷丙转氨酶(glutamic pyruvic transaminase,GPT)、谷草转氨酶(glutamic oxaloacetic transaminase,GOT)、碱性磷酸酶(alkaline phosphatase,ALP)由上海荣盛生物科技有限公司生产,总蛋白(total protein,TP)、白蛋白(albumin,ALB)、总胆红素(total bilirubin,T-Bil)由中生北控生物科技股份有限公司生产。谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(total superoxide dismutase,T-SOD)和微量丙二醛(malondialdehyde,MDA)由南京建成生物工程研究所生产。
1.3 仪器
日本产TMS-1024全自动生化分析仪;日本产CL-770型临床分光光度计;国产ACCULAB ALC-210.3型电子天平;国产TDZ5-WS平衡离心机;日本产Nikon eclipse 50i生物显微镜;北京天地电子科技公司彩色病理显微镜图像分析系统。
1.4 剂量设计[7]
前期药效学实验结果表明,在荷瘤小鼠动物模型上,LLC-0601 60 mg·kg-1取得一定的疗效,与舒铂 80 mg·kg-1的疗效基本相当,LLC-0601 120 mg·kg-1疗效则明显优于舒铂 80 mg·kg-1。因此将这3个剂量通过体表面积折算为大鼠剂量,分别为LLC-0601 34.9 和 69.8 mg·kg-1和舒铂 46.6 mg·kg-1。因此本实验设 LLC-0601 40,70 mg·kg-1组和舒铂40 mg·kg-1组,同时设顺铂阳性对照。顺铂常作为动物肝肾损伤模型的阳性药物,其小鼠剂量选择一般为3~4 mg·kg-1,按体表面积折算大鼠为1.75 ~2.33 mg·kg-1,本实验大鼠顺铂给药量为2.0 mg·kg-1。
1.5 动物分组及给药
50只大鼠随机分为5组,每组10只,分别为正常对照(5%葡萄糖)组、顺铂2 mg·kg-1(阳性对照)组、舒铂40 mg·kg-1组、LLC-0601 40 和 70 mg·kg-1组。大鼠均尾静脉iv给药,每天1次,连续给药2 d后间隔5 d,再给药2 d,如此3个循环,共注射6次,停药恢复观察28 d。
1.6 血清生化指标的检测
于末次给药后24 h和恢复期结束分别处死6只和4只动物,采血进行血清 GPT,GOT,ALP,TP,ALB和T-Bil检测。
1.7 肝系数的计算和病理组织学检查[8]
称量肝质量并计算肝系数,以每100 g体质量肝所占质量表示。肝系数=肝质量(g)/体质量(g)×100。取部分肝组织进行组织匀浆检测GSH-Px,TSOD和MDA;取肝组织用4%甲醛溶液固定,常规石蜡包埋,切片,片厚4 μm,HE染色,光学显微镜下观察,进行病理组织学检查肝炎程度:-为肝基本正常;+为轻度病变,肝细胞局部点状坏死,少量炎细胞浸润;++为中度病变,局部肝细胞灶状、片状坏死,多量炎细胞浸润。
1.8 统计学分析
2 结果
2.1 动物一般情况观察
LLC-0601 40 mg·kg-1组大鼠未见明显异常,其余给药组动物均表现出神差、少食、少动、竖毛、毛发无光泽和体质量下降,并随给药次数增加而逐渐加重,舒铂组最为明显,给药结束前舒铂组有1只动物死亡。
2.2 LLC-0601与舒铂对血清生化指标的影响
与顺铂组比较,给药末期舒铂组血清生化改变最为明显,GPT明显升高,TP和ALB明显降低(P<0.05,P <0.01);而 LLC-0601 40 和 70 mg·kg-1组未见明显差异。与正常对照组比,恢复期顺铂组GPT明显升高(P<0.05)。与舒铂组相比,顺铂组和LLC-0601 40 mg·kg-1组 TP 和 ALB 略低,TP 有显著性差异(P<0.05),但均在正常参考值范围内(表1)。
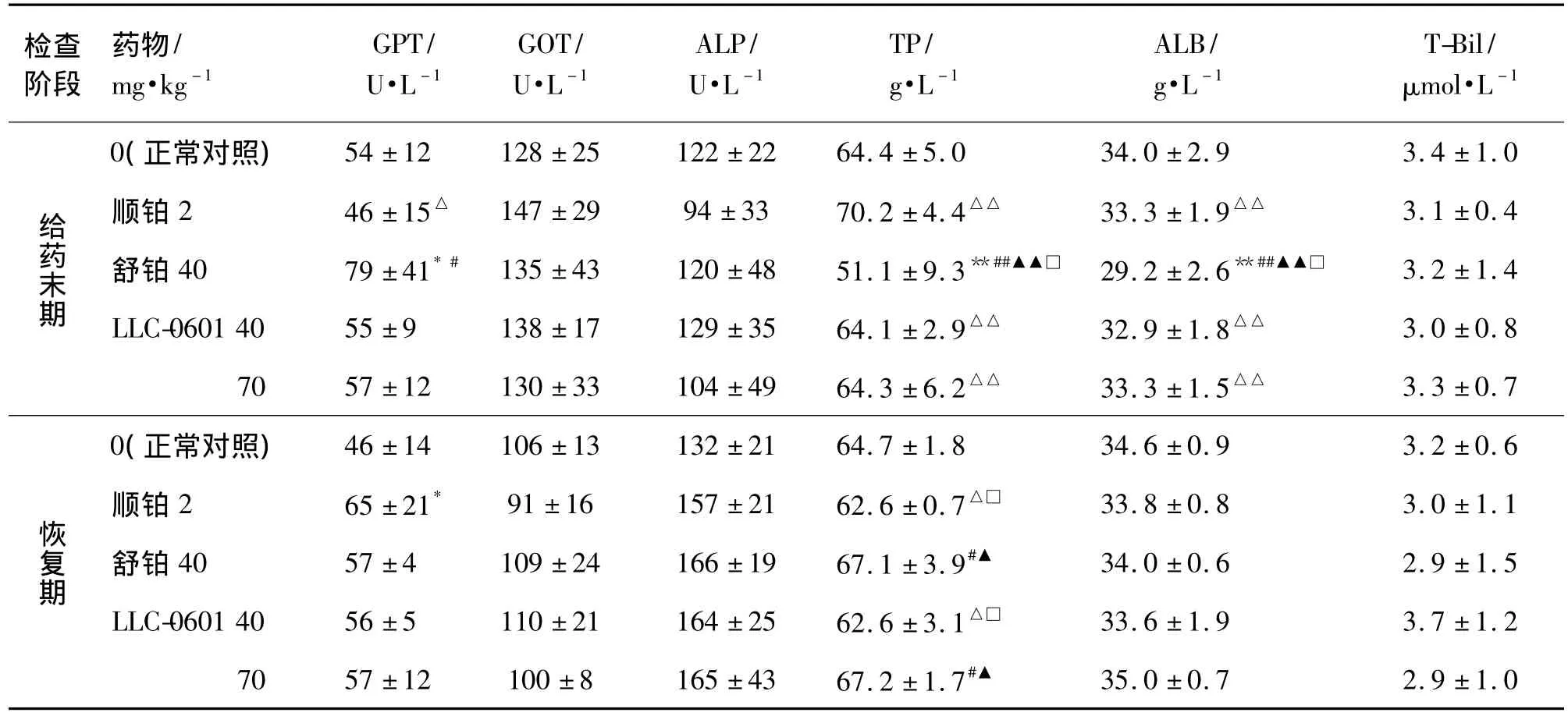
表1 LLC-0601与舒铂对血清生化指标的影响Tab.1 Effect of LLC-0601 and heptaplatin on serum biochemical parameters in SD rats
2.3 LLC-0601与舒铂对肝质量与肝系数的影响
与正常对照组相比,给药末期 LLC-0601 40 mg·kg-1组肝质量与肝系数未见明显变化,其余给药组肝质量明显降低(P <0.05,P <0.01),以顺铂组和舒铂组降低最为明显(P<0.01);顺铂组肝系数明显降低(P <0.01);而 LLC-0601 70 mg·kg-1组肝质量降低(P<0.05),但肝系数无显著性差异。恢复期各给药组动物肝质量与系数均恢复正常,组间比较无显著性差异(表2)。
2.4 LLC-0601与舒铂对肝组织匀浆 GSH-Px,SOD和MDA的影响
与正常对照组相比,给药末期各相应给药组GSH-Px无明显变化,顺铂组T-SOD有显著性差异(P<0.01);而各给药组 MDA均明显升高(P<0.05)。与顺铂组比较,舒铂和 LLC-0601 40和70 mg·kg-1组 T-SOD 均明显升高(P <0.01)。与正常对照组和顺铂组比较,恢复期各给药组肝GSH-PX,SOD和MDA均无显著性差异(表3)。
2.5 LLC-0601与舒铂对肝病理组织学的影响
如图2和表4所示,正常对照组和LLC-0601 40 mg·kg-1组动物肝给药末期和恢复期均未见明显异常。其余各给药组均出现不同程度的肝炎性改变,给药末期顺铂组和LLC-0601 70 mg·kg-1组可见散在的肝细胞点状或小灶性坏死,肝窦内少量的淋巴细胞浸润,病变较轻微。舒铂组表现为广泛的肝细胞水肿,散在的肝细胞多灶状片状坏死,个别中央静脉边缘和肝窦内多量的淋巴细胞浸润。恢复期舒铂组和LLC-0601 70 mg·kg-1组仍可见散在的肝细胞局部点状坏死和肝窦内少量淋巴细胞浸润,病变程度较轻。顺铂组表现为散在或多发的肝细胞灶状片状坏死,肝窦内多量淋巴细胞浸润,病变程度较给药末期重。
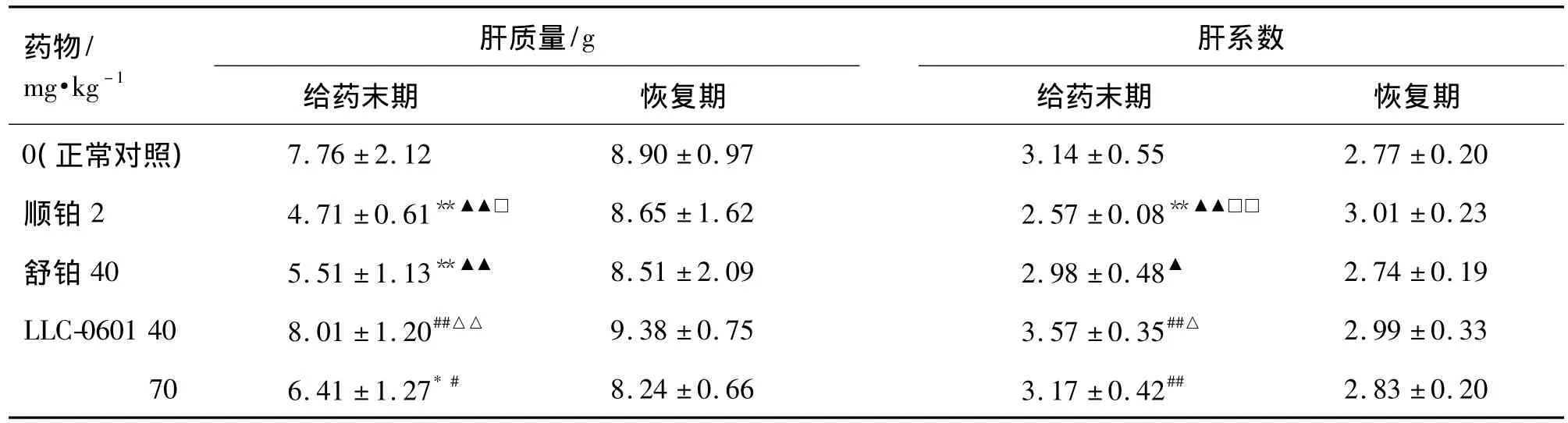
表2 LLC-0601与舒铂对肝质量与肝系数的影响Tab.2 Effect of LLC-0601 and heptaplatin on in liver mass and coefficient of rats
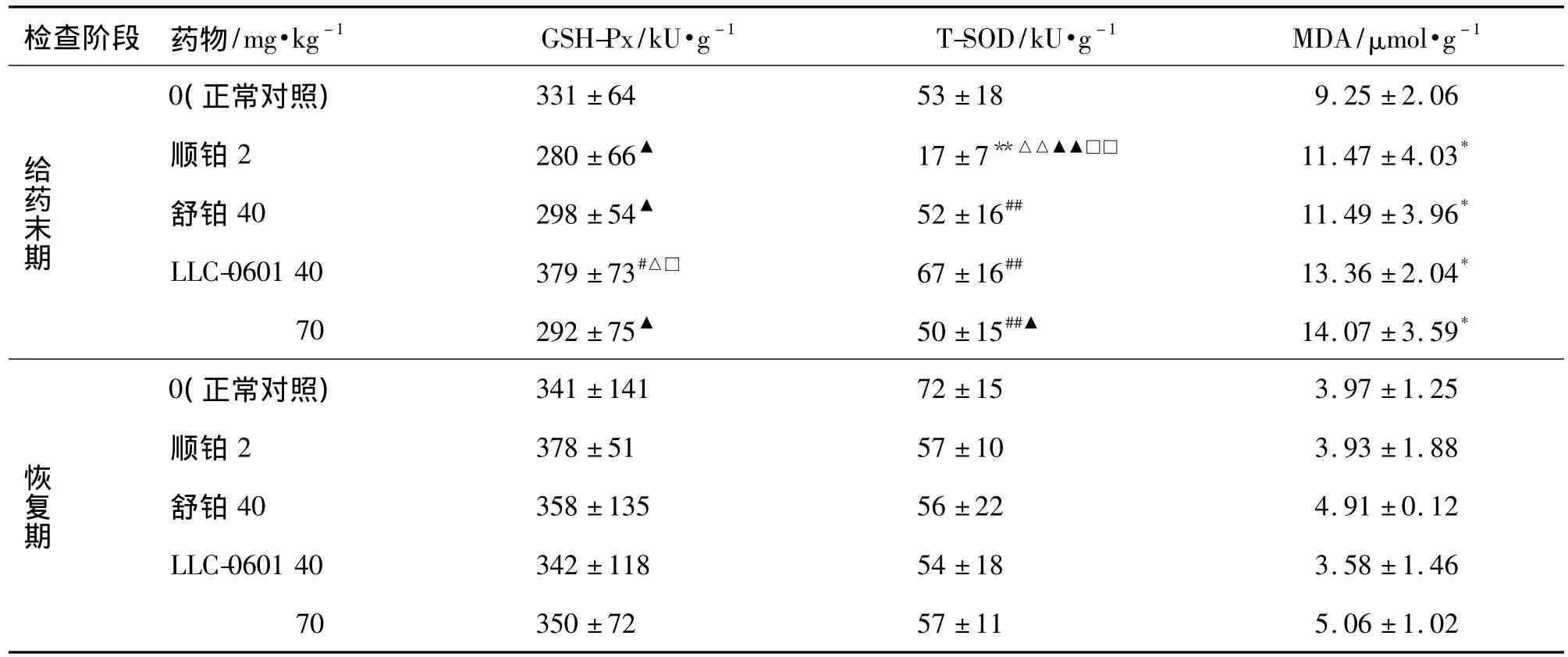
表3LLC-0601与舒铂对肝组织匀浆谷胱甘肽过氧化物酶(GSH-Px),超氧化物歧化酶(SOD)和微量丙二醛(MDA)的影响Tab.3 Effect of LLC-0601 and heptaplatin on glutamic pyruvic transaminase(GSH-Px),total superoxide dismutase(SOD)and malondialdehyde(MDA)in liver homogenate of rats
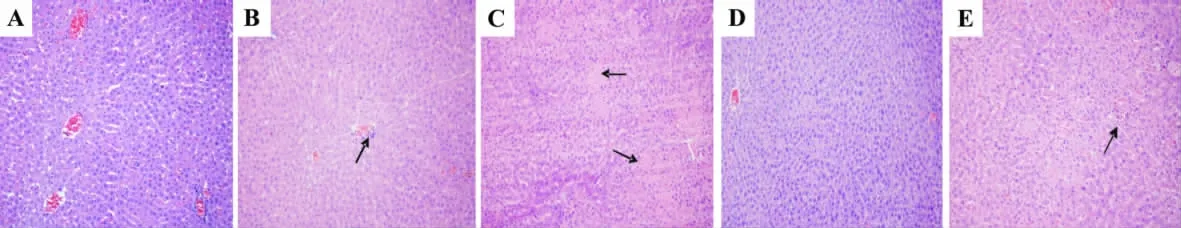
图2 LLC-0601与舒铂给药末期对肝病理组织学的影响(HE ×100).动物处理见表1.A:正常对照组;B:顺铂组,箭头示散在的肝细胞点状或小灶性坏死;C:舒铂组,箭头示肝细胞散在的多灶性坏死.D:LLC-0601 40 mg·kg-1.E:LLC-0601 70 mg·kg-1,箭头示散在的肝细胞点状或小灶性坏死.Fig.2 Effect of LLC-0601 and hetaplatin representative histopathological changes in the liver of rats(HE ×100).
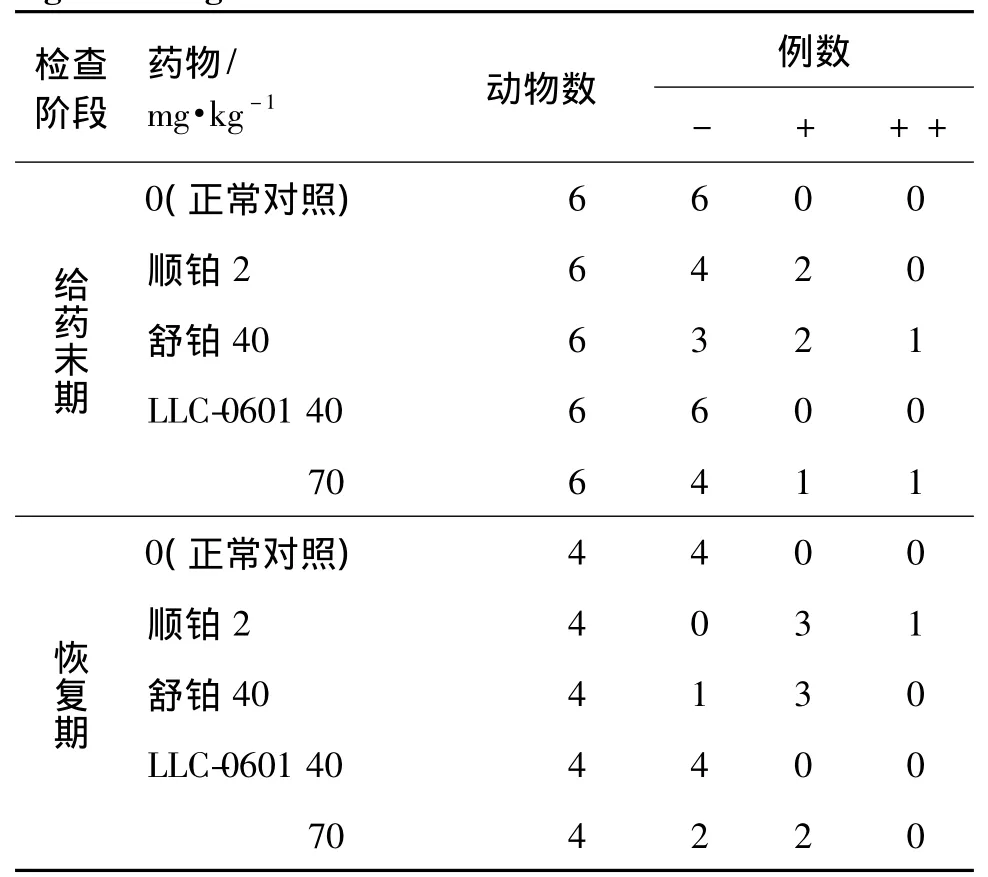
表4 LLC-0601与舒铂对肝病理组织学的影响Tab.4 Effect of LLC-0601 and heptaplatin on histopathological changes in liver of rats
3 讨论
目前上市的几个铂类药物均存在不同程度的肝毒性及其他器官系统毒性,如顺铂的消化系统反应、肾毒、神经毒、耳毒、肝毒及骨髓抑制等[9],而舒铂虽然毒性较顺铂有所降低,但无论是在临床前或临床Ⅰ,Ⅱ和Ⅲ期研究均发现了较明显的不良反应[5-6,10-11]。如Ⅰ期的临床研究中发现以每天 1 次静脉滴注1 h,间隔3~4周为一个循环,当舒铂剂量达到480 mg·m-2时,多数患者均出现明显的毒性反应(按 WHO毒性分级标准):4级肝毒性(GPT,GOT升高)、3级血液毒性(白细胞、血小板减少和贫血)、2级肾毒性(氮质血症和蛋白尿,经水化治疗后测定)以及2级消化道反应(恶性、呕吐)等。Ⅱ期的临床研究中以同样的给药方式,舒铂剂量达到360~440 mg·m-2时,同样观察到1~2级的肝毒性、血液毒性、肾毒性和消化道反应。此外舒铂的溶解度小,室温下溶解度 <5 g·L-1。
LLC-0601水溶性好,室温溶解度可达到25 g·L-1,水溶液稳定性与舒铂相当,避光可稳定72 h以上。前期研究结果显示其体内外对人的非小细胞肺癌细胞、结肠癌细胞和胃癌细胞均有明显的抑制作用,而小鼠单次静脉注射急性毒性实验LLC-0601的 LD50(372.7 mg·kg-1)约 为 舒 铂 (196.2 mg·kg-1)的 2 倍。
本研究以顺铂为阳性对照,观察舒铂与LLC-0601的肝毒性,从结果中不难发现,舒铂在40 mg·kg-1就出现明显的肝毒性反应,血清GPT升高、TP和ALB降低,提示肝细胞受损,肝蛋白合成功能降低。同时肝质量和肝系数均降低,病理组织学检查表现为肝细胞多灶状坏死和肝窦内淋巴细胞浸润。而LLC-0601 40 mg·kg-1时几乎未观察到任何肝损伤表现,而LLC-0601 70 mg·kg-1时才出现轻微的肝损伤表现。而顺铂组的肝毒性改变与舒铂和LLC-0601略有不同,其恢复期病变程度明显重于给药末期,考虑为其在体内蓄积而引发的延迟毒性反应。文献[9,12]报道,0~5 d顺铂从尿中回收铂为给药量的27% ~54%,而0~7 d舒铂的从尿中回收铂为给药量的80%~86%,从其他排泄物中回收铂为给药量的8% ~15%,即0~7 d舒铂总的排除率在90%以上。LLC-0601目前还未进行药代动力学研究,尚不能确定其在体内的蓄积情况,但根据其理化性质和动物恢复情况,其药物的排泄率可能与舒铂相当。
顺铂的肝毒性与组织过氧化损伤相关[13-14]。顺铂进入机体后可产生大量羟自由基和活性氧自由基,引起膜脂质过氧化,导致膜通透性和膜脂流动性的改变,同时产生多种有毒的降解产物,从而引起组织的氧化损伤。本研究为探索舒铂和LLC-0601的肝毒性机制,检测了肝组织匀浆中的抗氧化主要指标SOD,GSH-Px和MDA。本研究结果显示,给药末期除 LLC-0601 40 mg·kg-1组外,顺铂组、舒铂组和 LLC-0601 70 mg·kg-1组 SOD 和 GSH-Px均有不同程度的下降,而MDA各给药组均略高于对照组,提示氧化损伤是这3种铂类化合物引起肝损伤的原因之一。
综上所述,在同等剂量下,铂类化合物LLC-0601对SD大鼠的肝毒性明显小于结构相似的上市药物舒铂,是一个有开发前景的新化合物。
[1] Wheate NJ,Walker S,Craig GE,Oun R.The status of platinum anticancer drugs in the clinic and in clinical trials[J].Dalton Trans,2010,39(35):8113-8127.
[2] Wong E,Giandomenico CM.Current status of platinumbased antitumor drugs[J].Chem Rev,1999,99(9):2451-2466.
[3] Hong WS,Kim HT,Kim KH,Kim DK.In vitro antitumor activity of a new platinum complex,cis-malonato[(4R,5R)-4,5-bis(aminomethyl)-2-isopropyl-1,3-dioxolane]platinum(Ⅱ)(SKI 2053R),against human lung and stomach cancer cell lines[J].Anticancer Res,1995,15(1):51-54.
[4] Kim DK,Kim HT,Cho YB,Tai JH,Ahn JS,Kim TS,et al.Antitumor activity of cis-malonato[(4R,5R)-4,5-bis(aminomethyl)-2-isopropyl-1,3-dioxolane]platinum(Ⅱ),a new platinum analogue,as an anticancer agent[J].Cancer Chemother Pharmacol,1995,35(5):441-445.
[5] Zang DY,Lee KH,Lee JS,Lee JH,Kim WK,Kim SH,et al.PhaseⅡ trial of a novel platinum analog,SKI 2053R,in patients with previously untreated extensive-stage small-cell lung cancer[J].Am J Clin Oncol,1999,22(5):495-498.
[6] Kim NK,Kim TY,Shin SG,Park YI,Lee JA,Cho YB,et al.A PhaseⅠ study of cis-malonato[(4R,5R)-4,5-bis(aminomethyl)-1,3-dioxolane]platinum(Ⅱ)in patients with advanced malignancies[J]. Cancer,2001,91(8):1549-1556.
[7] 谢恩C.加德,著.范玉明,李毅民,张 舒,译.国外药学专著译丛—药物安全性评价[M].北京:化学工业出版社,2006:202-208.
[8] 袁伯俊,廖明阳,李 波.药物毒理学实验方法与技术[M].北京:化学工业出版社,2007:516-550.
[9] Tsang RY, Al-Fayea T, Au HJ. Cisplatin overdose:toxicities and management[J].Drug Saf,2009,32(12):1109-1122.
[10] Kim NK,Im SA,Kim DW,Lee MH,Jung CW,Cho EK,et al.PhaseⅡ clinical trial of SKI-2053R,a new platinum analog,in the treatment of patients with advanced gastric adenocarcinoma[J].Cancer,1999,86(7):1109-1115.
[11] Lee KH,Hyun MS,Kim HK,Jin HM,Yang J,Song HS,et al.Randomized,multicenter,phaseⅢ trial of heptaplatin 1-hour infusion and 5-fluorouracil combination chemotherapy comparing with cisplatin and 5-flu-orouracil combination chemotherapy in patients with advanced gastric cancer[J].Cancer Res Treat,2009,41(1):12-18.
[12] 刘新春,陈运久.其他抗肿瘤药物[M]∥刘新春,程玉峰,李德爱.实用抗肿瘤药物治疗学.北京:人民卫生出版社.2002:466-467.
[13] Zhang X,Yamamoto N,Soramoto S,Takenaka I.Cisplatin-induced germ cell apoptosis in mouse testes[J].Arch Androl,2001,46(1):43-49.
[14] Chirino YI,Pedraza-Chaverri J.Role of oxidative and nitrosative stress in cisplatin-induced nephrotoxicity[J].Exp Toxicol Pathol,2009,61(3):223-242.
[15] Louie B,Rajamahanty S,Pyo P,Choudhury M,Konno S.Mode of cytotoxic action of nephrotoxic agents:oxidative stress and glutathione-dependent enzyme[J].BJU Int,2010,105(2):264-268.

