鹰嘴豆总皂苷对2型糖尿病大鼠胰岛素抵抗及糖代谢的影响
凯赛尔·阿不都克热木, 魏媛媛, 李 潇, 闫 冬, 阿吉艾克拜尔·艾萨, 帕尔哈提·克热木*
(1.新疆医科大学药理教研室,新疆乌鲁木齐 830054;2.新疆维吾尔医药研究所新疆维吾尔医方剂学重点实验室,新疆乌鲁木齐 830049;3.中国科学院新疆理化技术研究所,新疆乌鲁木齐 830011)
鹰嘴豆总皂苷对2型糖尿病大鼠胰岛素抵抗及糖代谢的影响
凯赛尔·阿不都克热木1,2, 魏媛媛1, 李 潇1, 闫 冬1, 阿吉艾克拜尔·艾萨3*, 帕尔哈提·克热木1*
(1.新疆医科大学药理教研室,新疆乌鲁木齐 830054;2.新疆维吾尔医药研究所新疆维吾尔医方剂学重点实验室,新疆乌鲁木齐 830049;3.中国科学院新疆理化技术研究所,新疆乌鲁木齐 830011)
目的 观察鹰嘴豆总皂苷(TSCA)对2型糖尿病大鼠胰岛素抵抗及糖代谢的影响。方法 高糖高脂饲料喂养加链脲佐菌素腹腔注射(45 mg/kg)建立2型糖尿病大鼠模型。将造模成功的大鼠随机分为模型组(丙二醇灌胃,灌胃容积1 mL/100 g)和2个鹰嘴豆总皂苷治疗组分别给100 mg/kg、300 mg/kg(以丙二醇为助溶剂灌胃给药,灌胃容积1 mL/100 g)及二甲双胍组(二甲双胍100 mg/kg灌胃),另选8只大鼠作为正常对照组(丙二醇灌胃,灌胃容积1 mL/100 g),给药4周后,检测空腹血糖值(FPG)、空腹胰岛素(Fins)、并计算胰岛素抵抗指数,血清游离脂肪酸量、白介素-6(IL-6)、肝糖原(HG)、肌糖原(MG)量及糖代谢中关键酶己糖激酶(HK)活性。结果 与模型组相比,鹰嘴豆总皂苷各剂量组均可有效降低2型糖尿病大鼠的血糖(P<0.01),改善胰岛素抵抗,显著降低血清白介素-6、游离脂肪酸量并增加骨骼肌中己糖激酶活性及肌、肝糖原的量。结论 鹰嘴豆总皂苷各剂量组可有效降低2型糖尿病大鼠空腹血糖并改善胰岛素抵抗。
鹰嘴豆总皂苷;2型糖尿病;胰岛素抵抗;游离脂肪酸;白介素- 6;己糖激酶
鹰嘴豆(Cicer arietinumL.)在维吾尔医药中已有两千多年应用历史,为一年生栽培植物,因其面形奇特,尖如鹰嘴,故称此名。维吾尔语称其为诺胡提(音译)。鹰嘴豆属于高营养豆类植物,富含多种植物蛋白和8种人体必需氨基酸、维生素、粗纤维及钙、镁、铁等成分。其中纯蛋白质质量分数高达28%以上.除此之外,它还具有较高的药用价值,据《维吾尔常用药材》记载,鹰嘴豆具有主消渴、解百毒,润肺止咳等功效,近年来的一些研究表明鹰嘴豆可用于预防和治疗2型糖尿病[1-2].
胰岛素抵抗在2型糖尿病中的病理发展过程中扮演着重要的角色,使机体中靶细胞对胰岛素敏感性降低,从而产生高血糖以及高胰岛素血症。本实验采用醇提方法,提取出有效成分鹰嘴豆总皂苷,并研究它对糖尿病大鼠胰岛素抵抗及糖代谢的影响及其改善机制。为开发维吾尔地方药材鹰嘴豆防治糖尿病提供实验及理论依据。
1 材料与方法
1.1 受试物 鹰嘴豆总皂苷中科院新疆理化技术研究所提供。主要试剂:胰岛素酶联免疫定量检测试剂盒及白介素-6 ELISA法检测试剂盒购于上海沪峰生物科技有限公司(批号:0903202);链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);游离脂肪酸试剂盒,肌、肝糖原试剂盒及己糖激酶试剂盒(南京建成生物工程研究所);丙二醇(天津制药三厂)。实验仪器:美国产Microplate Reader血糖仪(罗氏公司罗康全活力型精密血糖仪);紫外可见分光光度仪(UV-2550);低速大容量多管离心机(Anke LXJ-IIB);电热恒温水浴箱(南京顺流仪器有限公司,批号:SC-15);酶标仪(MODEL550 BIO—RAD)。
1.2 方法
1.2.1 造模 实验动物 健康Wistar雄性大鼠60只,体质量180~220 g;由新疆医科大学实验动物中心提供,许可证号:SCXK(新)2003-0001。
Wistar雄性大鼠体质量(200±20)g,60只,室温18~22℃,湿度50% ~60%,明暗周期12/12 h,自由摄食、饮水。给予标准大鼠饲料(含碳水化合物53%,脂肪5%,蛋白质23%),适应性饲养一周后:除8只大鼠作为正常对照组给予普通标准饲料,其余大鼠给予高糖高脂饲料(基础饲料中食盐0.5%、白糖10%、猪油10%、蛋黄粉10%,胆固醇1%、猪胆盐0.5%,香油0.5%)喂养4周。4周后,正常对照组的大鼠一次性腹腔注射等量0.1 mol/L、pH 4.4枸椽酸缓冲液,其余则一次性腹腔注射STZ 45 mg/kg(STZ溶于0.1 mol/L pH 4.4枸椽酸缓冲液中)。3 d后尾静脉取血,用血糖仪测定空腹血糖值。若11.1 mmol/L≤空腹血糖值<33.3 mmol/L,确定为糖尿病成模大鼠。2周后再测血糖,血糖值居高不下证明模型稳定,予以选用进入正式实验。
1.2.2 分组及给药 将造模成功的40只大鼠随机分为4组:模型组((丙二醇灌胃,灌胃容积1 mL/100 g)、鹰嘴豆总皂苷低剂量组Ⅰ(鹰嘴豆总皂苷溶于丙二醇中100 mg/kg体质量灌胃)、鹰嘴豆总皂苷高剂量组Ⅱ(鹰嘴豆总皂苷溶于丙二醇中300 mg/kg体质量灌胃),二甲双胍组(二甲双胍100 mg/kg灌胃),另设正常对照组(丙二醇灌胃,灌胃容积1 mL/100 g)。灌胃周期均为4周。因在灌胃期间少量大鼠死亡,最后统计为每组8只。
1.2.3 检测指标及方法 实验结束后大鼠禁食12 h,先尾静脉取血测定血糖。再将大鼠麻醉后腹主动脉取血,离心取血清,ELISA法测定血清胰岛素和IL-6量。按试剂盒方法测血清游离脂肪酸量,肌、肝糖原一按蒽酮法进行测定,比色法测定骨骼肌己糖激酶活性。按文献方法[3]计算:胰岛素抵抗指数(Homa-IRI)=空腹血糖×空腹胰岛素/22.5。
1.3 统计学处理 采用SPSS16.0进行统计学处理,采用单因素方差分析,满足方差分析条件的用LSD作均数间的两两比较,不服从正态分布或是方差不齐的数据进行对数转换,满足条件后再作均数间的两两比较,所有数据均以均数±标准差(±s)表示,检验水准 α =0.05。
2 结果
2.1 各组大鼠体质量、空腹血糖(FPG)和胰岛素(FIns)水平情况比较 模型组大鼠体质量下降,但FPG和FIns较正常对照组显著升高(P<0.01),符合T2DM动物模型的特点。经过药物干预后,除TSCAⅠ组体质量有所降低(P<0.05),其余各组与模型组相比体质量无明显变化;给药各组大鼠FPG和IRI与模型组相比均有不同程度降低(P<0.05),其中二甲双胍组和TSCAⅡ组大鼠FPG显著降低(P<0.01),见表1。
表1 各组大鼠体质量、空腹血糖(FPG)和胰岛素(Fins)水平的情况(n=8±s)

表1 各组大鼠体质量、空腹血糖(FPG)和胰岛素(Fins)水平的情况(n=8±s)
注:与正常对照组相比,#P<0.05,##P<0. 01;与模型组相比,*P <0.05,**P <0.01。下同。
组别 体质量/g FPG/(mmol/L)Fins/(ng/mL)正常对照组418.18 ±31.70 3.58 ±0.53 0.81 ±0.23模型组 313.8 ±20.16##26.27 ±6.61##2.11 ±1.00##二甲双胍组 307.4 ±31.70 13.28 ±8.96**1.12 ±0.26*鹰嘴豆总皂苷低剂量组Ⅰ 275.55 ±38.24* 17.95 ±5.19* 1.07 ±0.33*鹰嘴豆总皂苷高剂量组Ⅱ 306.19 ±30.29 15.09 ±4.81**0.95 ±0.55**
2.2 各组大鼠胰岛素抵抗指数(IRI)、血清白介素-6(IL-6)和游离脂肪酸(FFA)量的变化 模型组大鼠IRI、FFA浓度和IL-6量显著升高(P<0.01);药物干预4周后,TSCAⅡ组各指标均显著下降(P<0.01),TSCAⅠ组大鼠血清中IL-6量无显著变化(P>0.05),血清 FFA浓度升高(P<0.05),见表2。二甲双胍组胰岛素抵抗指数显著降低(P<0.01),但对于IL-6及FFA无显著影响。
表2 各组大鼠胰岛素抵抗指数(IRI)、血清白介素-6(IL-6)和游离脂肪酸(FFA)水平的变化(n=8±s)
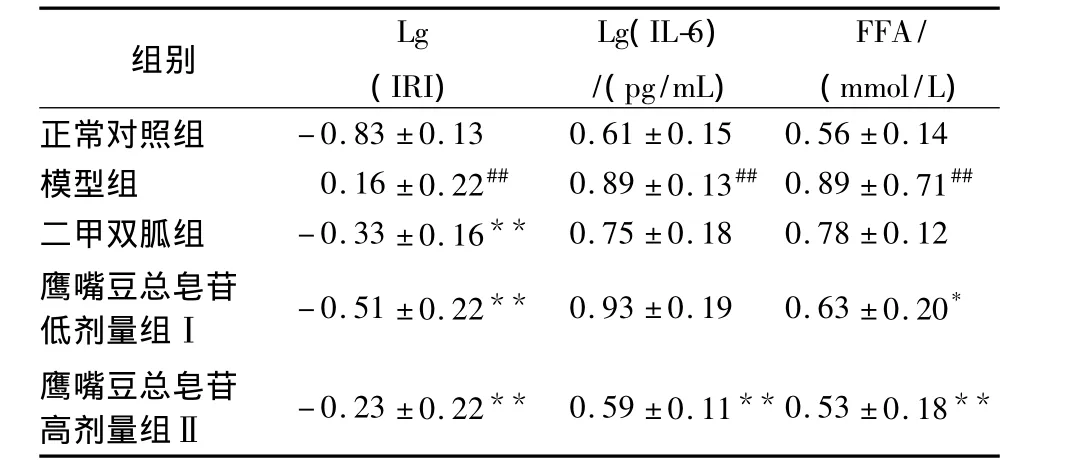
表2 各组大鼠胰岛素抵抗指数(IRI)、血清白介素-6(IL-6)和游离脂肪酸(FFA)水平的变化(n=8±s)
组别Lg(IRI)Lg(IL-6)/(pg/mL)FFA/(mmol/L)正常对照组 -0.83 ±0.13 0.61 ±0.15 0.56 ±0.14模型组 0.16 ±0.22## 0.89 ±0.13##0.89 ±0.71##二甲双胍组 -0.33 ±0.16** 0.75 ±0.18 0.78 ±0.12鹰嘴豆总皂苷低剂量组Ⅰ -0.51 ±0.22** 0.93 ±0.19 0.63 ±0.20*鹰嘴豆总皂苷高剂量组Ⅱ -0.23 ±0.22** 0.59 ±0.11**0.53 ±0.18**
2.3 各组大鼠肌糖原(MG)和肝糖原(HG)量及骨骼肌中己糖激酶(HK)活性的变化 与正常对照组相比,模型组大鼠MG和HG量均显著降低(P<0.01),HK活性降低(P<0.05)。药物干预4周后,与模型组相比,TSCA各组大鼠的MG和HG量及HK活性明显升高(P<0.05或P<0.01),其中MG尤为明显,见表3。
表3 各组大鼠肌糖原(MG)和肝糖原(HG)量及骨骼肌己糖激酶(HK)活性的变化(n=8±s)
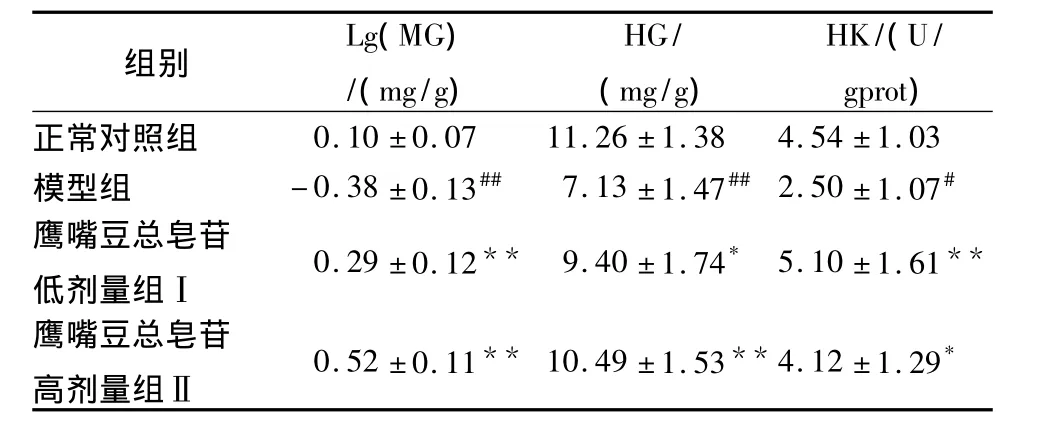
表3 各组大鼠肌糖原(MG)和肝糖原(HG)量及骨骼肌己糖激酶(HK)活性的变化(n=8±s)
注:与正常对照组相比,#P<0.05,##P<0. 01;与模型组相比,*P <0.05,**P <0.01。
组别Lg(MG)/(mg/g)HG/(mg/g)HK/(U/gprot )正常对照组0.10 ±0.07 11.26 ±1.38 4.54 ±1.03模型组 -0.38 ±0.13## 7.13 ±1.47##2.50 ±1.07#鹰嘴豆总皂苷低剂量组Ⅰ0.29 ±0.12** 9.40 ±1.74* 5.10 ±1.61**鹰嘴豆总皂苷高剂量组Ⅱ0.52 ±0.11** 10.49 ±1.53**4.12 ±1.29*
3 讨论
大多数T2DM患者并发肥胖,而过多的脂肪组织释放FFA,使血清FFA水平增高[4]。研究显示脂肪细胞产生的游离脂肪酸(FFA)升高是导致胰岛素抵抗的重要原因之一。糖尿病大鼠由于胰岛素生物活性不足,激素敏感性脂肪酶活性增加,使糖原生成不足,产生葡萄糖利用障碍,机体抗脂解作用降低,从而使FFA水平升高直接导致胰岛素抵抗(IR)[5]。FFA升高可抑制葡萄糖的氧化途径,通过竞争性抑制葡萄糖的氧化从而降低葡萄糖的酵解[6]。糖酵解的降低使6-磷酸葡萄糖(G-6-P)水平升高,抑制己糖激酶活性,从而降低细胞对葡萄糖的摄取,致使血糖升高,这一过程被称作葡萄糖—脂肪酸循环学说。游离脂肪酸增加可使糖原合成酶亚单位分离,失去其生物活性,这是糖原合成的限速步骤[7]。并对肌糖原合成有抑制作用。炎症因子白介素-6在胰岛素抵抗过程中也有重要的作用。通过影响血糖和血脂的代谢过程,抑制胰岛β细胞的功能,下调脂肪细胞胰岛素转导信号从而产生胰岛素抵抗[8]。IL-6还能够诱导小鼠的肝细胞和HepG2细胞表达细胞因子信号转导抑制因子,通过抑制胰岛素受体信号转导而阻止胰岛素发挥作用[9-10]。
本实验通过给予高热量饲料STZ和诱导的糖尿病大鼠显示出典型的胰岛素抵抗特征.血清FFA水平和IL-6与正常对照组相比明显升高,给予T2DM大鼠鹰嘴豆总皂苷4周后,血糖及血清胰岛素水平显著降低,其中鹰嘴豆总皂苷高剂量组Ⅱ作用接近二甲双胍组。鹰嘴豆总皂苷干预后,大鼠血清FFA水平和IL-6量显著下降.提示鹰嘴豆总皂苷可能通过降低血清中FFA水平和IL-6量,缓解胰岛素抵抗。此作用在二甲双胍组中不明显。
己糖激酶是糖代谢的第一个关键酶,也是葡萄糖以糖原形式贮存通路中的第一个限速酶,与糖原的合成分解密切相关。在肌肉中催化葡萄糖转化为葡萄糖-6-磷酸(G-6-P),此反应在生理条件下是不可逆的,需要ATP的参与[11],它与细胞膜上葡萄糖转运蛋白(GLUT4)在功能上相互偶联,决定细胞内葡萄糖流量。增加己糖激酶活性可增加糖酵解并增加葡萄糖转化为能量被有效利用[12]。本研究结果显示,HK活性:鹰嘴豆总皂苷低剂量组Ⅰ>正常对照组>鹰嘴豆总皂苷高剂量组Ⅱ>模型组;肌糖原增加。提示鹰嘴豆总皂苷可通过增加糖尿病大鼠骨骼肌中HK活性促进肌糖原的合成贮存,减少血液中游离的葡萄糖,促使T2DM大鼠血糖降低。肝糖原增加与HK无直接关系,但结果表明,鹰嘴豆总皂苷的降糖机制与增加糖的利用和贮存有关。
[1]王玉芹,陈 娜,阿吉艾克拜尔·艾萨.维药鹰嘴豆及活性部位降血糖作用研究[J].中成药,2007,12:1832-1833.
[2]董晓全,刘君琳,顾政一.鹰嘴豆降血糖有效部位的药效学筛选[J].中国民族民间医药,2008,2:4-6.
[3]李光伟,潘孝仁,Lillioja S,等.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,32:656-659.
[4]Li Ling,Yang Gangyi.Effect of hepatic glucose production on acute insulin resistance induced by lipid—infusion in awake rats[J].World J Gastroenterol,2004,10(21):3208-3211.
[5]Roden M,Stingl H,Chandramouli V,et al.Effects of free fatty acid elevation on postabsorptive endgenous glucose production and gluconeogenesis in humans[J].Diabetes,2000,49(5):701-707.
[6]Randle PJ,Carland PB,Hales CN,et al.The glucose-fatty acid cycle:its role in insulin sensitivity and metabolic disturbances of diabetes mellitus[J].Lancet,1963,1:785-789.
[7]Boden G,Chen X,Ruiz J.et al.Mechanisms of fatty acid-induced inhibition of glucose uptake[J].J Clin Invest,1994,93:2438.
[8]Zozulinska D,Wierusz-Wysocka B.Type 2 diabetes mellitus as inflammatory disease[J].Diabetes Res Clin Pract,2006,74:S12-S16.
[9]Senn JJ,Klover PJ,Nowak IA,et al.Suppressor of cytokine signaling-3(SOCS):a potential mediator of interleukin-6-dependent insulin resistance in hepatocytes[J].J Biol Chem,2003,278(16):137402-137406.
[10]Shimizu H,Sato N,Tanaka Y,et al.Interleukin-6 stimuhtes insulin secretion in HIT—T 15 cells[J].Horm Metab Res,1995,47:89-94.
[11]Laakso M,Malkki M,Deeb SS.Amino acid substitutions in hexokinase II among patients with NIDDM[J].Diabetes,1995,44:330-334.
[12]杨宏莉,张宏馨,李兰会,等.本草消渴丹对实验性糖尿病大鼠糖代谢酶活性的影响[J].时珍国医国药,2009,20(9):615-617.
R966
B
1001-1528(2011)08-1405-03
2010-07-20
新疆维吾尔自治区自然科学基金(200821109);中国科学院西部行动高新技术计划项目(KGCX2-YW-503)
凯赛尔·阿布都克热木(1970—)男(维吾尔族),博士生,研究方向:心血管药理学。
*通信作者:帕尔哈提·克热木(1960—),男(维吾尔族),博士,教授,博士生导师,研究方向:心血管药理及植物提取物药效学的研究。E-mail:parhatke@vip.sina.com
阿吉艾克邦尔·艾萨(1965—),男(维吾尔族),博士,研究员,博士生导师,主要从事天然产物研究与开发。Tel:(0991)3835679,Email:Haji@mx.xjb.ac.cn

