PCR-DGGE法研究Sludge bio-membrane(SB)系统中反硝化聚磷菌的变化
刘晖,孙彦富,周康群,顾雪婷,刘洁萍,陈捷美
(仲恺农业工程学院 环境科学与工程系,广东 广州,510225)
控制并降低污水中的氮、磷浓度是防止水体富营养化的主要措施,因此,生物同步脱氮除磷技术是目前国内外污水处理研究领域的重点和热点。在污水处理厂的实际运行过程中发现有一类反硝化聚磷菌(即DPB),其在厌氧条件下吸收有机物同时合成为细胞内储备营养物PHB(聚β-羟基丁酸)并释放正磷酸盐,而在缺氧环境下利用硝酸盐作为电子受体,进行反硝化作用的同时超量聚磷,使除磷和脱氮这2个生物过程在缺氧环境下由同一类微生物一并完成。由此开发的工艺不仅降低了脱氮对碳源的需要,而且可节省好氧聚磷所需能源和池容,此外,剩余污泥量也大大降低[1-3],是一种低碳节能高效的新技术。目前,国内反硝化聚磷的研究多利用 SBR反应器在实验室采用人工模拟废水进行研究[4-6],但是,利用连续流的SB活性污泥与生物膜复合系统(SB系统)、采用实际的污水来进行同步反硝化聚磷的研究报道较少。国内外对菌富集过程中反硝化聚磷菌种类的变化研究很少,仅周康群等[4-6]对反硝化聚磷SBR系统中的微生物组成采用传统的微生物方法进行了研究。迄今为止,采用PCR-DGGE技术对SB系统在富集过程中微生物种群变化的系统研究尚未见文献报道。本研究采用SB系统富集反硝化聚磷菌,以3个处理阶段的泥水混合液为研究对象,进行了微生物种群变化的跟踪与研究。为研究SB系统中的种群多样性及其作用微生物学机理,从运行不同时期装置中提取污水混合液,利用平板分离法和 PCR-DGGE法同步跟踪不同驯化富集阶段反硝化聚磷菌种群的变化情况,以便为反硝化聚磷工艺富集功能菌株及机理的进一步研究提供参考,为传统的脱氮除磷工艺的改良、新工艺的开发与应用提供帮助。
1 材料与方法
1.1 试验反应装置
研究采用Sludge bio-membrane(SB)系统试验装置见图1。进水流量为1 m3/d,各处理单元的操作分别为:(1) 厌氧活性污泥释磷区:水力停留时间(HRT)为3.3 h,氧化还原电位(ORP)小于-100 mV;(2) 快速沉淀区:HRT为0.32 h;(3) 生物膜区:HRT为2.2 h,ORP大于+200 mV;(4) 兼性脱氧区:HRT为0.6 h,ORP小于+50 mV;(5) 缺氧活性污泥反硝化聚磷区:HRT为2.7 h,ORP为0~-100 mV;(6) 微曝气区:HRT为0.15 h;(7) 沉淀区:HRT为0.3 h。
1.2 供试材料
1.2.1 试验污水
试验污水来自广州市某污水处理厂的实际污水,其水质情况见表1。
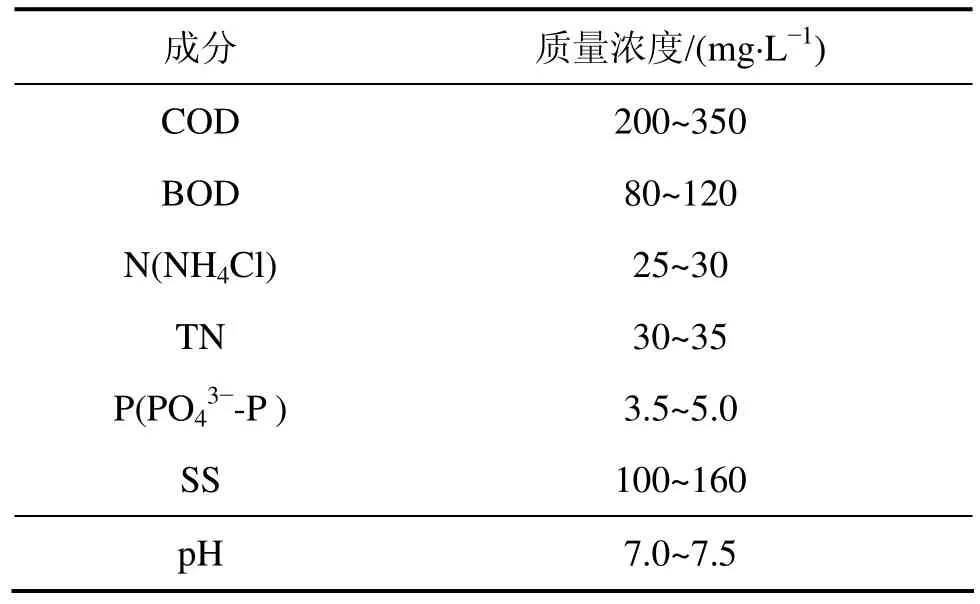
表1 试验污水成分Table 1 Composition of sewage wastewater
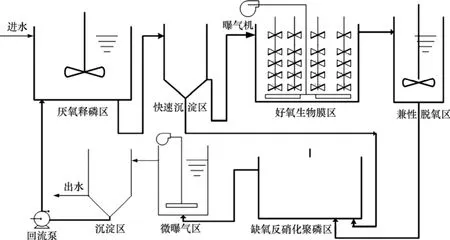
图1 活性污泥与生物膜复合系统Fig.1 Activated sludge and bio-membrane combined system
1.2.2 Sludge bio-membrane(SB)同步脱氮除磷系统的运行方案
取自运行良好污水处理厂A2/O厌氧段活性污泥。将种泥与表 1中的试验污水混合(ρ(MLSS)=3.5~4.0 g/L),以生物膜区氨氧化反应后产生的硝酸盐为电子受体富集反硝化聚磷菌。运行方案分3个阶段,先分段运行后连续运行。
第1阶段为膜硝化池的启动阶段。目的是对系统中的硝化菌进行富集从而将污水中的氨氮转化为硝酸盐氮,为后2阶段富集反硝化聚磷菌提供硝酸盐氮的电子受体。将运行良好的广州沥滘污水厂 A2/O工艺好氧段活性污泥与广州某污水处理厂污水混合,ORP控制在80~100 mV,共运行3月。
第2阶段为反硝化聚磷菌的富集、设备调试阶段。该阶段的目的是:(1) 去除常规的反硝化菌(仅有反硝化作用而无聚磷作用);(2) 通过对厌氧释磷池和同步反硝化吸磷池交替运行,利用接触氧化池产生的硝酸盐为电子受体,对反硝化聚磷菌进行选择和富集,该段是整个试验的关键。当第1阶段的好氧膜硝化池中氨氮转化为硝酸盐氮的转化率稳定在90%以上后,设备进入第2阶段,即同时启动厌氧释磷区、快速沉淀区、好氧生物膜区、兼性脱氧区、缺氧反硝化聚磷菌区、微曝气区和二次沉淀区。其过程为:好氧释磷区(3.30 h)→快速沉淀区(0.32 h)→好氧生物膜区(2.20 h)→兼性脱氧区(0.20 h)→缺氧反硝化聚磷区(2.70 h)→微曝气区(0.15 h)→二次沉淀区(0.34 h)方式运行,初始污泥质量浓度控制在2.0~2.5 g/L,缺氧ORP为-100~-120 mV,厌氧ORP为-150~-220 mV,共运行6月。
第3阶段为体系的稳定阶段。目的是:反硝化聚磷菌富集到一定量后,进一步保持体系的稳定性,装置共运行40 d。
当第3阶段运行到39 d时,出水TP质量浓度为0.65 mg/L(<1.00 mg/L),总氮质量浓度为 12.6 mg/L(<15.0 mg/L),氨氮质量浓度为3.8 mg/L(<5.0 mg/L),COD质量浓度为34 mg/L(<50 mg/L),均低于GB18918—2002标准的要求。系统出水TP、总氮、氨氮、COD浓度变化幅度都较小,由此进一步说明体系进入稳定运行。
本试验采用第2阶段开始和第3阶段末期反硝化聚磷区的污泥(此时硝酸盐去除率高达 90.26%,磷酸盐的去除率高达 92.31%)为研究种泥,将其分离纯化后的纯菌株作为研究对象。
1.2.3 聚磷菌培养液
无水乙酸钠 5.0 g,KH2PO40.025 g,MgSO4·7H2O 0.5 g,CaCl2·H2O 0.2 g,(NH4)2SO42.0 g,微量元素 1.0 mL,蒸馏水1 000 mL,pH=7.0。
1.3 试验方法
1.3.1 反硝化聚磷菌株的分离
将 1.2.2中的研究种泥接种于牛肉浸膏蛋白胨培养基,将最佳稀释度平板上单一菌落经过平板划线纯化得单菌株,用甘油混匀密封冷藏。
1.3.2 同步反硝化聚磷菌株显微形态观察、生理生化指标
将幼龄菌落进行革兰氏染色,在100×10倍光学显微镜下观察颜色和形态。进行产氨试验、硝酸盐还原、亚硝酸盐还原、反硝化、异染粒、PHB染色等主要生化特性[7]试验。
1.3.3 DNA提取、PCR扩增、基因序列比对及进化树构建
对获得的培养物进行离心收集沉淀,用 TE缓冲液(pH=8.0)洗涤,通过溶菌酶裂解和冻融步骤裂解细胞,以 SDS和酚/氯仿提取基因组 DNA。16S rRNA基因扩增采用寡聚核苷酸引物27 f和1522 r。PCR扩增程序:于94 ℃预变性4 min,于94 ℃变性1 min,于55 ℃复性1 min,于72 ℃延伸2 min,30次循环,最后于72 ℃延伸7 min。扩增产物送上海英骏生物技术有限公司测序。所得 16S rDNA基因序列,在GenBank数据库中进行 BLAST序列的相关性搜索[8-9]。同时,利用相关种属的16S rDNA序列,构建系统发育树。序列对排用CLUSTAL X1.83 进行多序列匹配排列,进化树的构建用Neighbour-joining方法。进化树分枝模式的稳定性用MEGA 4.0进行bootstrap分析,重复1 000次,计算各分支的支持度。
1.3.4 PCR-DGGE的试验过程
(1) 样品 DNA的制备。采用修改后的 Bead-Beating法[10],样品中加入20 mL抽提缓冲液(0.1 mol/L Tris·Cl,0.1 mol/L EDTA-Na2,0.2 mol/L NaCl,1%PVP,2% CTAB,pH=8.0),浸泡 30 min,超声波 15 min,加入10 mg/mL的溶菌酶,于37 ℃振荡45 min。加入1.5 mL 20%SDS,65 ℃水浴1 h。离心后收集上清。上清用酚、氯仿、异戊醇(体积比为25:24:1)抽提3次,并加入终浓度为0.3 mol/L的NaAc(pH=5.2)及0.6倍NaAc溶液体积的异丙醇,于室温沉淀1 h。转速为13 000 r/min,离心20 min,收集沉淀,并用70%乙醇漂洗2次,晾干后溶于50 µL TE中。采用0.8%琼脂糖凝胶电泳检测。
(2) 16S rDNA-V3区扩增。将样品分别稀释50倍后进行 16SrDNA-V3区扩增。引物对为 F357(含 GC夹子):5’CGCCCGCCGCGCGCGGCGGGCGGGGCG-GGGGCACGGGGGGCCTACGGGAGGCAGCAG3’,R518:5’ATTACCGCGGCTCGCTGG 3’。25 µL 的反应体系包含 H2O 0.25 µL,10×Buffer(含 2.0 mol/L MgCl2)2.0 µL,dNTP(10 mol/L) 1.0 µL,F338(10 µmol/L)1.0 µL,R518(10 µmol/L)1.0 µL,Taq(5 U/µL) 0.1 µL和模板DNA 1.0 µL。反应程序为:于94 ℃预变性4 min;于94 ℃变性0.5 min;于52 ℃复性1 min;于72 ℃延伸0.5 min;30次循环,于72 ℃延伸7 min。反应结果用1.2%琼脂糖凝胶电泳检测。
(3) DGGE的实验过程。DGGE采用 BIO-RAD DGGE电泳仪。聚丙烯酰胺凝胶浓度为 8%,变性梯度为35%~65%(100%变性剂含有7 mol/L尿素和40%甲酰胺),电泳条件为:60 ℃,180 V,电泳5 h。0.04‰的 Goldview染液 30 min后用凝胶成像系统(GDS-8000)照相。
(4) DNA的回收和PCR扩增测序。将DGGE切胶回收所得的条带中加入适量的无菌水于 4 ℃浸泡 24 h,用作模板使用。将样品进行16SrDNA-V3区扩增。引物对为 F338:5’ATTACCGCGGCTCGCTGG 3’,R518:5’ATTACCGCGGCTCGCTGG 3’。25 µL 的反应体系包含H2O 0.25 µL,10×Buffer(含2.0 mmol/L MgCl2)2.0 µL,dNTP(10 mmol/L)1.0 µL,F338(10µmol/L)1.0 µL,R518(10 µmol/L)1.0 µL,Taq(5 U/µL)0.1 µL和模板DNA 1.0 µL。反应程序为:于94 ℃预变性5 min;于94 ℃变性30 s;于55 ℃复性40 s;于72 ℃延伸40 s;30次循环,于72 ℃延伸7 min,测序由上海英骏生物公司进行。
2 结果与讨论
2.1 利用微生物分离和纯化的结果
在第2和第3阶段分别分离出单菌株17株和11株。结合细菌的主要生理生化指标[7]和16S rDNA测序鉴定结果见表2。
从表2可以看出:第2阶段的细菌主要为棒状杆菌属、不动杆菌属、假单胞菌属、肠杆菌科、莫拉氏菌属、葡萄球菌属、副球菌属等7种,第3阶段的细菌主要为组成为不动杆菌属、假单胞菌属、肠杆菌科、副球菌属4种,即富集后系统内细菌种类在减少,而周康群等[4-5]在SBR反应器中分离到的反硝化聚磷菌以假单胞菌属、棒状杆菌属为主,肠杆菌科和葡萄球菌属次之。罗宁等[6]在A2/O-SBR反应器中分离到的假单胞菌属、莫拉氏菌属、肠杆菌科细菌、气单胞菌属以及不动杆菌属与生物反硝化脱氮和生物除磷密切相关,占全部菌株的66.16%。导致结果产生差异的原因是:试验采用Sludge bio-membrane (SB)同步脱氮除磷系统,进水水质是污水处理厂的实际污水,废水中的碳源成分复杂;而罗宁等[6]采用实验室自配水样,以醋酸钠为主要碳源;此外,运行条件不同,因此,活性污泥系统内微生物组成和数量存在一定的差异。这说明反应器中微生物种群组成和变化反映了生物脱氮除磷体系运行状况。
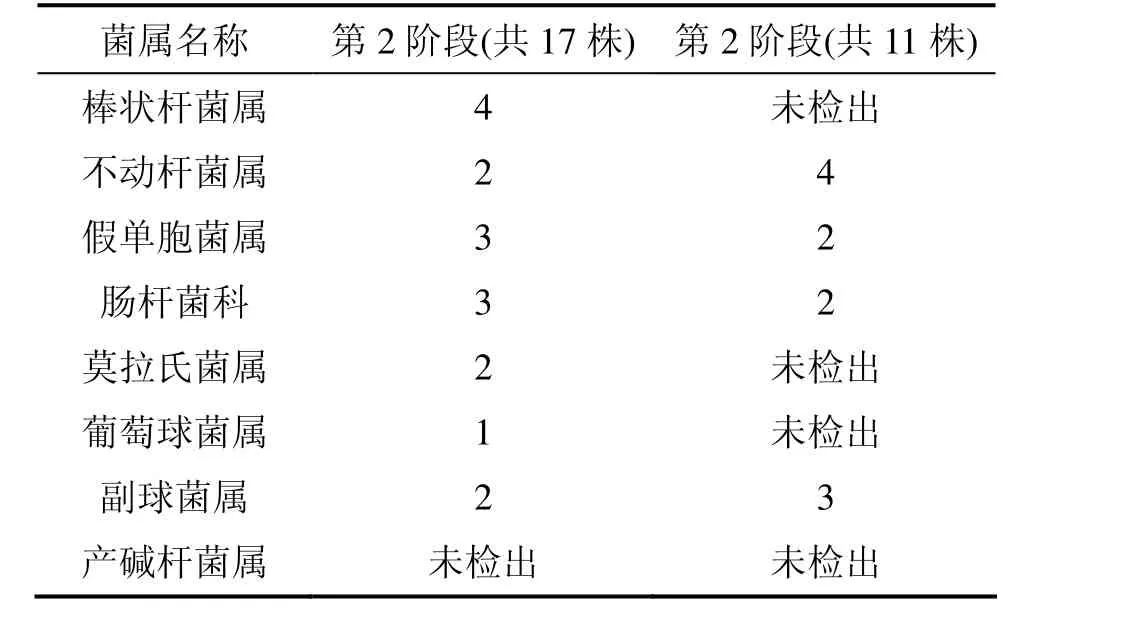
表2 SB同步脱氮除磷系统不同阶段中主要的细菌数量Table 2 Main bacteria of SB simultaneously nitrogen and phosphorus removal system during different stages 个
2.2 采用PCR-DGGE分析SB系统微生物的多样性
2.2.1 DGGE图谱分析
图2中的样品分别取自第2阶段的开始(即反硝化聚磷菌富集前,泥样 A)和第 3阶段的末期(即富集反硝化聚磷菌,泥样B),从图2可知:泥样B的DGGE图谱在某些位置与泥样A的比较接近,但在某些位置存在着一些差异。在样品A中a,b,c,d和e条带较亮,条带较多这说明富集前菌种丰富,不同条带间的位置较远而且很亮,说明菌种之间的差异比较明显,充分显示了装置中微生物的多样性。分析其原因是由于富集前种泥取自A/A/O工艺厌氧池,A/A/O工艺为一个单泥系统,具有丰富的微生物种群,主要有聚磷菌、反硝化菌等兼性厌氧菌。
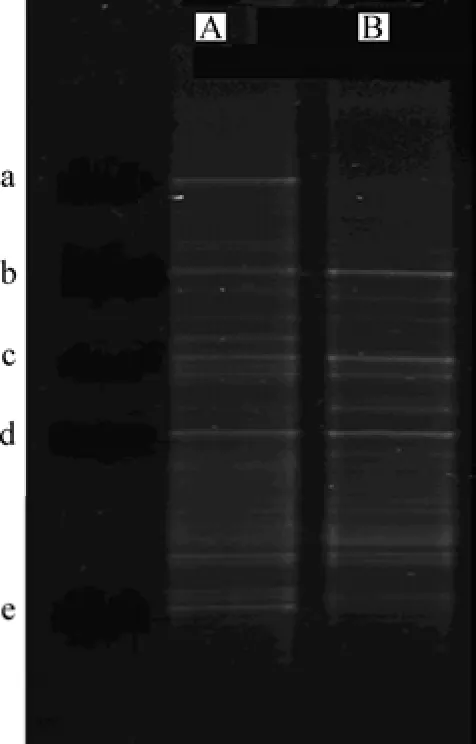
图2 DGGE图谱Fig.2 Profile of DGGE
经过富集培养后,样品B中的b,c和d条带存在,而且较亮,但是,a和e条带消失,这说明经过一段时间的富集培养,水体中占优势的微生物种群减少了2种,微生物的多样性呈下降趋势。这说明富集的方式有利于反硝化聚磷菌的生长。
2.2.2 代表条带的回收测序和进化分析
选取较有代表性的条带a,b,c,d和e切胶回收DNA后作为模板进行PCR扩增,对产物直接测序。使用GenBank的BLAST程序将富集前后的5条序列与数据库中已登录的序列进行同源性比较,采用Clustal W(Versionl.8)进行多序列匹配排列,选取核酸数据库中的序列,用Neighbour-joining方法构建进化树,进化树分枝模式的稳定性用 MEGA4.0软件进行bootstrap分析,重复1 000次,计算各分支的支持度,结合伯杰氏细菌鉴定手册和常见细菌鉴定手册[7-10]的生理生化指标为依据鉴定归属。结果如下:
(1) a和Flavobacterium sp.(黄杆菌属)的亲缘关系最接近,序列同源性为95%,黄杆菌属[11-12]是革兰阴性杆菌,直杆状,端圆,宽度×长度为(0.5~0.8) µm×(1.0~3.0) µm,非发酵型,在含碳水化物培养液内的反应一般不产酸也不产气,也有兼性厌氧型,菌落呈黄色或橙色而得名。有机化能营养,接触酶、氧化酶、磷酸酶均为阳性,细胞内不含聚β-羟基丁酸盐,有些菌株能还原硝酸盐和亚硝酸盐。同时,结合反应器中硝酸盐去除率高达90.26%,因此,a与Flavobacterium sp.(黄杆菌属)最相似,是反硝化菌。
(2) b和Alcaligenes sp.DQ435021(产碱杆菌属)的亲缘关系最接近。通过对其基因进行比对,序列的同源性为96%。产碱杆菌属是革兰阴性杆菌,化能异养型,能够利用醋酸钠为碳源,呼吸代谢为非发酵类型,具有好氧反硝化特性。有的在硝酸盐或亚硝酸盐存在,能通过厌氧呼吸进行反硝化,硝酸盐和亚硝酸盐作为电子受体,从而产生氮气[13]。鲍林林等[13-15]报道产碱菌属表现出良好的反硝化吸磷效果。由此认为b与产碱杆菌属Alcaligenes sp.最相似,是反硝化聚磷菌。
(3) c与Paracoccus sp.(副球菌属)最相似,序列的同源性为94%。副球菌属球形,呈单个、成对或堆存在,直径为(0.5~0.9) µm,不运动。当硝酸盐、亚硝酸盐或氧化氮存在时,能以它们为电子受体进行厌氧生长,并且在厌氧条件下将硝酸盐还原为亚硝酸盐到氧化氮和N2,因此,表现为反硝化功能。同时氧化酶和接触酶反应呈阳性。
(4) d和Janthinobacterium sp. (紫色杆菌属)亲缘关系最为接近,序列的同源性为96%。紫色杆菌属由于其菌落呈紫色而得名[16-17],具有圆端的杆菌,稍弯曲,为革兰氏阴性杆菌,无运动性,无荚膜。其生理特性为:既是氧化型又是发酵型,接触酶阳性,吲哚阴性,磷酸酶阳性,还原硝酸盐和亚硝酸盐,有时产生气体,由胨产生氨即具有反硝化功能。但尚未报道是否具有反硝化聚磷功能,由此推断得出d与Janthinobacterium sp.(紫色杆菌属)最相似,同时是一种反硝化菌。
(5) e为赤细菌属(Erythrobacter sp.),序列的同源性为97%,由于其培养物及菌落呈橘黄色或粉色而得名,是一种光合细菌,具有营养、净化水体等作用[18],多发现在养殖密集区和海洋中。赤杆菌属是革兰氏阴性杆菌,好氧,化能异养型,兼性光能异养型。可利用的碳源为:醋酸盐、丙酮酸盐、丁酸盐、谷氨酸盐及葡萄糖。生长需要维生素。最佳生长温度为 25~30℃;pH为7.0~8.0;需要1.7%~3.5% NaCl,能将硝酸盐还原为亚硝酸盐。由此推断得出e与Erythrobacter sp.最相似,具有反硝化功能。
综上所述,a应归属于Flavobacterium sp.(黄杆菌属,属Flavobacteria),b应归属于Alcaligenes sp.(产碱杆菌属 β-proteobacteria),c应归属于 Paracoccus sp.(副球菌属,属 α-proteobacteria),d应归属于Janthinobacterium sp.(紫色杆菌属 β- proteobacteria),e应 归 属 于 Erythrobacter sp.(赤 细 菌属α-proteobacteria)。其中:b和 c为反硝化聚磷菌,a和e为反硝化菌,d是反硝化菌,但其聚磷功能有待进一步研究。
2.2.3 富集前后的群落结构差异
在样品A中a,b,c,d和e条带较亮,分别鉴定为黄杆菌属、产碱杆菌属、副球菌属、紫色杆菌属、赤细菌属,其中产碱杆菌属、副球菌属为反硝化聚磷菌,紫色杆菌属、黄杆菌属、赤细菌属为反硝化菌。这说明反硝化聚磷菌存在于A/A/O工艺的厌氧池中,只是由于A/A/O工艺的运行方式不能使其成为优势种群,也有可能是反硝化聚磷菌在A/A/O工艺运行中体现了其好氧聚磷的特点。
B水样中的代表条带为3条,分别为黄杆菌属、副球菌属、紫色杆菌属。从图2可以看出:7种菌经过富集后减少为4种,这显示SB同步脱氮除磷系统富集后微生物的多样性有所下降。这是因为通过富集运行后,采用反硝化聚磷工艺给聚磷菌提供了厌氧缺氧交替的环境,而且控制污水中 COD质量浓度。在
厌氧释磷后经过沉淀大大降低污水中COD质量浓度,致使缺氧池进水COD的质量浓度低于50 mg/L,消除残余 COD对反硝化聚磷菌的影响,限制了大部分常规反硝化菌的生长,因此减少了污泥中专职的反硝化菌,从而使仅具有反硝化功能的赤细菌属被淘汰,种群多样性随之降低[5],但反硝化聚磷功能的产碱杆菌属、副球菌属仍然存在,充分说明系统的富集方式有利于反硝化聚磷菌的生存。但另一方面是富集后d条带(紫色杆菌属)很亮,反应池中硝酸盐去除率高达90.26%,磷酸盐的去除率高达92.31%,紫色杆菌属的生理生化指标确定其为反硝化菌,而且从图3所示的系统进化树可知产碱杆菌属、副球菌属、紫色杆菌属3种菌属的亲缘关系接近,而黄杆杆菌属和赤细菌属的亲缘关系较远,因此,紫色杆菌属的聚磷功能有待于进一步确定。
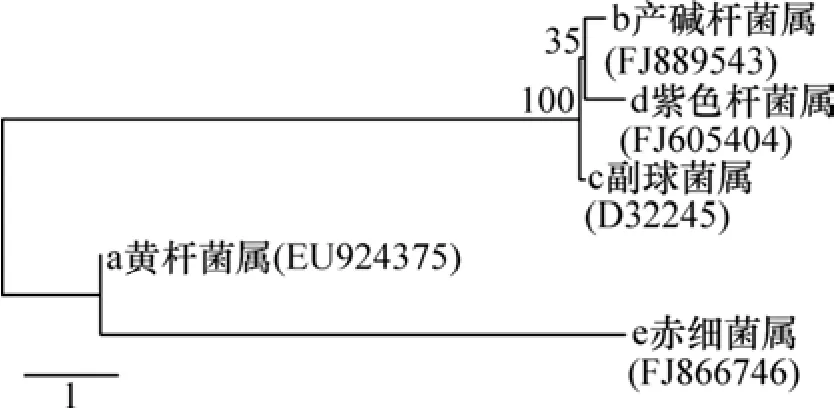
图3 SM系统中优势菌群的系统进化树Fig.3 Phylogenic tree construction of dominate bacteria in SM system
2.2.4 PCR-DGGE法与平板法的比较
从表2可以看出:富集后的细菌主要为不动杆菌属、假单胞菌属、肠杆菌科、副球菌属4种。而通过PCR-DGGE分析后可知:富集后主要的反硝化聚磷菌为产碱杆菌属、副球菌属2种,仅有副球菌属为2种方法同时获得的唯一菌属。这是因为利用平板分离技术,培养基单一,而且受到培养条件的限制,得到的菌种类有限;而利用 DGGE-PCR技术得到的菌种多样、丰富,但是由于该方法也有其自身的局限性, 有些平板分离后的菌种仍无法被显示, 因此,二者的试验结果重合度并不高。其他菌种对系统反硝化除磷能力的贡献还有待于进一步深入研究。
副球菌属是唯一通过2种办法获得确认反硝化聚磷功能的菌株。周康群等[4]采用传统方法从SBR反应器中分离的反硝化聚磷菌(DPB)以假单胞菌属、棒状杆菌属为主,肠杆菌科和葡萄球菌属次之。蒋轶锋等[19]采用 PCR-DGGE技术分离的 DPB为 gamma-Proteobaccteria亚纲中的 Chromatiaceae属(相似性98%),Ahn等[20]采用PCR-DGGE技术分离的DPB主要有红环菌属 Rhodocyclus sp.(96%相似度)和Dechlorimonas sp. (97%同源性),它们都是属于变形菌。然而,通过 FISH只发现了红环菌属。Tsuneda等[21-22]从厌氧/好氧 SBR池中污泥分离到的 DPB为Thauera mechernichensis (83%相似度)和固氮弧菌属Azoarcus tolulyticus (83%相似度),其都属于红环菌属。副球菌属是国内外首次报道的反硝化聚磷菌。
2.2.5 PCR-DGGE法与16S rDNA克隆法的比较
本实验中采用DGGE的结果检测到的细菌有:黄杆菌属(Flavobacteria纲,为bacteroidetes门),产碱杆菌属(β-proteobacteria 纲),副球菌属(α-proteobacteria纲),紫色杆菌属(β-proteobacteria 纲),Erythrobacter sp.(赤 细 菌 属 α-proteobacteria)即 以 变 形 门(proteobacteria)为主,此与焦中志等[14,23]的研究结果一致。焦中志等[14]采用平板分离法发现假单胞菌属和产碱菌属的脱氮除磷效果最好,采用DGGE法发现系统中反硝化聚磷菌优势种群可主要分为7个群, 分别是 Anaerolineae(属), Actinobacteria(放线菌纲),Bacteroidetes (拟杆菌门),TM7,α-proteobacteria(变形纲),δ-proteobacteria(变形纲)和 γ-proteobacteria(变形纲)菌群,其中,Actinobacteria(放线菌纲)和γ-proteobacteria为优势的反硝化聚磷菌。而本试验中发现经过富集培养以后产碱杆菌属保持优势,也从另一方面证明了产碱杆菌属为反硝化聚磷菌。王海燕等[23]采用16S rDNA克隆文库方法对高效同步脱氮除磷系统的细菌进行了多样性研究。结果表明:系统中优势细菌类群为Proteobacteria类群(变形菌类群),占55.17%;细菌类群优势顺序为 γ-Proteobacteria类群(34.48%),Bacteroidetes类群(似杆菌类群,20.69%),β-Proteobacteria类群(12.07%),Candidate division TM7类 群 (12.07%), α-Proteobacteria 类 群 (5.17%),δ-Proteobacteria 类群(3.45%),Firmicutes类群(厚壁菌类群,3.45%),Candidate division OP11类群(1.72%)和Planctom ycetes类群(浮霉状菌类群, 1.72%)。因为克隆法所获得的基因序列非常短,因此,很多细菌无法鉴定到属,故研究系统内的微生物全面但不明确,而采用 PCR-DGGE法获得的基因序列长达几百,因此,细菌明确,但是,因为只能在某些较亮的光带上才能提取基因序列,因此,无法全面反映系统中微生物的多样性,故采用不同的研究方法、从不同的研究角度才能全方位了解系统内部微生物的多样性和复杂性。
无论采用PCR-DGGE研究SB同步脱氮除磷系统和SBR池中的优势菌,以及采用16S rDNA克隆文库方法研究高效同步脱氮除磷系统的细菌,都以变形门(proteobacteria)占优势。
3 结论
(1) 通过平板法分离到的微生物主要为棒状杆菌属、不动杆菌属、假单胞菌属、肠杆菌科、莫拉氏菌属、葡萄球菌属、副球菌属共7种,富集后细菌主要为不动杆菌属、假单胞菌属、肠杆菌科、副球菌属 4种,即富集后系统内细菌种类减少,与采用SBR池富集的反硝化聚磷菌种类不同。
(2) 采用DGGE法发现样品富集前以黄杆菌属、产碱杆菌属、副球菌属、紫色杆菌属、赤细菌属5种菌为主,富集后以产碱杆菌属、副球菌属、紫色杆菌属3种属为主,副球菌属是唯一通过2种办法获得确认反硝化聚磷功能的菌株,国内外尚未见报道。
(3) Sludge bio-membrane(SB)同步脱氮除磷系统中采用PCR-DGGE法获得的菌株与优势菌不同,16S rDNA克隆文库方法获得的菌株更为丰富,但是,proteobacteria门为主在脱氮除磷的系统中都占优势。
[1] Meinhold J, Filipe C D M, Daigger G T, et al. Characterization of the denitrifying fraction of phosphate accumulating organisms in brological phosphate removal process[J]. Wat Sci-Tech, 1999,39(1): 31-42.
[2] Kuba T, van Loosdrencht M C M, Brand F A, et al. Occurrence of denitrifying phosphorus removing bacteria in modified UCTtype wastewater treatment plants[J]. Water Research, 1997,31(4): 777-786.
[3] Kuba T, van Loosdrecht M C M, Heijnen J. Phosphorus and nitrogen removal with minimal COD requirement by integration of denitrifying dephosphatation and nitrification in a two-sludge system[J]. Water Research, l996, 30(7): l702-l7l0.
[4] 周康群, 刘晖, 孙彦富, 等. 反硝化聚磷菌的 SBR 反应器中微生物种群与浓度变化[J]. 中南大学学报: 自然科学版, 2008,39(4): 705-711.ZHOU Kang-qun, LIU Hui, SUN Yan-fu, et al. Change of microorganism amount and species in SBR reactor enriching denitrifying phosphate bacteria[J]. Journal of Central South University: Science and Technology, 2008, 39(4): 705-711.
[5] 周康群, 刘晖, 孙彦富, 等. A2/O厌氧段中聚磷菌的反硝化聚磷生物学特性及特性利用影响因素研究[J]. 中南大学学报:自然科学版, 2007, 38(4): 645-649.ZHOU Kang-qun, LIU Hui, SUN Yan-fu, et al. Denitrifying phosphorus accumulation characteristic of PAO from A2/O anaerobic stage and affecting factor of characteristic utilization[J]. Journal of Central South University: Science and Technology, 2007, 38(4): 645-649.
[6] 罗宁, 罗固源, 吉方英, 等. 新型双泥生物反硝化除磷脱氮系统中微生物的组成[J]. 中国给水排水, 2003, 29(8): 33-35.LUO Ning, LUO Gu-yuan, JI Fang-ying, et al. Microbial buildup on new two-sludge system for nitrogen and phosphorus removal[J]. China Water and Wastewater, 2003, 29(8): 33-35.
[7] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M] . 北京: 科学出版社, 2001: 164-169.DONG Xiu-zhu, CAI Miao-ying. Manual of ordinary systemic bacteriology[M]. Beijing: Science Press, 2001: 164-169.
[8] 王爱杰, 任南琪. 环境中的分子生物学诊断技术[M]. 北京:化学工业出版社, 2004: 132-165.WANG Ai-jie, REN Nan-qi. Diagnosis technology of molecular biology in the environment[M]. Beijing: Chemical Industry Press, 2004: 132-165.
[9] 李军, 杨秀山, 彭永臻. 微生物与水处理工程[M]. 北京: 化学工业出版社, 2003: 360-361.LI Jun, YANG Xiu-san, PENG Yong-zhen. Microbiology and water treatment engineering[M]. Beijing: Chemical Engineering Press, 2003: 360-361.
[10] Chen B Y, Janes H W. PCR cloning protocols[M]. Totowa:Humana Press, 2002: 33-45.
[11] van Trappen S, Vandecandelaere I, Mergaert J, et al.Flavobacterium degerlachei sp. nov., Flavobacterium frigoris sp.nov. and Flavobacterium micromati sp. nov., novel psychrophilic bacteria isolated from microbialmats in Antarctic lakes[J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54: 85-92.
[12] van Trappen S, Tan T L, Samyn E, et al. Flavobacterium frigoris sp. Alcaligenes aquatilis sp. nov., a novel bacterium from sediments of the Weser Estuary, Germany, and a salt marsh on Shem Creek in Charleston Harbor, USA[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55:2571-2575.
[13] 鲍林林, 李相昆, 李冬, 等. 双污泥脱氮除磷系统中聚磷菌的特性研究[J]. 中国给水排水, 2008, 24(7): 4-7.PAO Lin-lin, LI Xiang-kun, LI Dong, et al. Study on characteristics of phosphorus accumulating organisms in a continuous flow two sludge system for nitrogen and phosphorus removal[J]. China Water and Wastewater, 2008, 24(7): 4-7.
[14] 焦中志, 李相昆, 张立成, 等. 反硝化聚磷菌菌种筛分与除磷特性分析[J]. 沈阳建筑大学学报: 自然科学版, 2009, 25(3):535-539.JIAO Zhong-zhi, LI Xiang-kun, ZHANG Li-cheng, et al.Isolation and characteristic of denitrifying phosphorus accumulating organism[J]. Shenyang Architectural University:Science and Technology, 2009, 25(3): 535-539.
[15] 刘亚男, 夏圣骥, 于水利. 不同碳源强化生物除磷系统的PCR-DGGE分析[J]. 哈尔滨工业大学学报, 2007, 39(4):589-593.LIU Ya-nan, XIA Sheng-ji, YU Shui-li. Application of polymerase chain reaction-denaturing gradient gel electrophoresis to analyze biological phosphorus removal systems fed with different carbon sources[J]. Journal of Harbin Institute of Technology, 2007, 39(4): 589-593.
[16] Kampfer P, Falsen E, Busse H J. Reclassification of Pseudomonas mephitica Claydon and Hammer 1939 as a later heterotypic synonym of Janthinobacterium lividum (Eisenberg 1891) de Ley et al. 1978[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58: 136-138.
[17] 宋朝霞, 张颖. 一株产聚乙烯醇降解酶的紫色杆菌的发酵条件研究[J]. 高校化工学报, 2006, 20(5): 769-774.SONG Zhao-xia, ZHANG Ying. Optimization of fermentation conditions for a pva-degrading enzyme producing strain[J].Journal of Chemical Engineering of Chinese Universities, 2006,20(5): 769-774.
[18] Yoon J H, Oh T K, Park Y H. Erythrobacter seohaensis sp. nov.and Erythrobacter gaetbuli sp. nov., isolated from a tidal flat of the yellow sea in Korea[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55: 71-75.
[19] 蒋轶峰, 朱润晔, 郑建军. 亚硝酸为电子受体的反硝化除磷工艺特性[J]. 中国环境科学, 2008, 28(12): 1094-1099.JIANG Yi-feng, ZHU Yun-ye, ZHENG Jian-jun. Feasibility of denitrifying phosphorus removal technique using nitrite as electron acceptor[J]. China Environmental Science, 2008, 28(12):1094-1099.
[20] Ahn J, Daidou T, Tsuneda S, et al. Characterization of denitrifying phosphate-accumulating organisms cultivated under different electron acceptor conditions using polymerase chain reaction-denaturing gradient gel electrophoresis assay[J]. Water Research, 2002, 36: 403-412.
[21] Tsuneda S, Miyauchi R, Ohno T. Characterization of denitrifying polyphosphate-accumulating organisms in activated sludge based on nitrite reductase gene[J]. Journal of Bioscience and Bioengineering, 2005, 99(4): 403-407.
[22] Tsuneda S, Ohno T, Soejima K, et al. Simultaneous nitrogen and phosphorus using denitrifying phosphate-accumulating organisms in a sequencing batch reactor[J]. Biochemical Engineering Journal, 2006, 27: 191-196.
[23] 王海燕, 周岳溪, 戴欣, 等. 16SrDNA 克隆文库方法分析MDAT2IAT同步脱氮除磷系统细菌多样性研究[J]. 环境科学学报, 2006, 26(6): 903-911.WANG Hai-yan, ZHOU Yue-xi, DAI Xin, et al. Bacterial diversity study for the simultaneous nitrogen and phosphorus removal system (MDAT2IAT) by 16S rDNA cloning method[J].Acta Scientiae Circumstantiae, 2006, 26(6): 903-911.
- 中南大学学报(自然科学版)的其它文章
- 垂序商陆对污染水体重金属去除潜力的研究
- 高锰酸钾氧化嗅味物质β-环柠檬醛的动力学

