鹿流行性出血病病毒双抗夹心ELISA方法的建立
陈 兵,李健波,杨俊兴,阮周曦,孙 洁,张彩虹,刘建利,花群义*,周晓黎
(1.深圳出入境检验检疫局,广东深圳518001;2.云南出入境检验检疫局,云南昆明650228)
鹿流行性出血病病毒双抗夹心ELISA方法的建立
陈 兵1,李健波1,杨俊兴1,阮周曦1,孙 洁1,张彩虹1,刘建利1,花群义1*,周晓黎2
(1.深圳出入境检验检疫局,广东深圳518001;2.云南出入境检验检疫局,云南昆明650228)
为建立鹿流行性出血病病毒(EHDV)病原学检测方法,用纯化的抗EHDV特异性单克隆抗体包被ELISA板,用兔抗EHDV IgG作为夹心抗体,IgG作为夹心抗体建立EHDV双抗夹心ELISA方法,并对该方法的特异性和敏感性进行了试验。用ELISA分别检测EHDV、蓝舌病病毒(BTV)、水疱性口炎病毒(VSV)、赤羽病病毒(AKV)、小反刍兽疫病毒(PPRV)样品,用RT-PCR作对照。结果表明,ELISA具有良好的特异性和敏感性。用夹心ELISA和RT-PCR同时检测128份参考样品,结果表明夹心ELISA的特异性和敏感性分别为100%和96.3%,两种方法的符合率为99.2%。本研究结果为EHDV检测及鹿流行性出血病流行病学调查提供了有效的工具。
鹿流行性出病;鹿流行性出病病毒;双抗体夹心ELISA;单克隆抗体
*通讯作者
鹿流行性出血病(Epizootic hemorrhagic disease of deer,EHD)是由鹿流行性出血病病毒(EHDV)引起的,以引起白尾鹿体温升高、黏膜和浆膜广泛出血并常处于昏迷状态下死亡为特征的致死性虫媒传染病,牛和羊也可以感染发病。流行期时,此病危害较大,严重影响畜牧业和国际贸易的发展[1]。由于EHDV在周边国家(如日本、朝鲜)都曾暴发过,存在EHDV传入我国的风险。因此,EHD是我国进出口贸易中需要监测的重要疫病。
EHDV属呼肠病毒科(Reoviridae)环状病毒属(Obivirus),是节肢动物源(主要是库蠓)的双股RNA病毒[2]。EHDV由10个片段(1~10)组成,编码7个结构蛋白(VP1-7)和3个非结构蛋白(NS1、NS2、NS3/NS3A)[3]。VP7蛋白是 EHDV 的群特异性抗原,由S7基因编码,基因全长1 162bp,编码349个氨基酸残基[4]。
目前,常用的EHDV检测方法有琼脂扩散试验(AGID)和RT-PCR方法[5]。由于EHDV与BTV之间有很强的免疫学交叉反应[6],因此,AGID的特异性很差。本研究中用EHDV特异性单克隆抗体包被ELISA板,用于捕获EHDV,用兔抗EHDV IgG作为夹心抗体,建立了检测EHDV双夹心ELISA方法。通过对EHDV阳性样品、阴性样品、其他病毒阳性样品及参考样品的检测,结果表明该ELISA方法具有良好的特异性和敏感性,该方法可以用于EHDV快速检测。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞株及实验动物 EHDV(血清1型~8型)、蓝舌病病毒(BTV)1、3、10和17血清型、新泽西型水疱性口炎病毒(VSV-NJ)、赤羽病病毒(AKV)、小反刍兽疫病毒(PPRV)等灭活抗原(经BHK-21细胞增殖)和BHK-21细胞均由深圳出入境检验检疫局动植物检验检疫技术中心动检实验室保存。3月龄新西兰家兔购自广东省医学实验动物中心。
1.1.2 主要试剂、材料及试剂盒 HRP标记羊抗兔IgG为Sigma公司产品,可溶型单组分TMB底物溶液为 Millipore公司产品,96孔(8孔×12条)ELISA微孔板为Costa公司产品,蛋白A/G抗体纯化试剂盒为Pierce公司产品。
1.1.3 单克隆抗体 鼠源抗EHDV单克隆抗体(1A5和8H6),由本实验室先前制备并保存[7]。经实验验证2株单克隆抗体具有良好的特异性,与BTV、VSV、AKV、PPRV无交叉反应性。2株单克隆抗体(1A5和8H6)腹水效价分别为1∶1 024 000和1∶2 048 000。经抗体亚型鉴定,1A5和8H6均属于IgG1,轻链均为κ。
1.2 方法
1.2.1 单克隆抗体的纯化 将腹水用蛋白A/G抗体纯化化试剂盒进行纯化,用DU-600核酸蛋白分析仪测定蛋白含量,用50mmol/L PBS(pH7.2)将纯化的IgG稀释至1mg/mL,置-70℃保存备用。1A5和8H6,以等比例混合后包被96孔ELISA板。1.2.2 兔抗EHDV IgG的制备及纯化 用差速离心和蔗糖梯度离心法对经BHK-21细胞增殖的EHDV(血清1型,经甲醛灭活)进行纯化[8],并用PBS稀释至2mg/mL。用纯化的EHDV免疫接种3月龄新西兰家兔,每隔2周免疫接种1次,共免疫接种4次,前3次注射剂量为EHDV抗原1mg,第4次注射剂量为EHDV抗原2mg。首免时加等体积弗氏完全佐剂乳化,二免和三免时加等体积弗氏不完全佐剂乳化[9-10]。最后一次免疫后15d,经耳静脉采血并分离血清,间接ELISA检测抗体效价。若效价达到1∶5 000以上,通过颈动脉放血,分离血清。蛋白A/G抗体纯化试剂盒纯化IgG,用DU-600核酸蛋白分析仪测定蛋白含量,将其稀释至1mg/mL,于-70℃保存备用。
1.2.3 双抗夹心ELISA的建立 用碳酸盐缓冲液(Na2CO31.59g,NaHCO32.93g,H2O 1 000mL,pH9.6)将纯化后的抗EHDV单克隆抗体(1A5和8H6)稀释至0.01mg/mL(由方阵滴定试验得出的最佳包被浓度,详细数据本文未列出),包被ELISA板(50uL/孔),4℃ 过夜,用洗涤液 (含 5mL/L Tween-20的PBS,PBST,pH7.2,)洗3次。加入30 mg/mL BSA溶液(200μL/孔),37℃封闭1h。用PBST洗3次,加入待检样品50μL/孔,同时用BHK细胞培养物作为阴性对照,37℃反应30min,加入1∶500稀释的兔抗EHDV IgG,50μL/孔,37℃反应30min,用PBST洗3次,加入1∶5 000稀释的HRP标记羊抗兔IgG,37℃反应30min,用PBST洗3次,最后加入底物溶液,50μL/孔,室温反应10min,用0.2mol/L H2SO4溶液终止反应,检测OD450值。
1.2.4 ELISA结果判定标准的确定 用建立的ELISA检测30份EHDV阴性样品,测定OD450值,计算平均值(X)和标准差(SD),以OD450值X+2SD作为阳性和阴性的分界线。
1.2.5 ELISA方法的特异性 用建立的ELISA分别检测EHDV(血清1型~8型)标准阳性样品(灭活抗原)各10份和其他病毒阳性样品(灭活抗原)及阴性样品各10份,评价ELISA的特异性。
1.2.6 参考样品检测 128份参考样品为本实验室保存的经BHK增殖EHDV阳性样品、其他病毒阳性样品及阴性样品(多种正常同细胞培养物)。检测时,用超声波将收集细胞培养物破碎,离心后取上清用ELISA检测,同时用PT-PCR作为对照,来评价ELISA的相对特异性和敏感性及ELISA与RTPCR检测结果的符合率。
1.2.7 重复性试验 从同一批试剂盒随机取5个,分别检测5份阳性样品(灭活抗原)和5份阴性样品,计算批内变异系数。批间重复性试验用4批试剂盒同时检测5份标准阳性样品(灭活抗原)和5份阴性样品,计算批间变异系数。
1.2.8 RT-PCR方法 根据EHDV NS3基因设计EHDV特异引物[11],上游引物和下游引物序列分别为 5′-CGTGTAGAGTTGACAGCG-3 和 5-TGTCACACTCATTCGTAC-3′。用 Trizol提取法提取RNA,用宝生物工程(大连)有限公司一步法RTPCR试剂盒进行扩增。PCR反应体系为25μL,扩增程序为45℃反转录60min;94℃预变性3min;94℃30s,56℃30s,72℃30s,40个循环;最后72℃延伸5min。PCR反应完成后,取10μL PCR产物,于15g/L琼脂糖凝胶中进行电泳分析。
2 结果
2.1 ELISA结果判定标准的确定
用ELISA检测30份EHDV阴性样品,测定OD450值,平均值为0.183,标准差为0.031,根据公式X+2SD计算,阳性和阴性结果判定的临界值为0.245(详细数据本文未列出)。
2.2 ELISA特异性试验结果
用ELISA分别检测EHDV(血清1型~8型)标准阳性样品各10份,结果全为阳性。用ELISA试剂盒检测BTV(血清1、3、10和17型)、VSV-NJ、PPRV、AKV阳性样品各10份及阴性样品10份,结果全为阴性,表明该ELISA具有良好的特异性(表1)。
2.3 重复性试验结果
从同一批ELISA试剂盒(20100925)中随机取5个分别对10份样品进行检测,结果批内变异系数在2.48%~8.51%之间(表2),表明ELISA批内重复性良好。用4批ELISA试剂盒(20100925、20101030、20101208和20110215)同时检测10份样品,结果批间变异系数在4.10%~8.77%之间(表3),表明ELISA批间重复性良好。
2.4 参考样品检测结果
用建立的ELISA和RT-PCR检测参考样品128份,其中ELISA检测26份阳性样品,102份为阴性;RT-PCR检测27份为阳性,101份为阴性。26份两种方法检测均为阳性,101份两种方法检测均为阴性。特异性为(101/101)×100%=100%;敏感性为(26/27)×100%=96.3%;符合率为[(26+101)/128]×100%=99.2%。计算得出 ELISA 的特异性和敏感性分别为100%和96.3%;两种方法检测结果的符合率为99.2%(表4)。
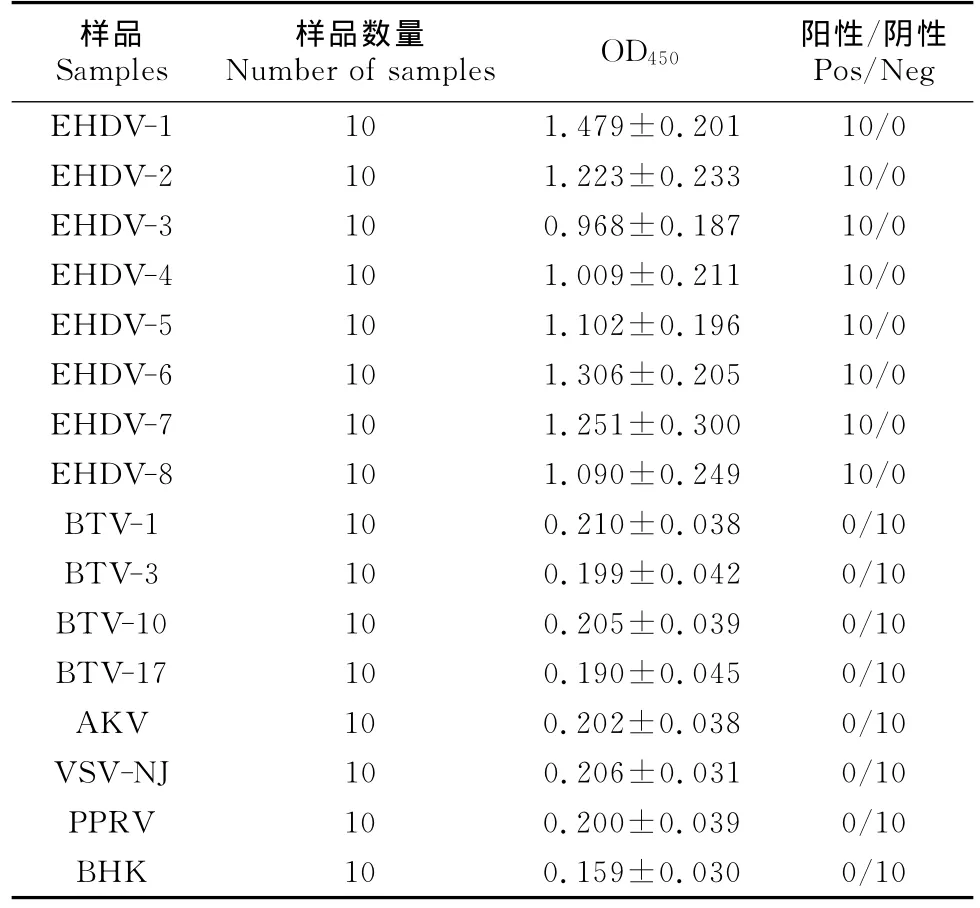
表1 特异性试验结果Table 1 Results of specificity test
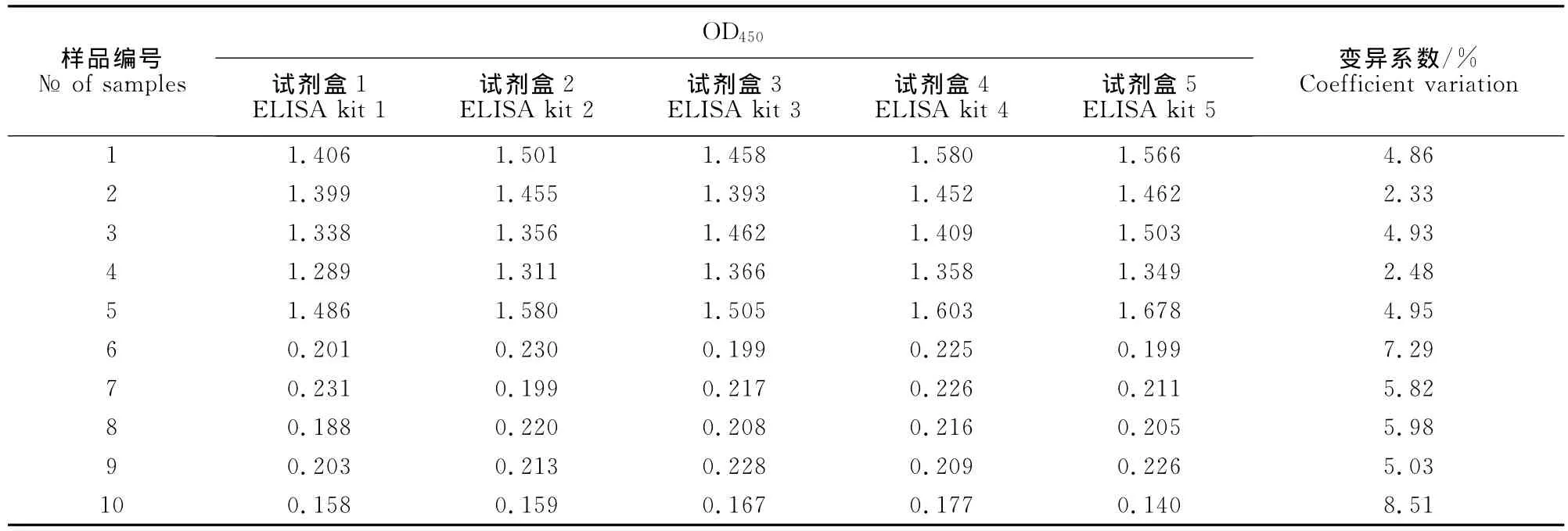
表2 批内重复性试验结果Table 2 Results of reproducibility tests within a batch
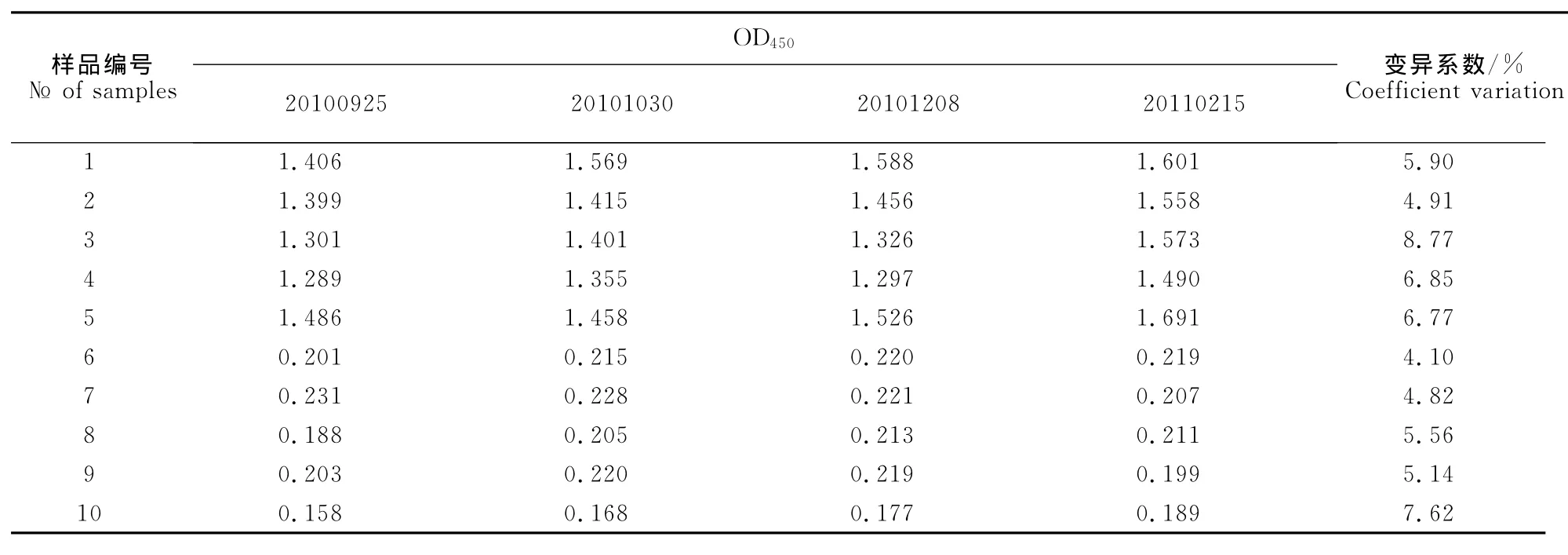
表3 批间重复性试验结果Table 3 Results of reproducibility tests among batches

表4 临床样品检测结果Table 4Results of reference samples tested by ELISA and RT-PCR
3 讨论
本研究选用前期自行制备的抗EHDV特异性单克隆抗体(1A5和8H6)作为第一抗体,包被96孔ELISA板,用于捕获样品中的EHDV,用兔抗EHDV IgG作为第二抗体,建立了检测EHDV双抗夹心ELISA方法。通过对EHDV阳性样品、阴性样品、其他病毒阳性样品和参考样品进行检测,并用RT-PCR作为对照方法,结果表明该方法具有很好的特异性和敏感性。
单克隆抗体是重要的免疫学工具,在病原的生物学特性、抗原性研究及病原的检测、治疗、免疫机制研究等方面均具有重要应用价值。在建立病原学诊断方法中,单克隆抗体的特异性直接决定着所建立诊断方法的特异性。因此,在建立EHDV双抗夹心ELISA方法时,作者选用单抗作为第一抗体包被ELISA板,来捕获样品中的抗原。也有学者用多抗作为第一抗体,在本研究中,作者曾试用兔抗EHDV IgG包被ELISA板,用抗EHDV单克隆抗体作为第二抗体,结果发现,在检测时OD450值较低,可能是由于用多抗作为第一抗体与EHDV抗原反应后,减少了与单克隆抗体结合的表位,导致抗原与第二抗体(单抗)结合的效率降低,在一定程度上降低检测方法的敏感性[6]。
目前,常用的EHDV检测的免疫方法是琼脂扩散试验方法,但由于EHDV和BTV之间存在较强的免疫学交叉反应[6-7]。导致琼脂扩散试验的特异性较低。本研究中,使用EHDV特异性单克隆抗体包被ELISA板,用抗EHDV IgG作为夹心抗体建立了ELISA方法,检测BTV(血清1、3、10和17型)时,没有交叉反应,表明本研究所建立方法的特异性优于较琼脂扩散试验。因此,该方法可以用于EHDV检测及EHD流行病学调查。另外,由于我国境内目前还没有EHD流行的报道,该ELISA方法可用于进口动物EHDV的检测,有利于防止境外EHD传入我国。
[1] Temizel E M,Yesilbag K,Batten C,et al.Epizootic hemorrhagic disease in cattle,Western Turkey[J].Emerg Infect Dis,2009,15(2):317-319.
[2] 殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:549-554.
[3] 陈志飞,李树清.鹿流行性出血热病毒[J].中国进出境动植检,1996(4):31-33.
[4] Iwata H,Chuma T,Roy P.Characterization of the genes encoding two of the major capsid proteins of Epizootic haemorrhagic disease virus indicates a close genetic relationship to bluetongue virus.[J].J Gen Virol,1992,73(4):915-924
[5] Mecham J O,Jochim M M.Development of an enzyme-linked immunosorbent assay for the detection of antibody to Epizootic hemorrhagic disease of deer virus[J].J Vet Diagn Invest,2000,12(2):142-145.
[6] 杨俊兴,花群义,陈焕春,等.检测蓝舌病病毒双抗夹心ELISA方法的建立[J].中国兽医科学,2009,39(1):50-53.
[7] 郭莹洁,杨俊兴,花群义,等.鹿流行性出血病病毒单克隆抗体的制备与生物学特性鉴定[J].动物医学进展,2009,30(3):14-17.
[8] Thevasagayam J A,Wellby M P,Mertens P P,et al.Detection and differentiation of epizootic haemorrhagic disease of deer and bluetongue viruses by serogroup-specific sandwich ELISA[J].J Virol Methods,1996,56(1):49-57.
[9] 董昕欣,郭 鑫,杨汉春,等.猪脑心肌炎病毒VP1蛋白单克隆抗体的制备及鉴定[J].中国兽医科学,2007,37(1):24-28.
[10] 侯 强,彭伍平,孙 元,等.猪瘟病毒E2蛋白主要抗原区编码基因的原核表达及其单克隆抗体的制备[J].中国兽医科学,2008,38(1):1-5.
[11] Aradaib I E,Wilson W C,Schore C E,et al.PCR detection of North American and Central African isolates of Epizootic hemorrhagic disease virus(EHDV)based on genome segment 10of EHDV serotype 1[J].J Clin Microbiol,1998,36(9):2604-2608.
Establishment of Sandwich ELISA for Epizootic Hemorrhagic Disease of Deer Virus
CHEN Bing1,LI Jian-bo1,YANG Jun-xing1,RUAN Zhou-xi1,SUN Jie1,ZHANG Cai-hong1,LIU Jian-li1,HUA Qun-yi1,ZHOU Xiao-li2
(1.ShenzhenEntry-ExitInspectionandQuarantineBureau,Shengzhen,Guangdong,518001,China;
2.YunnanEntry-ExitInspectionandQuarantineBureau,Kunming,Yunnan,650228,China)
In order to establish an immunoassay for Epizootic hemorrhagic disease of deer virus(EHDV)detection,a double-antibody sandwich ELISA was developed based on purified monoclonal antibody against EHDV and rabbit anti EHDV polyclonal antibody.This ELISA was used to detect positive samples of EHDV,bluetongue virus(BTV),Vesicular stomatitis virus(VSV),Akabane disease virus(AKV)and Peste des petits ruminants virus(PPRV)and negative samples,and the results indicated that the ELISA had good specificity.This ELISA was also used to test 128reference samples,RT-PCR was used as a reference method,the results showed the specificity and sensitivity were 100%and 96.3%respectively,the agreement ratio between ELISA and RT-PCR was 99.2%.This ELISA is suitable for rapid detection of EHDV infection in ruminants.
Epizootic hemorrhagic disease;Epizootic hemorrhagic disease of deer virus;sandwich ELISA;monoclonal antibody
S854.43
A
1007-5038(2011)10-0001-05
2011-04-12
国家863计划项目(2006AA10Z445);中国博士后科学基金(20080430855)
陈 兵(1981-),男,河南沈丘人,兽医师,主要从事进出口动物疫病检测及外来动物传染病免疫学方法研究。

