丁香胃灵合剂对慢性萎缩性大鼠胃炎SS、Gas、Bax的影响
娄 华,朱耀环,李会朋,李素洁
(1.大连医科大学 2008级研究生,辽宁 大连 116044;2.大连医科大学 附属第二医院 中医科,辽宁 大连 116027;3.大连民族学院 校医室,辽宁 大连 116620)
慢性萎缩性胃炎(CAG)是临床上常见的消化系统疾病,以局限性或广泛性胃黏膜固有腺体的萎缩改变,黏膜层变薄为主要特征。其发病率、癌变率较高,现代医学缺乏理想的治疗方法,而中医药对该病进行辨证论治,在治疗上发挥了其独特的优势。丁香胃灵合剂(CWLM)在临床治疗CAG取得了良好的效果,但其作用机理仍不明确。本研究旨在观察CWLM对CAG模型大鼠生长抑素(somatostatin,SS)、胃泌素(gastrin,Gas)含量及胃黏膜Bax表达的影响,探讨其可能的作用机制。
1 材料和方法
1.1 动 物
健康清洁级 Wistar 大鼠60只,雌雄各半,体重180~230 g,大连医科大学动物实验中心提供。
1.2 实验药物
丁香胃灵合剂组成:丁香、桂枝、砂仁、白芍、白术、川芎、丹参、石斛、黄芪、甘草等组成,由大连医科大学附属第二医院中药房提供。
1.3 试剂及仪器
试剂:氨水含NH325%~28%(沈阳新兴试剂厂);水杨酸钠(天津市化学一厂);兔抗鼠Bax多抗(北京博奥森生物技术公司);SS与Gas ELISA试剂盒(北京博奥森生物技术公司);SP试剂盒(美国ZYMED公司);DAB染色液(美国ZYMED公司)。
仪器:高速离心机HHR21型,北京医用离心机厂;电热恒温水浴箱HWS-20型,江苏太仓市实验设备厂;酶标仪Thermo 354型,美国;光学显微镜Olympus BX-51型,日本。
1.4 方 法
1.4.1 分组:将60只健康Wistar大鼠随机分为5组,即正常组、CAG组、CWLM低剂量组、CWLM中剂量组、CWLM高剂量组,每组12 只。除正常组外各组大鼠采用浓度为2%水杨酸钠溶液按1 mL/100 g灌胃2个月,1次/d,灌胃前后1 h禁食禁水,并自由饮用0.05%的氨水,2 d足量喂食,1 d停食;正常组给予1 mL/100 g体重生理盐水日1次灌胃,自由饮水进食,直至实验结束。造模过程中CAG组死亡1只,CWLM低剂量组、CWLM中剂量组各死亡1只,正常组没有死亡。随机抽取2只大鼠做胃黏膜病理组织学检查,确认造模成功后进行药物干预实验,CWLM低剂量2 g生药/ (kg·d )灌胃,相当于人的临床用量,1次/d;CWLM中剂量组4 g生药/ (kg·d)灌胃,相当于人临床用量的2倍,1次/d;CWLM高剂量组8 g生药/ (kg·d )灌胃,相当于人临床用量的4倍,1次/d;CAG组予1 mL /100 g体重生理盐水1次/d灌胃。各组灌胃均50 d后,处死所有大鼠。
1.4.2 标本中Gas、SS含量的测定:采用摘取眼球法取血,约5 mL/只,离心10 min,留取血清,采用ELISA法按试剂说明书检测Gas、SS含量。
1.4.3 大鼠组织细胞凋亡相关蛋白Bax表达的检测:操作包括两部分:①剖胃取材后,用10%福尔马林固定,按照常规脱水,石蜡包埋,4 μm厚度连续切片;取切片拷至已用多聚赖氨酸防脱片处理的载玻片上,进行常规免疫组织化学染色(按SABC试剂盒说明书的步骤操作,每次实验以PBS代替一抗作阴性对照)。②在光镜下进行观察,每张切片至少观察5个视野,以细胞质或细胞核中出现均匀一致的棕褐色颗粒为阳性细胞。阴性表达:未见棕黄色染色的细胞;运用计算机图像分析仪定量分析大鼠胃黏膜Bax蛋白表达的灰度值,在400倍光镜下,测定阳性细胞灰度。灰度值是反映透光密度的定量指标,其值越高,相应的蛋白表达量越少;反之则表示蛋白表达越多。计算出平均灰度值,即阳性部位灰度值与检测面积之比。
1.5 统计学方法
2 结 果
2.1 血清Gas与SS含量的变化
与正常组比较,CAG组血清Gas和SS含量分别降低和升高,差异均有显著性意义(P<0.01);与CAG组比较,CWLM各治疗组Gas和SS含量分别有所升高和降低,其中低剂量组Gas虽升高,但差异无显著性意义(P>0.05),且仍显著低于正常组;中剂量组Gas升高,差异有显著性意义(P<0.05);而高剂量组Gas显著升高(P<0.01),并接近正常组(P>0.05);各治疗组间相比,差异无显著性意义(P>0.05)。与CAG组比较,CWLM各治疗组SS含量不同程度的降低, 差异有显著性意义(P<0.05或P<0.01),而低剂量组仍显著高于正常组(P<0.01),各治疗组间比较, 高剂量组明显高于低剂量组,差异有显著性意义(P<0.05)。见表1。

表1 各组大鼠血清Gas和SS含量的变化
2.2 胃黏膜Bax表达的变化
大鼠胃黏膜中Bax的平均灰度值在CAG组、CWLM低、中、高各剂量组及正常组各组中的表达呈递减趋势,即相应Bax的表达呈递增趋势。与CAG组比较,CWLM低、中、高剂量组Bax的平均灰度值明显降低,差异有显著性意义(P<0.05或P<0.01),低剂量组与正常组比较,差异有显著性意义(P<0.05)。各治疗组间相比,差异无显著性意义(P>0.05),见图1~5及表2。

图1 CAG组Bax表达(×400)

图2 正常组Bax表达(×400)

图3 CWLM低剂量组 Bax表达(×400)

图4 CWLM中剂量组Bax表达(×400)

图5 CWLM高剂量组Bax表达(×400)
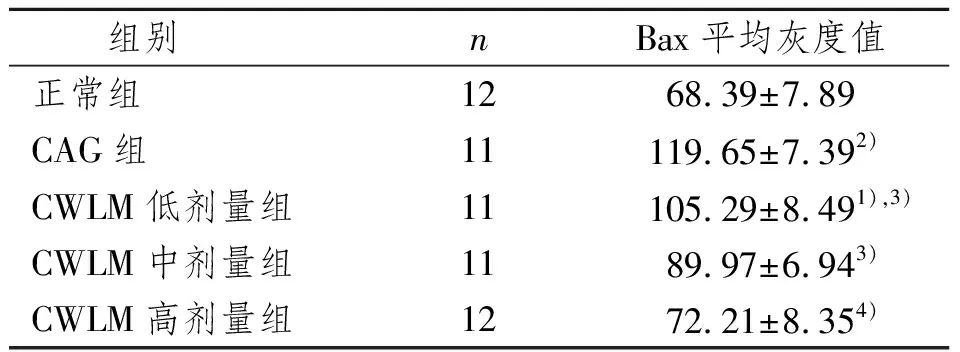
表2 各组大鼠胃粘膜Bax表达的变化
3 讨 论
CAG由多种因素如饮食不节、情志失调等导致脾胃虚弱,久则气滞血瘀,气血不能荣养胃络,胃膜失养,逐渐萎缩,最终形成CAG繁杂的病理改变。本课题组以益气健脾和胃,活血化瘀之法组方丁香胃灵合剂治疗本病,方中以丁香为主药,取其温中降逆、散寒止痛之效,黄芪补脾胃之气,扶正固本,使脾气健运,气血化生有源,白术扶植脾胃,散寒除弊,消食除痞,白芍养血柔肝,缓急止痛,使肝气不犯脾胃。丹参、川芎联用增强活血行气化瘀之效,石斛养胃生津,使胃阴得充,诸药合用可使补中有消,补而不滞,共奏健脾益气、活血化瘀、和胃理气、阴阳和合之效。前期研究已证实CWLM可能通过改善胃黏膜微循环、调节胃肠蠕动和分泌功能、增强免疫力等综合作用来发挥对CAG的治疗作用[1]。
有研究表明CAG癌前病变中存在着胃黏膜营养因子(如Gas)、胃肠激素(如SS等)分泌失调[2]、细胞凋亡异常(如Bax减少等)等因子的异常表达。Gas是由胃及十二指肠G细胞合成、分泌的胃肠道多肽激素,其既能刺激胃酸和胃蛋白酶的分泌,又能通过增加其DNA、RNA及蛋白的合成来刺激胃黏膜细胞的生长,增加胃黏膜血流量,从而发挥营养胃黏膜的功能。CAG患者随着胃窦萎缩的不断加重,G细胞数量不断减少,Gas的含量随之下降[3]。胃肠激素中的SS作为人体内重要的炎症负性调节肽之一[4],主要通过旁分泌、自分泌等不同途径发挥作用。正常情况下,SS不但能抑制胃酸和胃蛋白酶分泌,而且能与Gas组成Gas-SS-胃酸分泌轴,维持胃肠的正常生理功能[5]。CAG大鼠胃黏膜中SS的含量显著高于正常组织[6],SS的异常表达可导致组织细胞生长调节失控,最终形成肿瘤[7]。本实验结果显示:CAG大鼠血清Gas含量下降,而血清SS含量明显升高。经丁香胃灵合剂干预后,Gas含量升高、SS含量下降,CWLM 3种不同剂量呈不同程度的升高血清Gas含量,降低血清SS含量。结合相关文献报道[8],CWLM可通过升高CAG大鼠血清Gas含量,降低血清SS含量,使Gas-SS-胃酸分泌轴正常发挥,促进Gas、胃酸、胃蛋白酶等分泌,纠正低酸状态,发挥其保护胃黏膜、促进腺体的再生、增加胃黏膜血流的作用。且其作用的发挥有明显剂量依赖性,本实验中高剂量组较其它治疗组升高血清Gas含量,降低血清SS含量,发挥治疗作用方面CWLM效果最佳。
Bax是Bcl-2基因家族中极重要的细胞促凋亡基因,Bax在高表达时与Bcl-2形成异源二聚体,促进细胞凋亡,低表达时可使CytC从线粒体中释放,继而激活caspase,以同源二聚体的形式存在,抵消Bcl-2基因的抑制凋亡作用而对细胞凋亡有正向调节作用[9,10]。正常生理状态下,胃黏膜上皮细胞死亡的主要形式是细胞凋亡,黏膜凭借Bax促凋亡与Bcl-2促增殖之间的平衡维持其稳定性[11]。一旦该平衡被打破,则有可能发生病变。目前已有不少文献报道从正常胃黏膜→萎缩性胃炎→肠化生→异型增生→胃癌,Bax表达逐渐减弱,同时细胞凋亡指数逐渐降低,使胃黏膜细胞受损,细胞凋亡减少,那些变异的细胞可能因为凋亡机制得不到正常启动在体内聚集,最终导致肿瘤形成[12]。本实验结果显示:由正常组→CWLM高剂量组→CWLM中剂量组→CWLM低剂量组→模型组,胃黏膜Bax阳性表达呈明显递减趋势;与CAG组比较,CWLM 3种不同剂量均能不同程度的上调Bax表达水平,使Bax与Bcl-2形成异源二聚体,或自身形成同源二聚体,积极促进细胞凋亡,从而在一定程度上促使细胞数目增减平衡,发挥控制甚至逆转CAG病理黏膜改变的作用。且CWLM在抑制CAG大鼠胃黏膜细胞的异常增殖方面呈现一定的剂量反应关系,其中高剂量组效果最明显。
CWLM可通过升高血清Gas含量、降低血清SS含量,上调Bax表达,发挥调节细胞凋亡、调节内分泌功能、修复胃黏膜损伤等作用来实现对CAG大鼠胃黏膜病理改变的修复,达到治疗CAG的目的。且CWLM在治疗CAG方面具有明显的剂量相关性,一定程度上提高药物剂量可以达到更好的治疗效果。
参考文献:
[1] 朱耀环,刁风声,尹伟,等.丁香胃灵冲剂治疗慢性萎缩性胃炎的研究[J].中华实用中西医杂志,2002,2(15):291-292.
[2] 郭昱,郭霞,姚希贤.慢性萎缩性胃炎胃泌素、生长抑素、表皮生长因子、血管活性肠肽的测定及临床意义[J].世界华人消化杂志,2003,11(5):531-534.
[3] 苗明三,张玉林,杨亚蕾.参芪健胃颗粒对大鼠慢性萎缩性胃炎的影响[J].中药药理与临床,2008,24(6):66-68.
[4] Van Grieken NCT, Meijer GA, Zur Hausen A, et al. Increased apoptosis in gastric mucosa adjacent to intestinal metaplasia[J].J Clinical Pathol,2003,56(5):358-362.
[5] Campana D,Nori F,Pagotto U,et al.Plasma acylated ghrelin levels are higher in patients with chronic atrophic gastritis[J].Clin Endocrinol,2007,67(5):761-766.
[6] 朱方石,姒健敏,王良静,等.萎缩性胃炎大鼠胃黏膜主、壁细胞和G、D细胞及外周血胃泌素、生长抑素的变化[J].世界华人消化杂志, 2006,14(34):3261-3267.
[7] 王消冰,王绪,张南征.生长抑素与胃癌[J].世界华人消化杂志,2001,9(10):1185-1189.
[8] 张建强,康美清.慢性萎缩性胃炎黏膜中胃泌素、生长抑素与脾胃虚弱证的相关性研究[J].中国中医急症,2010,19(5):786-787.
[9] 袁红霞,刘彩梅,刘清君,等.善胃Ⅰ号方对胃癌前病变大鼠胃粘膜Bcl-2和Bax蛋白表达的影响[J].中华中医药学刊,2010,28(5):916-917.
[10] Shoff EH,Snyder C,Chandel NS.Bcl-2 family members regulate Anoxia-Induced cell death[J].Antioxid Redox Sign,2007,9(9):1405-1410.
[11] Bartek J,Lukas J.Cell biology.Balancing life-or-death decisions[J].Science,2006,314(5797):261-262.
[12] Lkeda M, Shomori K, Endo K,et al. Frequent occurrence of apoptosis in an early event in the ontogenesis of human gastric carcinoma[J].Virchows Ar,1998,432(1):43-47.

