地塞米松长期间断用药对大鼠骨骼的影响
卢 丽 ,王秀丽 ,蔡惠宁 ,陈 珺 ,杨国柱 ,程 晴 ,李青南 *
1.广东药学院生命科学与生物制药学院,广东广州 510006;2.北京海军总医院门诊部,北京 100048
地塞米松(Dexamethasone,Dex)属于糖皮质激素(Glucocorticoids,GCs)类药物,在临床上应用极为广泛,疗效显著。但Dex的长期、持续使用可造成一系列严重的不良反应,其中包括骨质疏松症,其发病急、病情重,增加了原发病的治疗难度[1]。为使Dex在临床上发挥更好的作用,需寻求一种适当使用Dex的方法,既能够保证原发病治疗的同时,又可以预防药物引发的副作用。本文通过观察长期、间断应用Dex对大鼠骨形态及骨质量的影响情况,来探讨一种能避免骨丢失且可安全应用Dex的方法。
1 材料与方法
1.1 实验动物
3 月龄 SPF 级雄性 SD 大鼠 20只,体重(200±20)g,动物由广州中医药大学实验动物中心供应,质量合格证编号:SCXK(粤)20080020。随机将其分为两组:①NC组,给予等体积的生理盐水;②Dex组,给予地塞米松磷酸钠,0.25 mg/100 g肌注,1周2次,共给药90 d。
1.2 骨标本不脱钙包埋及制片
动物处死前第14、13天和第3、2天分别注射钙黄绿素5 mg/kg作体内荧光标记。实验结束时,取其左胫骨(LT)及左股骨(LF),将 LT 锯出胫骨上段(PTM)和胫骨中段(TX),行不脱钙骨包埋。PTM包埋块切出5 μm和9 μm薄片,切片采用Masson-Goldner Trichrome 染色;TX 段锯出 40 μm 厚片[2]。
1.3 骨组织形态计量学检测
骨组织形态计量学参数分为静态参考和动态参数。静态参数可以分析骨量和骨的结构;而动态参数则可反映骨形成和骨吸收的指标[3]。
1.4 股骨生物力学检测
将股骨置于三点弯曲器内,加载点位于股骨中段测量处,两施压点间距为20 cm,压头以2 mm/min的速率加载,电子万能试验机记录并得出最大载荷,最大应力和最大应变,以反映其生物性能。
1.5 统计学处理
所有数据以均数±标准差(x±s)表示,采用 SPSS 11.5软件包进行分析,运用t检验检测两组之间的变量差异,P<0.05为差异有统计学意义。
2 结果
2.1 Dex对TX骨形态的影响
静态参数示:Dex组皮质骨骨量明显低于NC组,骨髓腔面积增大。动态参数示:Dex不但降低骨外膜的矿化沉积率、荧光周长百分率和骨形成率,且还使骨内膜的矿化沉积率和骨形成参数降低。另外,Dex还促进了骨内膜的骨吸收。见表1。
2.2 Dex对PTM骨形态的影响
与NC组相比,Dex并没使PTM静态参数出现明显变化,见表2。但Dex造成了PTM动态参数的改变,使骨矿化率及成骨细胞周长百分率明显降低,差异具有统计学意义(P<0.05 或 P<0.01),见表 3。
2.3 股骨生物力学检测
两组最大载荷、最大应力与最大应变比较,差异均无统计学意义(P>0.05),见表 4。
3 讨论
以往的实验[4-7]均提示长期持续(0.25 mg/100 g,1 次/d)使用Dex会使大鼠皮质骨和松质骨的骨量都丢失,令全身负荷骨的力学性能下降,骨质量降低。本研究以用药频率为切入点,维持用药剂量不变,频率降为2次/周,给药90 d,采用骨形态计量学与骨生物力学评价长期、间断使用Dex对骨骼的影响。
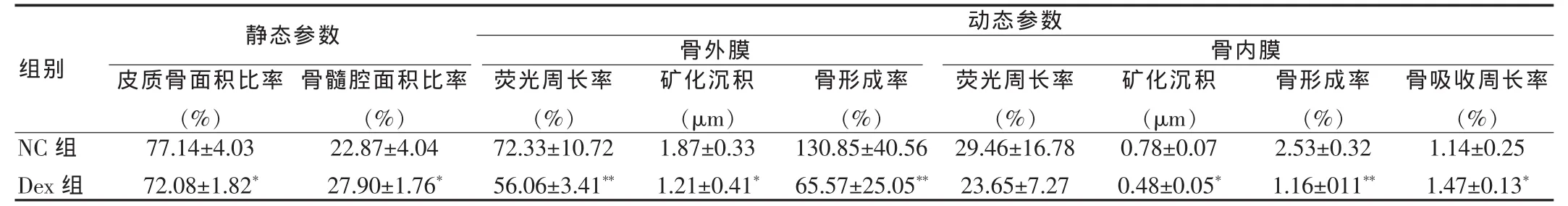
表 1 Dex 对 TX 骨形态的影响(x±s,n=10)

表2 PTM骨形态学静态参数的比较(x±s,n=10)
经分析Dex对骨量的影响与用药剂量有关,研究表明高剂量Dex抑制成骨细胞增殖与分化活性,但低剂量Dex呈促进作用[8-9]。因此导致骨丢失是Dex的超生理剂量应用的结果,它使成骨细胞数目减少,分化受抑制,影响成骨细胞的正常功能,使骨形成作用延迟,从而造成骨量丢失。而Dex使用的时间长短是众所周知的另一个原因,临床患者长期持续使用Dex,易致糖皮质激素性骨质疏松症。笔者认为除了Dex的用药剂量和时间,用药频率应该也起关键作用。研究发现长期间断性使用Dex仅使皮质骨骨量丢失,未对松质骨造成明显的影响。Dex对皮质骨的影响主要是使骨内外膜的骨形成减少,同时骨内膜面的骨吸收增加,从而出现皮质骨变薄,骨髓腔增大的情况。然而,这种几何形状的变化,并没有明显改变骨生物力学的性能,使骨质量得以维持。长期、间断应用Dex为何能避免骨丢失的机制仍有待探讨,可能的原因是间断用药减少了Dex对成骨细胞的抑制作用,从而减弱了Dex引起的骨量丢失,维持了骨生物性能。

表3 PTM 骨形态学动态参数的比较(x±s,n=10)

表 4 Dex 对股骨骨生物力学的影响(x±s,n=10)
综上所述,对于Dex这一类药物,用药剂量、时间及频率变化对骨骼的效应不同,提示临床上在需要长期、大量服用Dex时,可考虑采用间歇性用药方法,以减少骨丢失的程度。
[1]Zalavrsa C,Shah S,Birnbaum MJ,et al.Role of apoptosis in glucocorticoidinduced osteoporosis and osteonecrosis[J].Crit Rev Eukaryot Gene Expr,2003,13(2):221-235.
[2]McLaughlin F,Mackintosh J,Hayes BP,et al.Glucocorticoid-induced osteopenia in the mouse as assessed by histomorphometry,microcomputed tomography,and biochemical markers[J].Bone,2002,30(6):924-930.
[3]Li QN,Hu B,Huang LF,et al.Effects of low doses of hydrochloride tetracycline on bone metabolism and uterus in ovariectomized rats[J].Acta Pharmacol Sin,2003,24:599-604.
[4]Hulley PA,Conradie MM,Langeveldt CR,et al.Glucocorticoid-induced osteoporosis in the rat is prevented by the tyrosine phosphatase inhibitor,sodium orthovanadate[J].Bone,2002,31(1):220-229.
[5]李青南,梁念慈,黄连芳,等.醋酸泼尼松对大鼠松质骨和密质骨影响的比较[J].药学学报,1999,34(7):495-497.
[6]King CS,Weir EC,Gundberg CW.Effects of continuous glucocorticoid infu sion on bone metabolism in the rat[J].Calcif Tissue Int,1996,59(3):184-191.
[7]邹丽宜,吴铁.糖皮质激素与骨质疏松[J].中国骨质疏松杂志,2003,9(5):171-181.
[8]Olney RC.Mechanisms of impaired growth:effect of steroids on bone and cartilage[J].Horm Res,2009,72(1):30-35.
[9]ValtaH,LahdenneP,JalankoH,etal.Bonehealthandgrowthinglucocorticoidtreated patients with juvenile idiopathic arthritis[J].J Rheumatol,2007,34(4):831-836.

