CADM1表达下调与大肠腺癌发生发展的关系
陈科全,刘思德,白 杨,张亚历,彭 亮
1.广州医学院第一附属医院消化内科,广东广州510120;2.南方医科大学南方医院消化内科
大肠腺癌是最常见的消化道恶性肿瘤之一,在我国肿瘤死亡率排第五位,近年有明显上升趋势。该病发生发展涉及多种基因的改变,这些基因主要包括三类基因:癌基因、抑癌基因和DNA修复基因。其中,抑癌基因的突变、缺失和沉默失活在大肠癌发生发展中发挥重要的作用。细胞黏附分子1(cell adhesion molecule 1,CADM1)是Kuramochi等在对肺癌研究中发现的,该基因能诱导肿瘤细胞凋亡和抑制癌细胞增殖[1]。CADM1已被证实在人体正常组织中广泛表达,但在多种癌组织中表达减少;且该基因启动子的过甲基化是导致其表达减少的一个重要机制之一[1]。我们研究已发现CADM1在大肠癌发病中也发挥重要作用,启动子的过甲基化也是导致该基因表达下调的主要机制[2]。我们进一步探讨CADM1表达下调与大肠腺癌发生发展的关系。
1 资料与方法
1.1 组织标本 所有大肠腺瘤及正常肠黏膜、大肠腺癌及癌旁非癌组织标本来源于2007年11月~2010年3月在南方医院行结肠镜切除或外科手术切除治疗的患者,标本均经病理学确诊。大肠腺癌43例,大肠腺瘤20例,男30例,女33例,年龄29~83岁,所有患者术前均未接受放化疗。大肠腺癌中低分化7例、中分化21例、高分化15例;11例未发生淋巴结转移,32例发生淋巴结转移;24例未发生远处转移,19例发生远处转移;9例Dukes’A或B期,34例Dukes’C或D期。组织标本分别行两种方法预处理:①置入组织保存液(SIGMA公司),-80℃低温冰箱保存;② 常规10%中性甲醛固定。
1.2 RT-PCR 按Trizol[购自天根生化科技(北京)有限公司]说明书步骤抽提组织标本总RNA;按RT(逆转录)试剂盒(购自Fermentas公司)说明书步骤合成cDNA第一链;参考文献[3-4]由上海英骏生物技术有限公司合成cDNA第一链;并合成引物,CADM1 5'端引物序列(5'-GGTGATGGGCAGAATCTGTTTAC-3'),3'端引物序列(5'-ACCAGGACTGTGATGGTGGTGT-3'),产物为302 bp;GAPDH:5'端引物序列(5'-TGGTATCGTGGAAGGACTCATGAC-3'),3'端引物序列(5'-ATGCCAGTGAGCTTCCCGTTCAGC-3'),产 物 为189 bp。选用Premix Ex TaqTM Hot Start Version(购自Takara公司)进行PCR扩增反应,预变性95℃ 5 min、变性95℃ 45 s、退火60℃ 1 min、扩增72℃ 1 min、反应33个循环。最后72℃延伸10 min。常规琼脂糖凝胶电泳和半定量分析。
1.3 免疫组化 常规组织脱水、透明、浸蜡、包埋、制片、脱蜡及组织水化。运用 EDTA抗原修复液进行抗原修复;每张组织切片3%过氧化氢消除内源性过氧化物酶活性;山羊血清封闭。加小鼠抗人CADM1单克隆抗体(购自SANTA CRUZ BIOTECHNOLOGY公司,工作液浓度1∶50),室温孵育1 h后,置于4℃冰箱过夜;阴性对照组加PBS替代一抗。加辣根酶标记山羊抗小鼠IgG,室温孵育2 h后,常规DAB显色、苏木素复染、切片脱水和透明、封片及结果分析。
1.4 统计学分析 运用SPSS 13.0软件进行统计学分析。计量资料运用独立样本T检验分析;计数资料运用Chi-Square检验、Fisher’s精确检验。P<0.05为差异有统计学意义。
2 结果
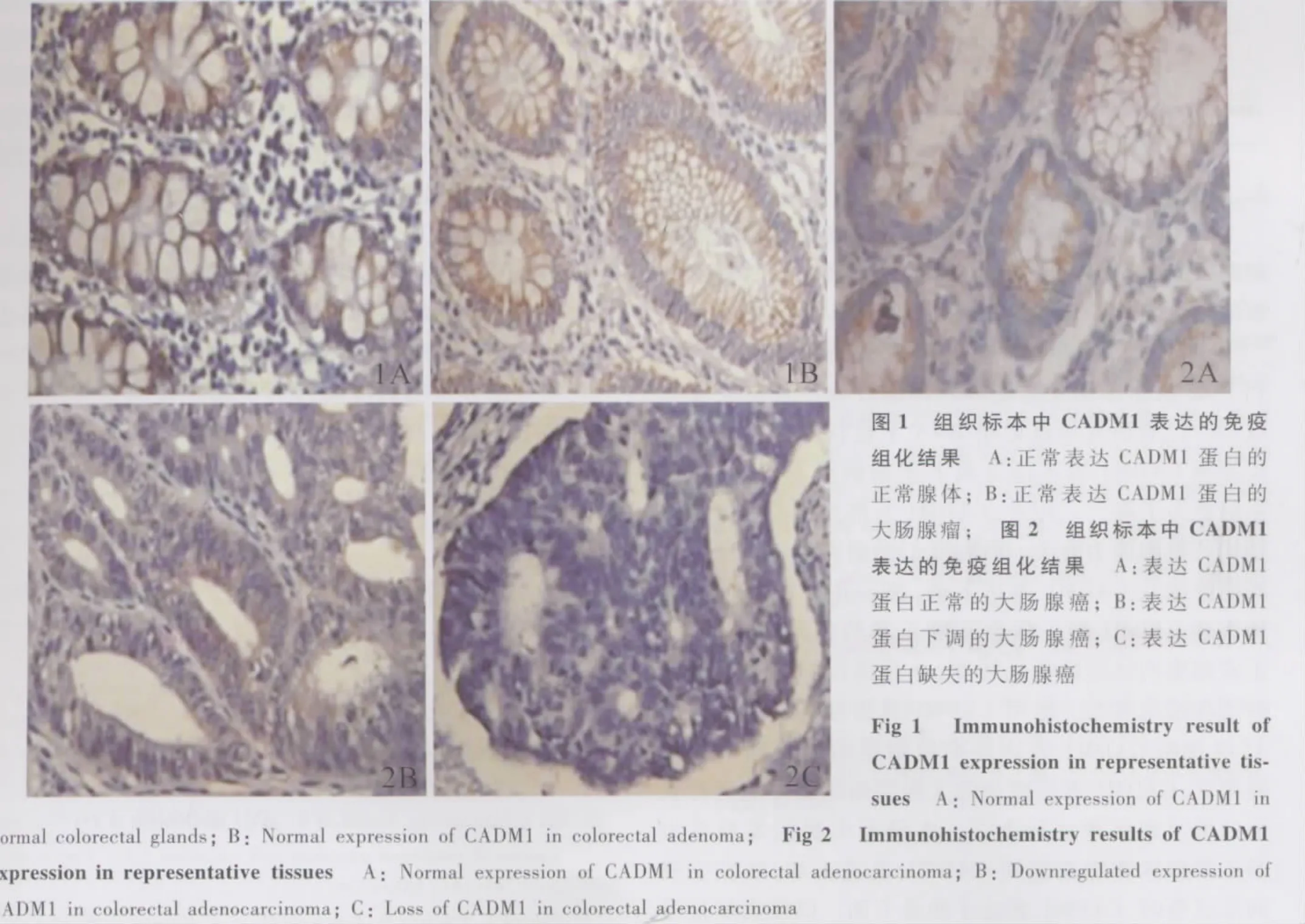
2.1 大肠腺瘤中CADM1的表达 免疫组化结果显示CADM1蛋白在细胞膜及细胞浆均有表达。在20例大肠腺瘤中,CADM1蛋白表达无缺失或明显减少。代表组织mRNA表达灰度比为:正常腺体0.369±0.015,腺瘤0.381±0.034,差异无统计学意义(P>0.05);相应组织免疫组化结果如图1所示。
2.2 大肠腺癌中CADM1的表达 43例大肠癌组织中,8例CADM1表达正常,17例表达减少,18例表达缺失;所有癌旁非癌组织CADM1均正常表达。代表组织CADM1 mRNA表达灰度比如下:代表组织A中非癌组织0.311±0.057,大肠腺癌组织 0.332±0.026,差异无统计学意义(P>0.05);代表组织B中非癌组织0.279±0.028,大肠腺癌组织 0.098±0.050,差异有统计学意义(P<0.05);代表组织C中检测不到CADM1表达。相应组织免疫组化结果如图2所示。
2.3 大肠腺癌CADM1表达下调与患者临床特征的关系 30例淋巴结转移患者检测到CADM1表达下调,5例无淋巴结转移患者检测到CADM1表达下调,两组比较差异显著(P<0.05)。Dukes’C期和Dukes’D期患者CADM1表达下调频率显著高于Dukes’A期和Dukes’B期患者(P<0.05)。CADM1表达下调与性别、T分期、组织分化、远处转移无显著相关,与淋巴结转移及Dukes’分期显著相关(见表1)。
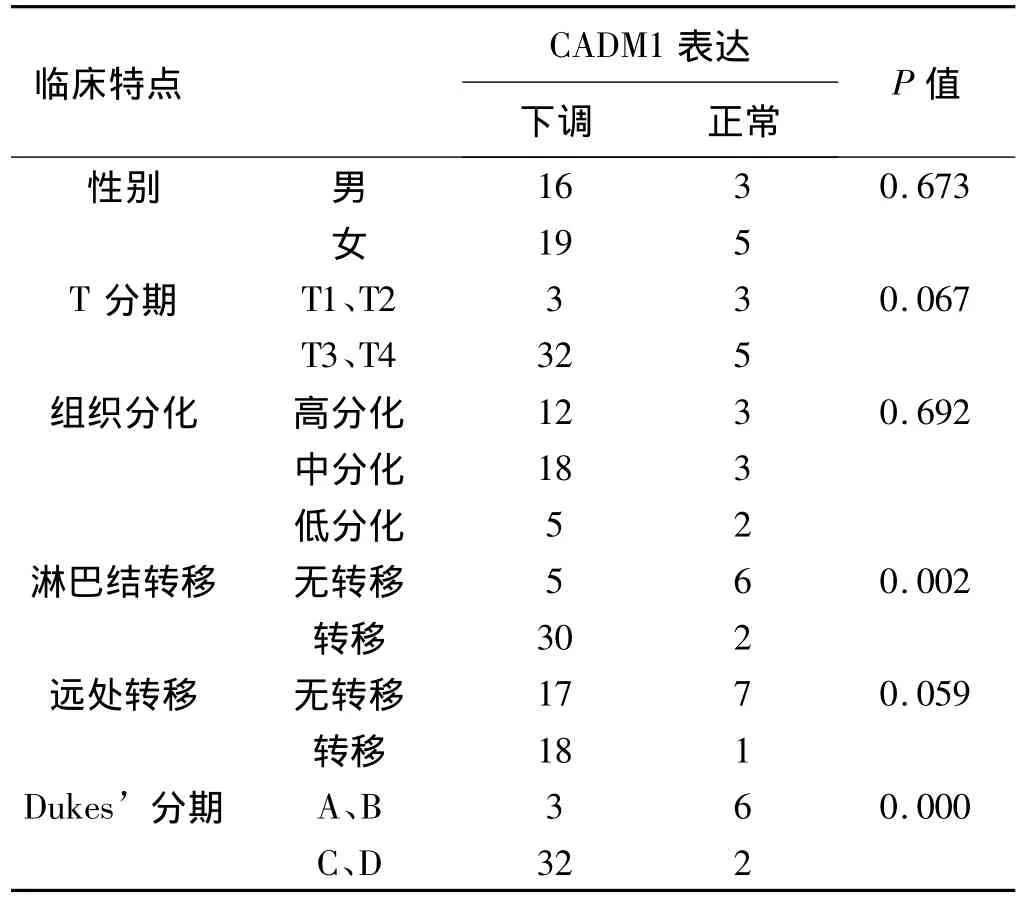
表1 CADM1表达下调与大肠腺癌临床特征的关系Tab 1 Correlation between downregulated expression of CADM1 and clinicopathological characteristics of patients with colorectal adenocarcinoma
3 讨论
CADM1是一种在非小细胞肺癌被发现的肿瘤抑制基因,CADM1可以通过抗增殖及促凋亡活性抑制肿瘤的生长,CADM1功能丧失能导致癌细胞浸润及转移[5]。Mao等已证明CADM1胞浆侧的FERM结合区和PDZ相互作用亚基是体内抑制肿瘤活性的重要区域[6]。已有研究报道运用RNA干扰技术抑制正常上皮细胞CADM1表达能导致上皮细胞形态改变,并使黏附能力下降[7]。因此,CADM1与维持正常上皮细胞结构的黏附能力有关。既往我们的研究发现有部分大肠癌细胞系CADM1表达下调,提示正常大肠上皮细胞表达CADM1减少后会影响正常的黏附功能,导致正常细胞向癌细胞特征转变,并获得浸润及远处转移的恶性细胞表型。运用CADM1重组腺病毒载体增加A549细胞CADM1表达能抑制细胞的增殖和诱导细胞凋亡,CADM1表达减少的大肠腺癌细胞可能具有较强的增殖和抗凋亡行为[5]。本研究中我们发现在大肠正常腺体和腺瘤组织CADM1表达正常,当发生浸润形成癌时,CADM1表达才明显下调。以往文献报道CADM1 表达下调在食管癌[3]、胃癌[8]、胰腺癌[9]、乳腺癌、非小细胞肺癌[7]及卵巢癌中也被发现。因此,CADM1在上皮肿瘤的发生发展中发挥着重要作用。
既往我们的研究发现在大肠腺癌中CADM1启动子甲基化对沉默该基因表达发挥很关键的作用。这与胰腺癌[9]、胃癌[8]和非小细胞肺癌[1]的研究结果一致。但是,Borinstein等报道在氧化偶氮甲烷诱导结肠癌的啮齿动物模型中结肠癌组织和相邻正常肠黏膜均无CADM1启动子甲基化[10]。这点不同可能是由于不同物种或实验引物和/或人和小鼠具有不同大肠癌发病机制有关。
本研究发现CADM1表达下调在发生淋巴结转移的患者更常见,这说明CADM1可能抑制大肠腺癌细胞的侵袭和浸润[5]。同时,研究结果也显示CADM1表达下调在Dukes’C和D期患者比Dukes’A和B期患者更常见,这也与既往我们研究发现CADM1启动子过甲基化在晚期患者更常见的结果一致。因此,随着大肠癌病情的进展,CADM1下调更明显,导致了肿瘤细胞侵袭和转移能力逐渐增强,更加重和加快了病情发展。类似结果也在其他肿瘤发现,在非小细胞肺癌中pT2期比 pT1期 CADM1下调明显[7];乳腺癌3级肿瘤较1、2级肿瘤CADM1下调明显;食管鳞状细胞癌组织中肿瘤分期恶性程度越高CADM1表达缺失发生率越高[3];肺腺癌中肿瘤浸润、淋巴结转移、淋巴管和血管浸润越明显CADM1表达越少;这些结果均表明CADM1表达状态可能是预测早期大肠腺癌向进展期发展风险的有价值指标。尽管如此,我们现在的研究结果尚不能提供足够的证据说明这个问题。
综上所述,研究结果表明CADM1表达下调在大肠腺癌中是常见现象,特别是在进展期大肠腺癌,因此在人大肠腺癌发病机制中该基因发挥重要作用。通过检测高级别上皮内瘤变的组织标本CADM1表达的状态,对判断异型细胞浸润行为可能有提示意义。恢复CADM1表达是否能改变癌细胞的行为,能否针对该基因来治疗大肠癌将需要对该基因进行深入研究。
[1]Kuramochi M,Fukuhara H,Nobukuni T,et al.TSLC1 is a tumorsuppressor gene in human non-small-cell lung cancer[J].Nat Genet,2001,27(4):427-430.
[2]Chen K,Wang G,Peng L,et al.CADM1/TSLC1 inactivation by promoter hypermethylation is a frequent event in colorectal carcinogenesis and correlates with late stages of the disease[J].Int J Cancer,2011,128(2):266-273.
[3]Ito T,Shimada Y,Hashimoto Y,et al.Involvement of TSLC1 in progression of esophageal squamous cell carcinoma [J].Cancer Res,2003,63(19):6320-6326.
[4]Fukami T,Fukuhara H,Kuramochi M,et al.Promoter methylation of the TSLC1 gene in advanced lung tumors and various cancer cell lines[J].Int J Cancer,2003,107(1):53-59.
[5]Mao X,Seidlitz E,Truant R,et al.Re-expression of TSLC1 in a nonsmall-cell lung cancer cell line induces apoptosis and inhibits tumor growth[J].Oncogene,2004,23(33):5632-5642.
[6]Mao X,Seidlitz E,Ghosh K,et al.The cytoplasmic domain is critical to the tumor suppressor activity of TSLC1 in non-small cell lung cancer[J].Cancer Res,2003,63(22):7979-7985.
[7]Murakami Y.Involvement of a cell adhesion molecule,TSLC1/IGSF4,in human oncogenesis[J].Cancer Sci,2005,96(9):543-552.
[8]Honda T,Tamura G,Waki T,et al.Hypermethylation of the TSLC1 gene promoter in primary gastric cancers and gastric cancer cell lines[J].Jpn J Cancer Res,2002,93(8):857-860.
[9]Jansen M,Fukushima N,Rosty C,et al.Aberrant methylation of the 5'CpG island of TSLC1 is common in pancreatic ductal adenocarcinoma and is first manifest in high-grade PanlNs [J].Cancer Biol Ther,2002,1(3):293-296.
[10]Borinstein SC,Conerly M,Dzieciatkowski S,et al.Aberrant DNA methylation occurs in colon neoplasms arising in the azoxymethane colon cancer model[J].Mol Carcinog,49(1):94-103.

